
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотно-основное титрованиеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Кислотно-основное титрование Кислотно-основное титрование основано на реакции взаимодействия кислоты и основания, а точнее, ионов Н+ и гидроксильной группы ОН-: Н+ + ОН- ↔ Н2О. В качестве титрантов используют сильные кислоты и основания. Если титрантом является кислота, метод называют ацидиметрия, если основание – алкалиметрия. В водной среде чаще всего титрантом служит соляная кислота HCl и гидроксид натрия NaOH, в неводных средах – хлорная кислота HClO4 и гидроксид тетрабутиламмония (C4H9)4NOH. Прямым кислотно-основным титрованием определяют концентрацию кислот или оснований или содержание элементов, входящих в их состав. Обратным титрованием или косвенными методами находят содержание некоторых солей, например, солей аммония или кальция. Применяя специальные приемы, титруют смеси кислот с их солями, смеси солей и др. В качестве индикаторов используют окрашенные слабые кислоты или основания. Изменение окраски индикатора наступает при определенном значении рН раствора. Кислотно-основные индикаторы
Важно правильно выбрать индикатор; точка эквивалентности должна попадать в интервал перехода окраски индикатора. Например, при титровании слабого основания сильной кислотой точка эквивалентности достигается в кислой среде. В этом случае титрование следует вести в присутствии метилоранжа, изменяющего свой цвет в диапазоне рН 3,0-4,4; фенолфталеин и лакмус дадут большую индикаторную ошибку (раствор будет перетитрован). При титровании слабой кислоты сильным основанием точка эквивалентности достигается в щелочной среде – нужно использовать фенолфталеин. При титровании сильной кислоты сильным основанием и наоборот точка эквивалентности соответствует рН 7; в качестве индикатора выбирают лакмус или фенолфталеин.
На правильность работы индикатора влияет также его концентрация, температура, наличие примесей в анализируемой пробе. Окислительно-восстановительное титрование Окислительно-восстановительное титрование основано на использовании окислительно-восстановительных реакций разного типа. В качестве титрантов применяют растворы веществ, обладающих окислительными или восстановительными свойствами. По своим аналитическим характеристикам метод близок кислотно-основному титрованию, хотя часто скорость реакций сравнительно ниже. Одинаковы и принципы подбора индикаторов: индикатор должен изменять окраску вблизи точки эквивалентности. В качестве индикаторов используют органические вещества, обладающие более слабыми, чем реагенты, окислительными или восстановительными свойствами. Очень сильное влияние на работу индикатора оказывает рН раствора. Интервал перехода окраски окислительно-восстановительного индикатора определяется по формуле: ΔЕ = (Еºинд. – 0,059 m/n рН) ± 0,059/ n, где m – число Н+, n – число электронов, участвующих в полуреакции, Еºинд. – потенциал, зависящий от природы вещества. Окислительно-восстановительные индикаторы
В зависимости от титранта, используемого в анализе, различают несколько вариантов окислительно-восстановительного титрования. 1. Перманганатометрия использует в качестве титранта перманганат калия KMnO4, который является сильным окислителем. Этот метод используется для определения восстановителей: щавелевой кислоты, Fe2+, HNO2, Mn2+, Sn2+ и др. (прямым титрованием), некоторых окислителей: NO3-, K2Cr2O7 (обратным титрованием), многих катионов металлов (титрованием заместителя). 2. Иодометрия использует в качестве титранта раствор йода I2, являющийся окислителем (этот вариант метода называют йодиметрический метод): I2 + 2e =2I-, или раствор KI, являющийся восстановителем (йодометрический метод) 2I- - 2е = I2. Наиболее распространен второй вариант; он используется для косвенного определения многих веществ, восстанавливающих KI. При этом выделяется I2 в количестве, эквивалентном количеству анализируемого вещества. Выделившийся йод оттитровывают стандартным раствором тиосульфата натрия Na2S2O3 I2 + 2 Na2S2O3 = 2NaI + Na2S4O6. В качестве индикатора на йод в обоих вариантах анализа используют раствор крахмала, который в присутствии свободного йода приобретает синюю окраску. 3. Хроматометрия использует в качестве титранта бихромат калия K2Cr2O7, являющийся окислителем: Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O. Индикаторами могут выступать дифениламиносульфокислоты. Реакцию проводят в сильнокислой среде, используя обычно серную кислоту. Этим методом определяют Fe (II), Mn (II), Mn (IV), V (V), Mo (V), ряд анионов, органических веществ и др. Комплексометрическое титрование При комплексометрическом титровании в качестве титрантов используют вещества, способные образовывать прочные комплексы с анализируемым веществом. Наибольшее распространение в аналитической практике получила этилендиаминтетрауксусная кислота – ЭДТА – (НООС - СН2)2 – N- CH2 – CH2 – N – (CH2 – COOH)2 и ее натриевая соль - трилон Б. Этот титрант применяется, прежде всего, для количественного определения катионов металлов (Fe3+, Cr3+, Ca2+, Mg2+ и др.). Молекула ЭДТА реагирует всегда с 1 катионом металлом, т.е. фактор эквивалентности равен 1. В качестве индикаторов часто применяют эриохром черный Т, мурексид и некоторые другие органические вещества. Очень сильное влияние на результаты комплексометрического титрования оказывает рН среды, поэтому чаще всего анализ проводят в среде буферного раствора. Осадительное титрование Осадительное титрование основано на реакциях осаждения, которые могут протекать с достаточной скоростью при невысоких температурах и являются необратимыми. Хотя таких реакций достаточно много, для анализа оказались пригодными лишь несколько. Хорошо разработан метод осадительного титрования нитратом серебра AgNO3 – аргентометрия. В качестве индикаторов при аргентометрическом анализе применяют K2CrO4, FeCl3, адсорбционные индикаторы. Ион серебра образует достаточно большое количество нерастворимых в воде солей, что обусловливает его аналитические возможности; аргентометрией можно определять Cl-, Br-, I-, SCN-, AsO43-, CO32- и др. Однако широкому использованию метода мешает высокая стоимость нитрата серебра. Еще реже используется метод меркуриметрии, в котором титрантами служат очень ядовитые соли ртути. №10. Основные понятия: титрант, титрование, точка эквивалентности, точка конца титрования. Способы проведения анализа (прямое, заместительное, обратное), приемы проведения анализа (отдельных навесок, аликвотных проб (пипетирования)). Титрометрия - это наиболее широко используемый в аналитической практике метод анализа. По чувствительности он близок гравиметрии (предел обнаружения 0,10%), по правильности уступает гравиметрическому анализу (точность 0,5%). Однако он намного быстрее и проще в исполнении. Титриметрический анализ основан на точном измерении объема раствора реагента, пошедшего на реакцию с анализируемым компонентом пробы. Титрант - раствор реагента с точно известной концентрацией. Титрование - процесс постепенного прибавления титранта к анализируемому раствору называют титрованием. Точка эквивалентности - точка титрования, в которой достигается равенство эквивалентов вступивших в реакцию анализируемого вещества и титранта. До точки эквивалентности в растворе практически отсутствует титрант, а после точки эквивалентности – определяемое вещество. Вблизи точки эквивалентности резко меняются свойства системы. Это резкое изменение замеряемого свойства раствора вблизи точки эквивалентности называют скачком титрования. Точка конца титрования - такой момент титрования, когда по изменению окраски раствора индикатора или по другим признакам замечают конец реакции. Обычно к моменту конца титрования количество прибавляемого титранта больше или меньше, чем эквивалентное. Титрование будет тем точнее, чем ближе к точке эквивалентности лежит точка конца титрования. Разница между точкой эквивалентности и точкой конца титрования обуславливает индикаторную ошибку титрования. Достигнув точки конца титрования, добавление титранта прекращают. По затраченному объему титранта и его концентрации вычисляют результаты анализа. Стандартные растворы титрантов получают разными методами: 1. по точной навеске (вещество должно быть химически чистым и устойчивым); 2. по приблизительной навеске с последующим определением точной концентрации раствора титранта по стандартному раствору (метод стандартизации); 3. из фиксанала, который представляет собой строго определенное количество вещества, запаянное в ампулу. При тщательном переносе этого вещества в мерную колбу определенного объема (обычно 1л) получают раствор заданной концентрации. Приемы титрования. В аналитической практике используют прямое, обратное и косвенное (титрование заместителя) титрование. Если в основе количественного определения лежит непосредственная реакция между анализируемым веществом и титрантом, титрование называется прямым. Иногда по ряду причин реагент добавляют в избытке, а оставшееся после реакции количество реагента оттитровывают. Поскольку объем и концентрация раствора добавляемого реагента известны, по результатам титрования определяют количество реагента, пошедшее на реакцию. Такое титрование называется обратным. При косвенном титровании в реакцию с титрантом вступает продукт взаимодействия анализируемого вещества с известным количеством реагента. №11 Способы выражения концентрации титрованных растворов, способы их приготовления. Стандартные (установочные, исходные) вещества. Требования, предъявляемые к стандартным веществам.
Способы выражения концентраций растворов: 1) Массовая доля вещества
Выражают обычно в массовых долях или процентах (для этого в формуле правую часть домножают на 100%). 2) Молярная концентрация - показывает, сколько моль вещества содержится в 1 литре (1000 мл.) раствора. Обозначается См. Единица измерения - [моль/л] (часто пишут просто М)
где n - количество вещества в молях, V - объём раствора, m - масса вещества, Mr - молярная масса вещества. 3) Моляльная концентрация - число молей растворенного вещества в 1 килограмме (1000 г.) расторителя. Единица измерения - [моль/кг]
4) Нормальная концентрация - это число эквивалентов в 1 литре раствора. Обозначают символом Сн
0,1 нормальный раствор - децинормальный. 5) Титр - количество вещества (в граммах), растворённое в 1 мл. раствора. Различают титр по растворённому веществу (например, титр раствора соляной кислоты — THCl) или титр по определяемому веществу (например, титр раствора соляной кислоты по едкому натру — THCl/NaOH)
где Т - титр в г/мл, Р - масса навески, V - объём мерной колбы.
Применяемые в анализе растворы с точной концентрацией называют рабочими или стандартными растворами. Титрованные растворы, полученные из точной навески вещества, называют приготовленными, а исходные или установочные вещества называют первичными стандартами. Растворы с установленным титром называют вторичными стандартами. Сам процесс установления точной концентрации называют стандартизацией. К стандартным (исходным) веществам предъявляют строгие требования. Ими могут быть только: · химически чистые (примеси меньше 0,01%), · химически устойчивые, · хорошо растворимые вещества, состав которых строго соответствует химической формуле, с возможно большей молярной массой при возможно меньшем вкладе в нее молярной массы вещества реактива, чтобы уменьшить погрешность при взвешивании. · вещества должны удовлетворять требованиям к химическим реакциям в количественном химическом анализе. Этим способом готовят, например, стандартные растворы сильных кислот и щелочей, вещества которых вследствие своей агрессивности не отвечают требованиям, предъявляемым к исходным веществам. Требования, предъявляемые к установочным веществам: 1. Иметь кристаллическую структуру и отвечать определенной химической формуле. 2. Химический состав должен соответствовать его формуле. 3. Не содержать посторонних примесей выше допустимого предела, устанавливаемого ГОСТ для данного вещества марки “х.ч.” 4. Способы очистки установочного вещества от сопутствующих примесей (кристаллизация, экстракция, возгонка и др.) должны быть доступными в аналитической лаборатории. 5. Химически чистое установочное вещество не должно быть гигроскопичным, но должно сравнительно хорошо растворяться в воде. 6. Растворы установочного вещества не должны изменять своего титра при хранении и соприкосновении с воздухом. 7.Установочное вещество должно отличаться по возможности наибольшим эквивалентным весом. Чем больше эквивалентный вес вещества, тем больше точность установки титра раствора, так как при взвешивании вещества с большим молекулярным весом ошибки взвешивания оказывают незначительное влияние. № 12. Теоретические основы, сущность алкалиметрического, ацидиметрического, перманганатометрического, иодометрического титрования. Используемые титранты, их концентрация, способы фиксирования точки эквивалентности, индикаторы. Алкалиметрия – определение веществ с применением стандартных растворов щелочей. Ацидиметрия - определение веществ с применением стандартных растворов сильных кислот. Пермангонатометрия основана на реакциях окисления различных веществ перманганатом калия. Окисление проводят в кислой среде, в которой ион MnO4- проявляет наиболее сильные окислительные свойства и имеет наименьший эквивалент (1/5). Иодометрия основана на титрометрической реакции йода с тиосульфатом натрия. Индикаторы представляют собой органические кислоты и основания сложного строения, характеризующиеся разной окраской молекулярной и ионизированной формы вещества. №13 Индикаторы метода кислотно-основного титрования. Интервал перехода окраски индикаторов. Титрантами метода являются растворы сильных кислот и оснований: HCI, H2SO4, NaOH, KOH. Эти вещества не соответствуют требованиям, предъявляемым к стандартным веществам, поэтому концентрацию титрантов устанавливают стандартизацией их растворов. В качестве первичных стандартов чаще всего используют буру Na2B4O7 •10Н2О, безводный карбонат натрия Na2CO3, дигидрат щавелевой кислоты Н2С2О4 • 2Н2О и некоторые другие. Кислотно-основной индикатор сам является кислотой или основанием и при кислотно-основном титровании изменяет свою окраску в ТЭ или вблизи ее. При визуальном индикаторном методе фиксации КТТ в кислотно-основном титровании прибавление титранта к титруемому раствору прекращают, когда резко меняется окраска раствора вследствие изменения цвета индикатора, введенного в титруемый раствор. Величину рН, до которой титруют раствор с данным индикатором, называют показателем титрования этого индикатора рТ. Важнейшие индикаторы имеют следующие области перехода и показатели титрования: Показатель титрования рТ Область перехода рН Метиловый оранжевый……………4,0………………………….. 3,1 - 4,4 Метиловый красный……………….. 5,5…………………………. 4,4 - 6,2 Лакмус……………….………………………7,0………………………….5,0 - 8,0 Фенолфталеин………………………..…9,0………………………….8,0 - 10,0 №14 Оборудование в титриметрическом анализе: бюретки, мерные колбы, мерные пипетки Мора и градуированные, мерные цилиндры, воронки конические колбы для титрования. Правила работы с оборудованием. Бюретки – используют для наполнения титраном и проведения титрования; градуированные по объёму стеклянные трубки с 0 делением наверху, предназначены для отмеривания р-ров небольшими порциями. V = 1-50 мл Мерные пипетки- стеклянные трубки для отмеривания и переноса р-ра из одного в другой сосуд Пипетка Мора имеет в средней части шаровое расширение, выше кот нанесена кольцевая метка. На расширенной части указывают V,t при кот проводилась колибровка (V=5,00-50,0 мл) Градуированные пипетки без расширения (V=0,10-10,0 мл) Конические колбы- служат для проведения титриметрических р-ций (V=25-250 мл)не должна наполняться более 1/3 Мерные колбы-имеется длинное узкое горлышко с нанесенной кольцевой метки. Предназначены для приготовления р-ров точно заданной концентрации Мерные цилиндры-в титриметрическом анализе имеют второстепенное значение. Используют для приблизительного измерения объемов некоторых вспомогательных р-ров или воды Воронка — приспособление в виде конуса, заканчивающегося трубкой, для переливания жидкостей в узкогорлые сосуды. Со стеклянной посудой и приборами(в том числе термометрами) следует обращаться бережно, не класть на край стола, не задевать локтями. Осколки разбитой посуды немедленно убирать. №15. Расчетные формулы, используемые в титриметрическом анализе согласно системы СИ
№16. Понятие о физико-химических методах анализа. Методы анализа, основанные на наблюдении изменений физических свойств анализируемой системы, происходящих в результате определенных химических реакций, называют физико-химическими методами. Физико-химические методы анализа отличаются большой чувствительностью и быстротой выполнения аналитических определений. Время, требуемое для завершения анализа физическими и физико-химическими методами, иногда измеряется минутами. Физико-химические методы количественного анализа не следует смешивать с физико-химическим анализом по Н. С. Курнакову, с помощью которого изучают физические свойства систем в зависимости от их химического состава. №17. Сколько мл раствора серной кислоты с массовой долей 98% (r = 1,84 г/мл) необходимо взять для приготовления 200 мл раствора с массовой долей 10% (r = 1,05 г/мл)? №18. Вычислите массовую долю и молярную концентрацию раствора глюкозы, содержащего 75 г вещества в 500 г воды. №19. Чему равна молярная концентрация 0,9% раствора хлорида натрия(r = 1,0 г/мл)?
№20. Как приготовить 5% раствор глюкозы из 20% раствора? №21. Концентрация глюкозы в сыворотке крови равна 3,5 ммоль/л, выразите концентрацию в мг%. №22. Гидроперит (содержит перекись водорода и мочевину) применяют как антисептическое средство. Одна таблетка соответствует 15 мл 3% раствора перекиси водорода. Сколько таблеток необходимо растворить в 100 мл воды для получения 1% раствора? №23. Для лечения впервые выявленных больных деструктивным туберкулезом вводят внутривенно 10% раствор изониазида из расчета 15 мг/кг массы тела. Рассчитайте объем в мл 10% раствора изониазида (r = 1,0 г/мл), который необходимо ввести больному массой 75 кг.
№24 Тактивин – лекарственный препарат полипептидной природы используется в медицинской практике как иммуномодулирующее средство. Форма выпуска: 0,01% раствор во флаконах по 1 мл. При офтальмогерпесе препарат назначают в виде подкожных инъекций по 0,010-0,025 мг один раз в сутки. Рассчитайте объемы 0,01% раствора тактивина, которые соответствуют суточной дозе препарата. W%=(m(x) /m)*100% m = V*p => m= 1*1=1 г m(x)= (W*m(р-ра))/100% m(x)= (0,01%*1г)/100% = 0,1 мг №25 Ампициллин – полусинтетический антибиотик. Форма выпуска: таблетки и капсулы по 0,25 г. Суточная доза для детей составляет из расчета 100 мг/кг. Суточную дозу делят на 4-6 приемов. Рассчитайте, какую часть таблетки нужно дать ребенку массой 10 кг на один прием: а) при четырехкратном приеме; б) при шестикратном приеме препарата в сутки? 100 мг/кг *10 кг = 1000 мг = 1 г 1:4=0,25 – 1 таблетка 1:6=0,166 – 2/3 таблетки Ответ: a)0,25г b) 2/3 г №26 Для определения общей кислотности желудочного сока 5 мл сока оттитровали раствором щелочи с концентрацией 0,095 моль/л в присутствии фенолфталеина. На реакцию израсходовано 2,5 мл раствора щелочи. Рассчитайте кислотность анализируемого сока в моль/л. С1*V1=С2*V2 С2 = (С1*V1)/V2 С2 = (0,095* 2,5)/5 = 0,0475 моль/л Ответ: 0,0475моль/л №27 Рассчитайте массу навески КMnO4, необходимую для приготовления: а) 1 л раствора KMnO4 с молярной концентрацией эквивалента 0,1 моль/л, б) 0,5 л раствора KМnO4 c молярной концентрацией эквивалента 0,05 моль/л для проведения работ по перманганатометрическому титрованию. M(KMnO4)=64+39+55=158 m(x)= (C(1/z x)*M(x)*V)/ z a) m(KMnO4)=(0,1*158*1)/ 5 = 3,16 b) m(KMnO4)=(0,5*158*0,05)/ 5=0,79 Ответ: a) 3,16 b)0,79 №29 Рассчитайте массовую долю (%) уксусной кислоты, если на 10 мл ее раствора израсходовано при титровании 20 мл 0,2 моль/л раствора гидроксида натрия. С(NaOH)*V(NaOH) = С(ук. к-ты)*V(ук. к-ты) С (ук. к-ты) = (С (NaOH)*V (NaOH))/ / V (ук. к-ты) С (ук. к-ты) = (0,2* 20) / 10 = 0,4 моль/л m (ук. к-ты) = С (ук. к-ты)*М (ук. к-ты)* В m (ук. к-ты) = 0,4*60*0,01 = 0,24 г р = m/V р = 0,24/10 = 24 г/л W = (С (ук. к-ты)* М (ук. к-ты)*в) / (р*10) = 0,1 % Ответ: W = 0,1% №31. Термодинамика, основные понятия и задачи. Параметры состояния (экстенсивные и интенсивные) и функции состояния системы. Термодинамика – это раздел общей химии, который объясняет процессы обмена организма с окружающей средой энергией и веществом. Термодинамика изучает процессы, связанные с переходом энергии (U) между телами в виде теплоты (Q) и работы (W). Одним из важнейших понятий является понятие термодинамической системы – это тело или группа тел, отделенных от окружающей среды поверхностью раздела. Объекты природы, не входящие в систему, являются средой. Система характеризуется массой (m) и внутренней энергией (U). Выделяют три вида термодинамических систем: 1. Изолированная система – система, не обменивающаяся с окружающей средой ни веществом, ни энергией. ∆U = 0, ∆m = 0. (термос). 2. Закрытая система – система, не обменивающаяся с окружающей средой веществом, но может обмениваться энергией. ∆U ≠ 0, ∆m = 0. (сосуд с водой). 3. Открытая система – обменивается с окружающей средой и веществом, и энергией. ∆U ≠ 0, ∆m ≠ 0. (клетка). Системы делят на: 1. Гомогенные – однородные -в них нет границ раздела фаз (плазма крови, истинные растворы). 2. Гетерогенные – неоднородные - есть границы раздела фаз (кровь). Любая система может быть охарактеризована рядом величин, которые называются параметры состояния. Их различают на: 1. Экстенсивные – суммирующиеся при сложении (масса, объем, энергия, энтропия). 2. Интенсивные – не суммирующиеся при сложении (давление, температура, плотность, концентрация). Существуют параметры состояния, которые зависят только от начального и конечного состояния системы и не зависят от пути процесса, их называют функции состояния. Например: Х1 – термодинамическая величина, характеризующая начальное состояние системы. Х2 - термодинамическая величина, характеризующая конечное состояние системы. ∆Х = Х2 – Х1 – изменение термодинамической величины. +∆Х – прибыль(приращение переменной Х). -∆Х – убыль. Функциями состояния являются следующие величины: температура - ∆Т, давление - ∆Р, внутренняя энергия - ∆U, энтропия - ∆S, энтальпия - ∆H, энергия Гиббса - ∆G. №32. Понятие внутренней энергии. Работа и теплота – две формы передачи энергии. Первое начало термодинамики. Изохорные и изобарные процессы. Внутренняя энергия системы представляет собой сумму энергии теплового движения молекул, атомов и ионов и энергии взаимодействия между ними (притяжение, отталкивание, вращательные и колебательные движения), за исключением кинетической энергии в целом и потенциальной энергии положения. Абсолютное значение внутренней энергии определить невозможно, можно только вычислить изменение внутренней энергии: ∆U = U2 – U1. Изменение внутренней энергии обусловлено работой, которая совершается при взаимодействии системы со средой, и передачей теплоты между средой и системой. Взаимосвязь величин U, Q, W, в термодинамике определяется первым началом термодинамики. В термодинамике под работой понимают работу расширения: W = p ∙ ∆V; Q = ∆U + p ∙ ∆V. В организмах совершается не только работа расширения, но и много другие виды работ – химическая (синтез белка), механическая (сокращения мышц), электрическая (проведение возбуждения по клеткам), осмотическая (перенос вещества через мембрану). Первичным источником энергии в организме для производства всех видов работ является химическая энергия пищевых веществ. Однако эта энергия не используется непосредственно для совершения всех видов работ; она трансформируется в энергию АТФ. Теплота в изобарных и изохорных процессах становится функцией состояния и называется тепловым эффектом. Это было установлено Гессом в 1840 году. Всего существует шесть общепризнанных формулировок I начала термодинамики. 1. В любой изолированной системе запас энергии остается постоянным. (Ломоносов) 2. Разные формы энергии переходят друг в друга в строго эквивалентных количествах. (Джоуль) 3. Вечный двигатель первого рода не возможен, то есть не возможно построить машину, которая давала бы механическую работу, не затрачивая на это энергию. 4. Первое начало термодинамики для живых организмов: все виды работ в организме совершаются за счет эквивалентного количества энергии, выделяющейся при окислении питательных веществ. 1. Изохорный процесс – характеризуется постоянством объема системы, V – const. Q v = ∆U + p ∙ ∆V; ∆V = 0; Q v = ∆U. Тепловой эффект изохорного процесса равен изменению внутренней энергии. 2. Изобарный процесс – характеризуется постоянством давления системы, Р – const. Q р = ∆U + p∙(V2 – V1); Q р = U2 – U1 + p V2 – p V1; Qр = (U2 + pV2) – (U1 + pV1); Qр = H2 – H1; Qр = ∆H; ∆H = ∆U + W. Тепловой эффект изобарного процесса равен изменению энтальпии. №33. Тепловой эффект химической реакции. Энтальпия как функция состояния системы. Эндотермические и экзотермические процессы. Н – энтальпия – функция состояния, которая показывает энергию расширенной системы или теплосодержание системы. Тепловой эффект изобарного процесса равен изменению энтальпии. Qр = ∆U + p∙(V2 – V1); Qр = U2 – U1 + pV2 – pV1; Qр = (U2 + pV2) – (U1 + pV1); Qр = H2 – H1; Qр = ∆H; ∆H = ∆U + W. По значению энтальпии судят о характере процесса: 1. Экзотермический – процесс, идущий с выделением энергии, ∆H < 0. 2. Эндотермический - процесс, идущий с поглощением энергии, ∆H > 0. №34. Первое начало термодинамики для изобарных процессов. Закон Гесса. Термохимические расчеты и их использование для энергетической характеристики химических и биохимических процессов. Стандартные энтальпии образования и сгорания. Следствия из закона Гесса. Изобарный процесс – характеризуется постоянством давления системы, Р – const. Qр = ∆U + p∙(V2 – V1); Qр = U2 – U1 + pV2 – pV1; Qр = (U2 + pV2) – (U1 + pV1); Qр = H2 – H1; Qр = ∆H; ∆H = ∆U + W. Н – энтальпия – функция состояния, которая показывает энергию расширенной системы или теплосодержание системы. Теплота изобарного процесса становится функцией состояния и называется тепловым эффектом. Тепловой эффект изобарного процесса равен изменению энтальпии. Закон Гесса: Тепловой эффект реакции при постоянном объеме и давлении не зависит от пути процесса, а зависит от начального и конечного состояния системы. Гесс ввел понятие термохимическое уравнение – уравнение химической реакции, в котором указывается агрегатное состояние реагирующих веществ и тепловой эффект реакции. Например: Н2(г) + 1/2О2(г) = Н2О(г), ∆H = -286кДж/моль. 2Н2(г) + О2(г) = 2Н2О(г), ∆H = -572кДж/моль. Тепловой эффект реакции определяют двумя путями: - экспериментальный (проводится в калориметрах); - теоретический, расчетный. Он основан на двух следствиях из закона Гесса, которые связаны с понятием стандартных теплот образований и сгорания. Стандартная теплота образования – тепловой эффект преобразования из простых веществ 1моля соединения при стандартных условиях - ∆Hо298 обр. Стандартные условия – Р = 1атм = 760 мм рт ст = 1,013·105 Па (Н/м2) = 101 кПа; Т = 25оС = 298оК. Стандартная теплота сгорания - тепловой эффект сгорания 1моля вещества при стандартных условиях - ∆Hо298 сгор. Чаще используют для органических веществ. Первое следствие закона Гесса – тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, взятых со своими стехиометрическими коэффициентами. ∆Hр = ∑i ni ∆Hо298 образования продуктов реакции – ∑i ni ∆Hо298 образования исходных веществ реакции. Теплоты образования простых веществ равны нулю. Например для реакции: С6Н12О6 + 6О2 → 6СО2 + 6Н2О ∆Hр = 6∆Hо298 (СО2) + 6∆Hо298 (Н2О) – ∆Hо298 (С6Н12О6) - 6∆Hо298 (О2) ∆Hр = 6(-393 кДж/моль) + 6(-296кДж/моль) – (-1260кДж/моль) – 6(0 кДж/моль) = =-2874 кДж/моль Второе следствие закона Гесса – тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ реакции и суммой теплот сгорания продуктов реакции, взятых со своими стехиометрическими коэффициентами. ∆Hр = ∑i ni ∆Hо298 сгорания исходных веществ реакции – ∑i ni ∆Hо298 сгорания продуктов реакции. №35. Энергетическая ценность пищевых продуктов, обоснование рационов питания, основные задачи биоэнергетики. Взаимное превращение различных видов энергии идет и в живых организмах. Изучение законов и механизмов накопления, хранения и использования энергии живыми системами составляет задачу особой науки: биоэнергетики, которая позволяет составить правильное представление об энергетической ценности продуктов питания и организации режима питания. Каждый продукт обладает определенной энергией или калорийностью, поэтому зная калорийность продукта и суточную потребность человека в калориях можно правильно составить рацион питания. Потребность в калориях можно рассчитать индивидуально, если учитывать 3 основных признака: интенсивность труда, возраст, пол. При составлении рациона питания необходимо учитывать не только общий запас энергии, но и потребность в белках, жирах, углеводах и витаминах. Суточная потребность в калориях: - для лиц умственного труда (16-60 лет) - 2600-2800 кал; - для работников механизированного труда - 2800-3000 кал; - для лиц физического труда - 3400-3700 кал; - студенты - 3000-3200 кал. Суточная потребность в белках – 60-80г; жирах – 60-70г; углеводах – 200-300г. Зная, что 1г белка дает 17 кДж (4,2 кал); жира - 37 кДж (9 кал); углеводов - 17 кДж (4,9 кал); составляют рацион по общему запасу калорий и по качественному составу. Выясним, справедливо ли первое начало термодинамики для открытых систем - живых организмов: Q=ΔU+W. Если в живом организме t° = 37°С = const, то ΔU = 0, тогда первое начало термодинамики для живых организмов: Q = W. В организмах совершается не только работа расширения, но и много другие виды работ – химическая (синтез белка), механическая (сокращения мышц), электрическая (проведение возбуждения по клеткам), осмотическая (перенос вещества через мембрану). Первичным источником энергии в организме для производства всех видов работ является химическая энергия пищевых веществ. Однако эта энергия не используется непосредственно для совершения всех видов работ; она трансформируется в энергию АТФ. Первое начало термодинамики для живых организмов: все виды работ в организме совершаются за счет эквивалентного количества энергии, выделяющейся при окислении питательных веществ. №36. Второе начало термодинамики, вклад С. Карно и Р. Клаузиуса. Энтропия как функция состояния системы. Критерии самопроизвольно протекающих процессов в изолированных системах. Связь энтропии с вероятностью состояния системы. Второе начало термодинамики дает ответ на вопрос о направленности протекания реакции. Оно является обобщенным результатом труда многих ученых. Первооткрывателем второго начала термодинамики считают С. Карно (1840г.). Он исследовал условия превращения теплоты в работу и сделал вывод, что в тепловых машинах количество теплоты, полученное от теплоисточника, не может полностью переходить в работу, часть ее передается холодильнику (рассеивается). Карно вывел коэффициент полезного действия – КПД – η – отношение полезной работы к начальной: η = (Q1 – Q2) /Q1 = W / Q1. КПД тепловой машины не зависит от природы рабочего тела, а определяется только интервалом температур
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 15858; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.012 с.) |


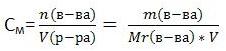 ,
,
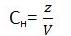
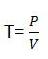 ,
,





