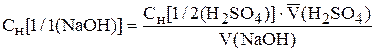Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 3. Определение концентрации гидроксида натрия методом кислотно-основного титрованияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В данной лабораторной работе используем титрование сильного основания сильной кислотой в соответствие с уравнением реакции
2NaOH + H2SO4 = Na2SO4 + 2Н2О.
Реактивы и оборудование. Титрант – стандартный раствор H2SO4 c концентрацией C[1/2(H2SO4)] = 0,10 н; коническая колба для титрования объемом 250 см3; пипетка на 10,00 см3; бюретка объемом 25 см3; кислотно-основной индикатор метиловый оранжевый 1% раствор. Выполнение работы. Определяют концентрацию раствора гидроксида натрия, приготовленного в опыте 1. Готовят бюретку для титрования и заполняют ее стандартным раствором кислоты. 2. Раствор NaOH из мерной колбы переливают в чистый сухой химический стакан, пипеткой объемом 10,00 см3 отбирают аликвотный объем раствора гидроксида натрия и переносят его в коническую колбу для титрования. 3. Стенки колбы обмывают небольшим количеством дистиллированной воды, добавляют 2 капли индикатора метилового оранжевого и начинают титрование. Последние порции кислоты приливать по каплям. Титрование останавливают в тот момент, когда произойдет резкий переход окраски от желтой к оранжево-красной. 4. Записывают объем раствора кислоты, пошедший на титрование. Повторяют титрование еще 3 раза. Перед каждым титрованием коническую колбу моют и ополаскивают дистиллированной водой. Запись данных опыта и расчеты. Данные записать по приведенной ниже форме. Определяемое вещество – NaOH, титрант – H2SO4 Объем мерной колбы V = 100,00 см3 Концентрация титранта Cн[1/2(H2SO4)] = 0,10 н Индикатор – метиловый оранжевый
По результатам титрования найти средний объем титранта Рассчитать эквивалентную концентрацию NaOH. На основании закона эквивалентов
рассчитывают эквивалентную концентрацию гидроксида натрия
Опыт 4. Анализ смесей и Na2CO3 + NaHCO3
Цель работы Определить массу NaOH и Na2CO3, находящихся в растворе методом кислотно-основного титрования при совместном присутствии (последовательное титрование). Определение компонентов смесей NaOH + Na2CO3 в растворе основано на титровании его стандартным раствором НС1 сначала в присутствии индикатора фенолфталеина и затем – метилового оранжевого. При титровании раствора смеси NaОН + Na2СО3 по фенолфталеину фиксируется момент титрования, когда оттитрованы NaOH и Na2СО3 до NaНСО3, расход титраита при этом составит V 1. При титровании этого раствора по метиловому оранжевому NaНСО3 титруется до угольной кислоты, общий расход титранта составит V2, причем 2V1 > V2. Объем титранта (V2 – V1) эквивалентен содержанию Na2СО3, f экв(Na2СО3) = 1, a V2 – 2(V2 – V1) эквивалентен содержанию NaOH. Для пояснения сказанного титрование раствора смеси NaOH + Na2CO3 схематично изображено на рис. 2
Рис.2. Схема титрования смеси Na2CO3 и NaOH
Реактивы и оборудование. Коническая колба для титрования объемом 250 см3; пипетка на 10,00 см3; бюретка объемом 25 см3; мерная колба на 100,00 см3. Титрант – стандартный раствор HCl c концентрацией C(HCl) = 0,10 н; кислотно-основной индикатор метиловый оранжевый 1% раствор, кислотно-основной индикатор фенолфталеин 1% раствор.
Выполнение работы. 1. Отбирают пипеткой аликвотные части раствора Vа из мерной колбы V, и переносят их в колбы для титрования, добавляют 3 капли раствора фенолфталеина и медленно при перемешивании титруют стандартным раствором НС1 до обесцвечивания розовой окраски; записывают расход титранта – V1. 2. Затем добавляют в титруемый раствор 1 – 2 капли раствора метилового оранжевого и продолжают титрование до перехода окраски раствора из желтой в оранжевую, записывают расход титранта – V2.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2153; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

 =
=