
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы приготовления растворов с точно известной концентрацией -титрантовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Существуют следующие способы приготовления растворов с точно известной концентрацией: 1) растворение точно взвешенной массы чистого реагента и разбавление до точно известного объема; 2) приготовление раствора приблизительной концентрации и установление его точной концентрации с помощью первичного стандартного вещества; 3) метод фиксаналов. Фиксаналы представляют собой запаянные стеклянные ампулы, содержащие определенную массу вещества. Для приготовления титранта ампулу фиксанала разбивают над специальной воронкой с пробивным устройством и содержимое ее смывают растворителем (водой) в мерную колбу объемом 1 литр. Полученный раствор затем разбавляют растворителем до метки. Концентрация полученного раствора указывается на.ампуле. При использовании первых двух вариантов приготовления титрантов требуется химическое соединение высокой степени чистоты, называемое первичным стандартом. Вещество, которое может рассматриваться как хороший первичный стандарт, должно удовлетворять ряду важнейших требований: 1) быть химически чистым (содержание примесей не должно превышать 0,05 %); 2) быть устойчивым и сохраняться без изменений как на воздухе, так и в растворе (т.е. вещество не должно быть гигроскопичным, окисляться, взаимодействовать с диоксидом углерода, терять кристаллическую воду); 3) быть легкодоступным; 4) иметь достаточно высокую эквивалентную массу (масса вещества, требующегося для определения, тем больше, чем выше молярная масса эквивалента). Концентрации стандартных растворов (С) выражают в моль/л (М), в моль/л эквивалента вещества (н.), в г/мл (титр ТА). В методах кислотно-основного титрования и окисления-восстановления удобнее выражать концентрацию стандартных растворов в моль/л эквивалента. Нормальный раствор вещества А — раствор, в 1 л которого содержится количество вещества, равное молярной массе его эквивалента, соответственно п — нормальный раствор содержит пМ.зка г вещества.
число г вещества В, соответствующее 1 мл раствора титранта А. Следующие соотношения связывают различные способы выражения концентраций раствора
Расчет навески а при приготовлении V мл раствора стандартного вещества А заданной концентрации СА или НА проводится по формуле
Эти же формулы позволяют рассчитать концентрации стандартных растворов, приготовленных по точной навеске вещества А (а), растворенной в V мд воды. При определении концентрации раствора А(НА) по результатам титрования стандартного вещества В вычисление производится по формуле
b — навеска стандартного вещества В, Vа количество раствора А, израсходованное на титрование, мл. Если для определения концентрации раствора А используется стандартный раствор вещества В, концентрация которого равна нв, а на титрование VA мл раствора А расходуется VB мл раствора В, то нА рассчитывается из соотношения
Произведение HV представляет собой число миллимолей эквивалента.
Расчеты в титриметрическом анализе Титриметрический анализ основан на принципе эквивалентности, согласно которому вещества вступают в реакции друг с другом в эквивалентных количествах, т.е.
Основные расчетные формулы в титриметрии Так как количество эквивалентов связано с нормальной концентрацией соотношением то из уравнения принципа эквивалентности можно получить уравнение, называемое основным соотношением титриметрического анализа:
где С(1/z х) - нормальная концентрация определяемого раствора (концентрация, которую необходимо определить); V(x) объем анализируемого раствора (известная величина); С(1/z R)- нормальная концентрация титранта (известная величина); V(R) - объем титранта (измеряемая величина). Следовательно
Формула для расчета массы анализируемого вещества:
Приемы титрования Прямое титрование основано на непосредственном взаимодействии определяемого вещества х и титранта (R):
Массу анализируемого вещества находят по формуле
Если титруется часть раствора, то расчет массы вещества ведут по формуле:
где Vk - объем мерной колбы; VA - объем аликвоты (пипетки). Титрование по остатку (обратное титрование) проводят, когда невозможно прямое титрование. В этом случае к определяемому веществу добавляют вспомогательный реагент β, взятый в избытке:
Остаток непрореагировавшего вспомогательного реагента оттитровывают стандартным раствором титранта:
В момент эквивалентности все количество вспомогательного реагента р затрачено на реакции с определенным веществом х и титрантом R:
Расчет массы анализируемого веществапроизводят по формуле
где Когда точная концентрация вспомогательного реагента неизвестна, проводят дополнительное титрование, устанавливая соотношение между вспомогательным реагентом, взятым в том же объеме, что и при определении анализируемого образца, и титрантом:
В этом случае, учитывая соотношение
где V1(R) - объем титранта, пошедший на титрование вспомогательного реагента в отсутствие анализируемого вещества. Титрование заместителя применяют, когда нет подходящей реакции или индикатора для прямого титрования. В этом случае к определяемому веществу х добавляют вспомогательный реагент β, с которым определяемое вещество образует стехиометрическое количество нового соединения, называемого заместителем у. Вспомогательный реагент выбирают с таким расчетом, чтобы получаемый заместитель было удобно определять прямым титрованием:
Так как
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1308; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.132.80 (0.006 с.) |

 При массовых анализах для упрощения расчетов концентрацию стандартного раствора выражают так же через титр по определяемому веществу
При массовых анализах для упрощения расчетов концентрацию стандартного раствора выражают так же через титр по определяемому веществу






 количество эквивалентов определяемого вещества
количество эквивалентов определяемого вещества количество эквивалентов титранта
количество эквивалентов титранта

 или
или 






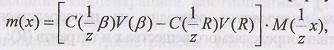
 - нормальная концентрация вспомогательного реагента; V(β) - объем вспомогательного реагента, взятый для определения; V(R) - объем титранта, пошедший на титрование остатка вспомогательного реагента.
- нормальная концентрация вспомогательного реагента; V(β) - объем вспомогательного реагента, взятый для определения; V(R) - объем титранта, пошедший на титрование остатка вспомогательного реагента.
 , рассчитывают массу определяемого вещества х следующим образом:
, рассчитывают массу определяемого вещества х следующим образом:

 то массу анализируемого вещества рассчитывают по формуле
то массу анализируемого вещества рассчитывают по формуле



