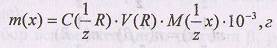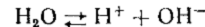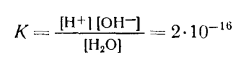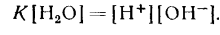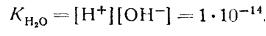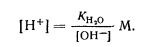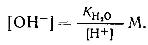Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы титриметрического анализаСодержание книги Поиск на нашем сайте
Титриметрический анализ можно проводить двумя методами: методом отдельных навесок и методом пипетирования. Метод отдельных навесок. На аналитических весах берут 5-6 навесок определяемого вещества А, каждую из которых растворяют в небольшом количестве дистиллированной воды, и полученные растворы титруют раствором титранта. Массу анализируемого вещества для каждой отдельной навески рассчитывают по формуле
Из среднего арифметического всех найденных значений определяют содержание анализируемого вещества и рассчитывают погрешность. Метод пипетирования (метод аликвот). Метод пипетирования заключается в том, что на титрование отбирают пипеткой только часть анализируемого раствора Va. Навеску анализируемого вещества растворяют в мерной колбе объемом VK. Массу навески рассчитывают таким образом, чтобы она была в (VK / Va.) раз больше, чем масса определяемого вещества, необходимая на отдельное титрование. Следовательно, при расчете массы по результатам титрования
По сравнению с методом отдельных навесок в методе пипетирования существуют дополнительные случайные отклонения, возникающие в результате погрешностей измерения объемов пипетки и мерной колбы, в которой готовят стандартный раствор. Кроме того, ошибка при взвешивании определяемого вещества может привести к неверным результатам за счет систематической погрешности. Однако ввиду большей длительности и трудоемкости определения по методу отдельных навесок на практике чаще используют метод пипетирования.
В основе кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами: Н+ + ОН- = Н2О, Н3О+ + ОН- = 2Н2О При помощи этого метода определяют кислоты, основания, соли, способных гидролизоваться в водных растворах, а также их смеси, азот, серу в органических соединениях, некоторые органические соединения (формальдегид, спирты и др.). В качестве титрантов в кислотно-основном титровании применяют в основном растворы сильных кислот (НС1, Н2SО4) и сильных оснований (КОН, NaOH). В зависимости от природы титранта кислотно-основное титрование включает два основных метода: ацидиметрия и алкалиметрия. В ацидиметрии титрантом служит раствор кислоты, а применяют ее для определения различных оснований. В алкалиметрии титрант - раствор щелочи, а применяется для определения кислот,
Титранты кислотно-основного титрования относятся к титрантам второго типа - стандартизированные или с установленным титром. В качестве исходных веществ для установления титра рабочих растворов кислот используют тетраборат натрия (Na2B4O7*10H2O) или карбонат натрия безводный (Na2CO3), а для установления титра растворов щелочей – щавелевую (Н2С2О4*2Н2О) или янтарную (Н2С4Н4О4) кислоту. Кислотно-основное титрование не сопровождается внешним эффектом, а лишь изменением рН. Реакция среды в точке эквивалентности определяется природой взаимодействующих кислот и оснований. В кислотно-основном методе титрования различают три случая титрования: 1. Титрование сильной кислоты сильной щелочью и наоборот: НСl + NaOH = NaCl + H2O; H+ + OH- = H2O Точка эквивалентности находится в нейтральной среде (рН=7), т.к. образующаяся соль не подвергается гидролизу. 2. Титрование слабой кислоты сильной щелочью: СН3СООН + NaOH = CH 3COONa + H2O В ионном виде: СН3COOH + OH- = CH3COO- + H2O В точке эквивалентности образуется соль слабой кислоты и сильного основания, которая вступает в реакцию гидролиза: СH3COONa + HOH ↔ CH3COOH + NaOH В ионном виде: СН3СОО- + НОН ↔ СН3СООН + ОН- В растворе накапливаются ионы ОН- и точка эквивалентности будет находиться в щелочной среде (рН > 7), не совпадая с точкой нейтральности. 3. Титрование слабого основания сильной кислотой: NH4OH + HCl = NH4Cl + H2O В ионном виде: NH4OH + H+ = NH4+ + H2O Образующаяся соль слабого основания и сильной кислоты (NH4Cl) подвергается гидролизу, и в растворе накапливаются ионы Н+, что вызывает смещение точки эквивалентности в кислую среду. Следовательно, и в третьем случае точка эквивалентности не совпадает с точкой нейтральности. Поскольку кислотно-основное титрование не сопровождается внешним эффектом, например, изменением окраски, для фиксирования точки эквивалентности применяют индикаторы Согласно протолитической теории к кислотам относятся химические соединения, способные в растворах отдавать протоны, а к основаниям вещества, способные присоединять протоны. Для того чтобы кислота могла отдать протон, необходимо присутствие основания, принимающего этот протон. Отдавая протон, кислота образует сопряженное с ней основание, а основание, принимая протон, образует сопряженную с ним кислоту.
В водных растворах кислот имеет место следующее равновесие:
В воде, которая является кислотой и основанием одновременно и представляет собой слабый электролит устанавливается равновесие
в сокращенном виде
Константа равновесия этой реакции при температуре 25° С равна
В водных растворах масса воды в большинстве случаев очень велика по сравнению с массой растворенного вещества, количество ее в 1 л раствора можно считать постоянным. Тогда выражение для константы равновесия запишется следующим образом:
Из уравнения следует, что ионное произведение является величиной постоянной при постоянной температуре. Эту константу называют ионным произведением воды, которое при температуре 25° С равно
В чистой воде
При избытке [ОН-]
При избытке [Н + ]
Концентрацию водородных ионов обычно используют для характеристики среды. В большинстве расчетов, относящихся к кислотно-основному равновесию, концентрации (и другие величины) удобно выражать в виде отрицательных логарифмов этих величин, обозначаемых знаком „р". Тогда
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.199.4 (0.01 с.) |