
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионное произведение воды тоже можно выразить в логарифмическом видеСодержание книги
Поиск на нашем сайте
Сильные кислоты (НХ) и сильные основания (МОН) в водных растворах практически полностью диссоциированы
Концентрации Н+ и ОН- в этих растворах в первом приближении можно считать равными общей концентрации СА кислоты (НХ) и соответственно основания (МОН). Следовательно
Эти выражения являются приближенными. В более строгих расчетах концентрацию электролитов следует заменять активностью ионов. Между концентрацией иона и активностью его существует следующая зависимость:
где ɤА — коэффициент активности. Коэ ффициент активности зависит от ионной силы раствора (μ)
где С концентрации ионов - катионов и анионов (М), Z. - заряды ионов.
В случае слабых кислот константа равновесия реакции может быть выражена следующим уравнением:
где Ка — константа диссоциации кислоты НА. Если общую концентрацию кислоты обозначить СНА, а равновесную [НА], то
Из уравнения следует, что [Н+] = [А-]. Тогда выражение константы диссоциации слабой кислоты можно записать следующим образом:
отсюда легко найти концентрацию [Н+]
то приближенно можно считать, что
Слабое основание, как и слабая кислота, в водных растворах диссоциирует не полностью
как и для слабой кислоты
Поскольку [В+] = [ОН-], уравнение для константы диссоциации слабого основания будет иметь вид
Когда [ОН-] < Свон (102 [ОН-] < Свон), можно принять
Многоосновные кислоты (H2S04, H2S03, H2C03, Н2С204, Н3Р04 и др.) в водных растворах диссоциируют ступенчато
Константы диссоциации по первой ступени всегда больше, чем по второй ступени: Ка1>Ка2. Если Ка1 во много раз больше Ка2 (Ка1 ≥ 104 Ка2), то концентрация ионов водорода определяется главным образом диссоциацией кислоты по первой ступени. Обозначим через х концентрацию диссоциированной части кислоты. Тогда, при начальной концентрации кислоты С1 равновесные концентрации будут равны
Подставив эти значения в уравнение получим
отсюда
Если Ка мала, то приближенно можно считать, что
Поскольку [Н+]~[НА - ], то из уравнения находим
БУФЕРНЫЙРАСТВОР, поддерживает при изменении состава среды постоянство значения к.-л. характеристики, напр. рН (кислотно-основной буферный раствор) или окислит.-восстановит. потенциала (окислит.-восстановит. буферный раствор).
Значение рН кислотно-основного буферного раствора зависит от концентраций компонентов буферной смеси, находящихся в хим.равновесии, и мало меняется при концентрировании и разбавлении р-ра, введении относительно небольших кол-в в-в, взаимодействующих с одним из компонентов буферного раствора. Наиб. распространены водные кислотно-основные буферные растворы. Они содержат слабую к-ту НА и сопряженное с ней основание А -, напр. СН3СООН и СН3СОО-, NH4+ и NH3. В таких системах осуществляется равновесие: По данным о константе диссоциации к-ты Ка = — [Н3О+] [А- ] /[НА] определяют значение рН р-ра: где [НА] и [А-] -равновесные концентрации соотв. к-ты и основания, рКа= —lgКа. Это значение рН остается практически постоянным, т.к. при добавлении небольших кол-в сильных к-т или оснований ионы Н3О+ или ОН-связываются основанием (к-той) с образованием сопряженной к-ты (основания). Количественно буферный раствор характеризуется буферной емкостью- производной Емкость кислотно-основного буферного раствора соответствует числу эквивалентов сильной к-ты или сильного основания, к-рое необходимо добавить к 1 л р-ра, чтобы изменить его рН на единицу. Буферная емкость возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве. Буферные свойства проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферный раствор часто готовят смешением р-ров равной концентрации обоих компонентов либо прибавлением к р-ру одного компонента соответствующего кол-ва реагента, приводящего к образованию равной концентрации сопряженной формы. Интервал рН (равный обычно рКа± 1), в к-ром данная буферная система может поддерживать постоянное значение рН, называется областью буферирования. В справочной литературе имеются подробные рецепты приготовления кислотно-основных буферных растворов для различных значений рН.
|
||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 223; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.111.63 (0.006 с.) |



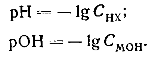




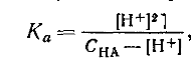

 Если кислота диссоциирована в незначительной степени
Если кислота диссоциирована в незначительной степени

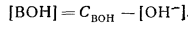
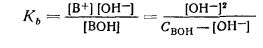


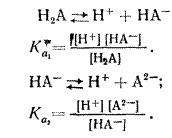

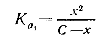



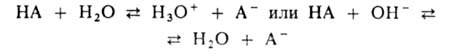

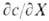 , где X - характеристика среды, с -концентрация одного из компонентов буферной смеси или добавленного в-ва, количественно реагирующего с одним из компонентов с образованием другого.
, где X - характеристика среды, с -концентрация одного из компонентов буферной смеси или добавленного в-ва, количественно реагирующего с одним из компонентов с образованием другого.


