
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Когда фактор эквивалентности равен единице, нормальная концентрация равна молярной.Содержание книги
Поиск на нашем сайте
Подготовка к коллоквиуму Количество вещества пропорционально числу элементарных объектов. Обозначают эту величину п(х), где х - химическая формула элементарного объекта. Единицей измерения количества является моль. Один моль вещества содержит 6,022-1023 элементарных объектов (атомов, молекул, ионов, электронов и других элементарных частиц). В количественном анализе часто используют и дольную единицу - миллимоль (ммоль): I моль * 1000 ммоль. Молярная масса М(х) характеризует массу единицы количества вещества (I моль) и определяется как отношение массы вещества к его количеству п(х):
Массу обычно измеряют в граммах или миллиграммах, а молярную массу выражают в г/моль или мг/ммоль. Молярная концентрация показывает количество растворенного вещества в единице объема раствора. Молярная концентрация обозначается С(х) и записывается соответственно определению как:
Численные значения молярной концентрации выражают в моль/л или ммоль/мл. Растворы с молярной концентрацией атомов,молекул, ионов называют молярными. 0,1моль/л =0,1M (здесь буква М обозначает «молярный»). Нормальная концентрация показывает количество эквивалентов растворенного вещества в единице объема раствора.
В системе СИ под эквивалентом понимают некую реальную или условную частицу, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентной одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях). Эквиваленты веществ не являются постоянными, они зависят от типа реакции, в которой участвуют эти вещества. Единицы измерения нормальной концентрации: моль/л или ммоль/мл.
Молярная масса эквивалента М(1/z x) связана с молярной массой вещества х соотношением (f=1/z фактор эквивалентности)
Когда фактор эквивалентности равен единице, нормальная концентрация равна молярной.
Растворы с нормальной концентрацией называют нормальными. I моль/л = I н (буква н обозначает нормальную концентрацию). Массовая концентрация Т(х), или mump вещества, выражает концентрацию в единицах массы вещества, растворенного в единице объема раствора:
Единицы измерения: г/л, мг/мл, г/мл, мкг/мл. Титр по определяемому веществу Т(R/х) показывает, какая масса анализируемого вещества Т(х) реагирует с I мл рабочего раствора титранта R:
Зная T(R/x) и объем (мл) рабочего раствора V(R), затраченного на титрование, рассчитывают массу определяемого вещества в граммах:
Массовая доля w(x) вещества показывает, какую часть составляет масса вещества х от общей массы (mобщ-) раствора или смеси веществ:
Основной единицей измерения является единица. В количественном анализе массовую долю, как правило, измеряют в процентах (поэтому иногда ее называют процентной концентрацией). Она характеризует содержание компонента как в твердом веществе, так и в растворе:
Плотность раствора р характеризует массу единицы объема раствора:
Используют единицу измерения г/см3, совпадающую с единицей измерения титра раствора (г/мл). Однако эти понятия не тождественны, поскольку масса раствора включает массу растворителя и растворенных веществ. Массовая же концентрация (титр) характеризует только массу растворенного вещества в единице объема. Титриметрический метод анализа основан на измерении объема реагента с точно известной концентрацией (титранта), пошедшего на реакцию с определяемым веществом. Процесс постепенного прибавления титранта к раствору определяемого вещества называется титрованием. Титрование продолжают до достижения точки эквивалентности, то есть такой точки, в которой количество титранта химически эквивалентно количеству определяемого вещества ( закон эквивалентных соотношений ). Этот закон выражается формулой
(степень оттировывания равна единице). Приемы титрования Прямое титрование основано на непосредственном взаимодействии определяемого вещества х и титранта (R):
Массу анализируемого вещества находят по формуле
Если титруется часть раствора, то расчет массы вещества ведут по формуле:
где Vk - объем мерной колбы; VA - объем аликвоты (пипетки). Титрование по остатку (обратное титрование) проводят, когда невозможно прямое титрование. В этом случае к определяемому веществу добавляют вспомогательный реагент β, взятый в избытке:
Остаток непрореагировавшего вспомогательного реагента оттитровывают стандартным раствором титранта:
В момент эквивалентности все количество вспомогательного реагента р затрачено на реакции с определенным веществом х и титрантом R:
Расчет массы анализируемого веществапроизводят по формуле
где Когда точная концентрация вспомогательного реагента неизвестна, проводят дополнительное титрование, устанавливая соотношение между вспомогательным реагентом, взятым в том же объеме, что и при определении анализируемого образца, и титрантом:
В этом случае, учитывая соотношение
где V1(R) - объем титранта, пошедший на титрование вспомогательного реагента в отсутствие анализируемого вещества. Титрование заместителя применяют, когда нет подходящей реакции или индикатора для прямого титрования. В этом случае к определяемому веществу х добавляют вспомогательный реагент β, с которым определяемое вещество образует стехиометрическое количество нового соединения, называемого заместителем у. Вспомогательный реагент выбирают с таким расчетом, чтобы получаемый заместитель было удобно определять прямым титрованием:
Так как
Подготовка к коллоквиуму Количество вещества пропорционально числу элементарных объектов. Обозначают эту величину п(х), где х - химическая формула элементарного объекта. Единицей измерения количества является моль. Один моль вещества содержит 6,022-1023 элементарных объектов (атомов, молекул, ионов, электронов и других элементарных частиц). В количественном анализе часто используют и дольную единицу - миллимоль (ммоль): I моль * 1000 ммоль. Молярная масса М(х) характеризует массу единицы количества вещества (I моль) и определяется как отношение массы вещества к его количеству п(х):
Массу обычно измеряют в граммах или миллиграммах, а молярную массу выражают в г/моль или мг/ммоль. Молярная концентрация показывает количество растворенного вещества в единице объема раствора. Молярная концентрация обозначается С(х) и записывается соответственно определению как:
Численные значения молярной концентрации выражают в моль/л или ммоль/мл. Растворы с молярной концентрацией атомов,молекул, ионов называют молярными. 0,1моль/л =0,1M (здесь буква М обозначает «молярный»). Нормальная концентрация показывает количество эквивалентов растворенного вещества в единице объема раствора.
В системе СИ под эквивалентом понимают некую реальную или условную частицу, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентной одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях). Эквиваленты веществ не являются постоянными, они зависят от типа реакции, в которой участвуют эти вещества. Единицы измерения нормальной концентрации: моль/л или ммоль/мл.
Молярная масса эквивалента М(1/z x) связана с молярной массой вещества х соотношением (f=1/z фактор эквивалентности)
Когда фактор эквивалентности равен единице, нормальная концентрация равна молярной.
Растворы с нормальной концентрацией называют нормальными. I моль/л = I н (буква н обозначает нормальную концентрацию). Массовая концентрация Т(х), или mump вещества, выражает концентрацию в единицах массы вещества, растворенного в единице объема раствора:
Единицы измерения: г/л, мг/мл, г/мл, мкг/мл. Титр по определяемому веществу Т(R/х) показывает, какая масса анализируемого вещества Т(х) реагирует с I мл рабочего раствора титранта R:
Зная T(R/x) и объем (мл) рабочего раствора V(R), затраченного на титрование, рассчитывают массу определяемого вещества в граммах:
Массовая доля w(x) вещества показывает, какую часть составляет масса вещества х от общей массы (mобщ-) раствора или смеси веществ:
Основной единицей измерения является единица. В количественном анализе массовую долю, как правило, измеряют в процентах (поэтому иногда ее называют процентной концентрацией). Она характеризует содержание компонента как в твердом веществе, так и в растворе:
Плотность раствора р характеризует массу единицы объема раствора:
Используют единицу измерения г/см3, совпадающую с единицей измерения титра раствора (г/мл). Однако эти понятия не тождественны, поскольку масса раствора включает массу растворителя и растворенных веществ. Массовая же концентрация (титр) характеризует только массу растворенного вещества в единице объема. Титриметрический метод анализа основан на измерении объема реагента с точно известной концентрацией (титранта), пошедшего на реакцию с определяемым веществом. Процесс постепенного прибавления титранта к раствору определяемого вещества называется титрованием. Титрование продолжают до достижения точки эквивалентности, то есть такой точки, в которой количество титранта химически эквивалентно количеству определяемого вещества ( закон эквивалентных соотношений ). Этот закон выражается формулой
(степень оттировывания равна единице).
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |

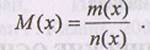




 где nH число ионов водорода принимающих участие в реакции
где nH число ионов водорода принимающих участие в реакции
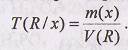

 .
.








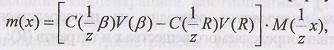
 - нормальная концентрация вспомогательного реагента; V(β) - объем вспомогательного реагента, взятый для определения; V(R) - объем титранта, пошедший на титрование остатка вспомогательного реагента.
- нормальная концентрация вспомогательного реагента; V(β) - объем вспомогательного реагента, взятый для определения; V(R) - объем титранта, пошедший на титрование остатка вспомогательного реагента.
 , рассчитывают массу определяемого вещества х следующим образом:
, рассчитывают массу определяемого вещества х следующим образом:

 то массу анализируемого вещества рассчитывают по формуле
то массу анализируемого вещества рассчитывают по формуле



