
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Индикаторы в методе кислотно-основного титрования.Содержание книги
Поиск на нашем сайте Одним из важнейших моментов в кислотно-основном титровании является выбор индикатора, так как только в присутствии подходящего индикатора можно своевременно зафиксировать момент, когда определяемое вещество и реагент прореагируют в эквивалентных количествах – момент конца титрования, и, следовательно, получить правильный результат анализа. Индикаторы по своей природе подобны веществам, участвующим в данной химической реакции. Так, индикаторы для кислотно-основного титрования представляют собой слабые органические кислоты или основания, растворимые в воде или смешанных водно-органических растворителях. Специфическое свойство кислотно-основных индикаторов состоит в том, что их молекулярная и ионизированная (солевая) формы значительно отличаются по окраске. Индикаторы, у которых окрашена только одна форма, называют одноцветными (например, фенолфталеин), в отличие от двухцветных, у которых обе формы окрашены в разные цвета (например, метилоранж). Индикаторы должны иметь интенсивную окраску, чтобы при незначительных их концентрациях (порядка 10-4 – 10-5 моль/дм3) титруемый раствор был бы ими достаточно четко окрашен. Это требование обусловлено тем, что для превращения одной формы в другую индикаторы расходуют некоторое количество стандартного раствора реагента. Следовательно, количество индикатора должно быть минимальным, чтобы существенно не влиять на результат анализа. Если индикатор представляет собой слабую кислоту (ее формулу можно обозначить HInd), то в водном растворе имеет место следующее равновесие: HInd + H2O Û H3O++Ind- или HInd Û H+ + Ind- При этом окраска молекулярной формы HInd и окраска сопряженного с ней основания Ind- различаются, и то, какую окраску будет иметь раствор, зависит от преобладающей формы индикатора в растворе, которая, согласно равновесию, зависит от величины рН. Константа равновесия является константой диссоциации индикатора (справочная величина), - наиболее важная его характеристика, на основе которой выполняют выбор индикатора:
Окраска раствора зависит от соотношения концентраций молекулярной и ионной форм индикатора, которые меняются в процессе титрования, т.к. меняется рН раствора, и, следовательно, существует такое значение рН, при которой индикатор наиболее резко меняет свою окраску:
Визуально изменение окраски раствора заметно, когда концентрация одной окрашенной формы примерно в 10 раз превышает концентрацию другой. В соответствии с принципом Ле-Шателье в кислой среде будет преобладать форма HInd (кислотная, молекулярная форма индикатора), и окраска раствора будет определяться окраской данной формы. Иными словами, когда отношение
то окраска раствора соответствует окраске молекулярной форме индикатора. При добавлении щелочи концентрация диссоциированной (ионной) формы индикатора будет увеличиваться, и при соотношении:
окраска раствора будет соответствовать окраске преобладающей ионной формы индикатора. Если концентрация ионов Н+ в растворе достигнет величины константы диссоциации индикатора [H+] = KHInd, то и в этом случае раствор будет иметь смешанную или промежуточную окраску, которая воспринимается в интервале соотношения Верхний и нижний пределы величины рН, при которых индикатор будет заметно изменять свою окраску, составляют соответственно: рН = рКHInd + lg10 = рКHInd + 1, рН = рКHInd + lg10-1 = рКHInd – 1; следовательно, получают интервал перехода окраски индикатора: ∆рН = рКHInd То значение рН, при котором кислотно-основный индикатор наиболее резко меняет свою окраску, называется показателем титрования рТ индикатора. В процессе титрования в тот момент, когда наблюдается наиболее резкое изменение окраски раствора от добавленной одной избыточной капли стандартного раствора реагента, титрование следует закончить. При проведении кислотно-основного титрования индикатор подбирают таким образом, чтобы значение показателя титрования индикатора рТ находилось как можно ближе к значению рН точки эквивалентности титруемого раствора. В таблице 1 представлены некоторые кислотно-основные индикаторы и их характеристики. Таблица 1 – Важнейшие кислотно-основные индикаторы
Лабораторная работа №2
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 345; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

 (4.3)
(4.3)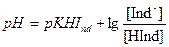 (4.4)
(4.4) ,
,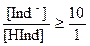 ,
,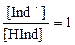 и [Ind-] = [HInd],
и [Ind-] = [HInd], от 0,1 до 10.
от 0,1 до 10. 1 (4.5)
1 (4.5)


