
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение адсорбции из растворов на твердом адсорбенте.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если в бинарный водный раствор внести твердый адсорбент, то на его поверхности могут адсорбироваться как молекулы растворителя, так и растворенного вещества – в общем случае это конкурентный процесс и конечный результат зависит как от природы (полярности) поверхности адсорбента, так и от химической природы компонентов раствора. Качественно предсказать характер адсорбции можно, руководствуясь правилом уравнивания полярностей контактирующих фаз (правило П.А. Ребиндера): на межфазной поверхности преимущественно сорбируется тот компонент раствора, который способен снижать разность полярностей контактирующих фаз, образуя адсорбционный слой определенного строения. Следовательно, речь идет об избирательной адсорбции, когда на поверхности твердого адсорбента накапливается исключительно растворенное вещество, которое называют адсорбатом или поверхностно-активным (ПАВ). Типичными ПАВ являются дифильные органические молекулы, в состав которых входит гидрофильная полярная группа (–ОН, –СООН, –NH2, –NO2, –SO3H, –SO3Na, –COONa и др). и неполярный гидрофобный углеводородный радикал. Подобные молекулы способны взаимодействовать одновременно с полярными и неполярными средами. Они самопроизвольно накапливаются на границах раздела фаз и понижают тем самым избыточную поверхностную энергию, ориентируясь в адсорбционном слое гидрофильной частью в сторону полярной фазы, а гидрофобной частью – в сторону неполярной. Так, например, в случае бинарных растворов спирт-вода и спирт-бензол избирательная адсорбция спирта наблюдается при внесении в первый раствор активированного угля (неполярная поверхность), а во второй раствор – силикагеля (полярная поверхность). Адсорбция на границе твердый адсорбент – раствор ПАВ представляет собой самопроизвольное изменение концентрации растворенного ПАВ в поверхностном слое по сравнению с его концентрацией в объеме жидкой фазы. К числу наиболее распространенных пористых адсорбентов относятся активированные угли, получаемые из каменного угля, дерева, костей животных, ореховых косточек и др. Адсорбирующее действие активированного угля обусловлено его большой удельной поверхностью, что позволяет использовать данный адсорбент для различных целей: извлечение из растворов посторонних веществ, поглощение газов, обесцвечивание жидкостей и т.д. Изучение адсорбции уксусной кислоты (ПАВ) на активированном угле основано на определении концентрации уксусной кислоты в растворе до контакта с адсорбентом со и после наступления адсорбционного равновесия c равн, т. е., до и после адсорбции, причем c равн< c о. Количественной характеристикой процесса адсорбции является величина удельной адсорбции Г. Удельная адсорбция Г – это равновесное количество поглощенного вещества, приходящееся на единицу площади поверхности или единицу массы твердого адсорбента, [ммоль/г]. Количество адсорбированной активированным углем кислоты рассчитывают по формуле: n (CН3СООН) = V∙(cо – cравн) (10.1), где V [см3] – объем раствора уксусной кислоты, из которого велась адсорбция. Величину удельной адсорбции Г рассчитывают по формуле:
где Γ – избыток ПАВ в поверхностном слое в расчете на единицу массы адсорбента, ммоль/г; V р-р – объем взятого раствора ПАВ, см3; m – масса адсорбента, г. График зависимости удельной адсорбции Г от равновесной концентрации ПАВ в растворе при постоянной температуре называется изотермой адсорбции. Различают изотерму адсорбции при низких концентрациях ПАВ в системе, когда адсорбция завершается образованием мономолекулярного слоя из молекул адсорбата на поверхности твердого адсорбента, и изотерму адсорбции при более высоких концентрациях адсорбата, когда уже происходит полимолекулярная адсорбция. Для определения вида изотермы адсорбции в координатах Γ (c равн ) готовят серию растворов с разной начальной концентрацией ПАВ и далее определяют концентрацию ПАВ в растворе после установления адсорбционного равновесия, анализируя фильтрат после отделения твердого адсорбента. По результатам эксперимента рассчитывают зависимость Γ (c равн ) по уравнению (2) и строят график изотермы адсорбции, типичный вид которого представлен на рисунке 1. В этом случае изотерма адсорбции содержит три участка: при очень малых концентрациях участок I изотермы прямолинеен, т.к. удельная адсорбция Г возрастает практически прямо пропорционально концентрации ПАВ в растворе; при больших концентрациях ПАВ участок III изотермы имеет вид горизонтальной прямой, где отсутствует зависимость Γ (c равн ), т.к. удельная адсорбция, достигнув величины Γ∞ , уже не меняется при дальнейшем увеличении равновесной концентрации ПАВ в растворе.
Рисунок 1 – Изотерма избирательной адсорбции ПАВ из раствора на твердом адсорбенте Экспериментально установленный ход изотермы адсорбции можно описать полуэмпирическим уравнением мономолекулярной адсорбции Ленгмюра:
где Γ∞ – предельная адсорбция, соответствующая образованию на поверхности адсорбента насыщенного мономолекулярного слоя ПАВ, ммоль/г и k – константа адсорбции, дм3/моль – параметры уравнения Ленгмюра, определяемые из опытных данных. Обработку экспериментальных данных, позволяющих вычислить Γ∞ и k, обычно проводят на основе линейной формы уравнения Ленгмюра (10.4):
Рисунок 2 – К расчету параметров уравнения Ленгмюра. и если экспериментальные точки укладываются на прямую линию в координатах Параметры уравнения Ленгмюра Г∞ и k определяют при обработке линейной зависимости Зная значение Г∞ , можно оценить удельную поверхность адсорбента, если принять, что строение мономолекулярного насыщенного адсорбционного слоя ПАВ соответствует модели, приведенной на рисунке 3:
Рисунок 3 – Строение мономолекулярного насыщенного адсорбционного слоя ПАВ. Расчетная формула имеет вид:
где S уд – удельная поверхность адсорбента, м2/г; Γ∞ - предельная адсорбция, ммоль/г; NA = 6,022·1023 моль-1 – постоянная Авогадро; So – площадь посадочной площадки для одной молекулы ПАВ, которая для большинства спиртов и одноосновных карбоновых кислот лежит в пределах 0,2 ÷ 0,3 нм2/молекула; 10-3 – переводной множитель из ммоль в моль. Необходимо помнить, что любой адсорбент – это пористый материал и количество молекул ПАВ, которое сорбируется на его поверхности, зависит от соотношения размеров молекул ПАВ и пор. Если молекулы ПАВ крупные, то часть поверхности, приходящаяся на мелкие поры, остается для молекул ПАВ недоступной, поэтому значение удельной поверхности есть величина оценочная, зависящая от вещества, по которому она определена. Как показывает опыт, начальный участок изотермы адсорбции (рисунок 1, (I)) при малых концентрациях ПАВ (с равн→0) является прямолинейным, т.е. адсорбция Г прямо пропорциональна концентрации ПАВ (Г ≈ Γ∞kсравн – закон Генри), а при сравнительно больших концентрациях ПАВ (kсравн >> 1) (рисунок 1, (III)) достигается предел адсорбции (Г ≈ Γ∞), когда ее величина уже не зависит от концентрации ПАВ в растворе. В области средних концентраций ПАВ (рисунок 1, (II)) зависимость Г(с равн ) может быть описана с помощью эмпирического уравнения Фрейндлиха:
где Кфр и Логарифмическая форма уравнения Фрейндлиха:
представляет собой уравнение прямой в координатах lg Г от lg cравн. и если экспериментальные точки укладываются на прямую линию в указанных координатах, то этот факт является критерием возможности описания участка II изотермы адсорбции с помощью уравнения Фрейндлиха. Параметры уравнения находят при обработке прямой по методу наименьших квадратов (рисунок 4).
Рисунок 4 – К расчету параметров уравнения Фрейндлиха. Как показывает опыт, при адсорбции ПАВ из водного раствора на неполярной поверхности активированного угля адсорбционная активность растворенного вещества растет по мере роста длины углеводородного радикала в гомологическом ряду ПАВ (правило Дюкло-Траубе). При этом параметры уравнений Ленгмюра k и Фрейндлиха Кфр растут, а в области II (рисунок 1) усиливается крутизна хода изотермы адсорбции (параметр Лабораторная работа № 7
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 448; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.89.181 (0.009 с.) |

 (10.2),
(10.2),
 (10.3)
(10.3) (10.4)
(10.4)

 от
от  (рисунок 2), то этот факт являетсякритерием отнесения изотермы адсорбции к ленгмюровскому типу.
(рисунок 2), то этот факт являетсякритерием отнесения изотермы адсорбции к ленгмюровскому типу.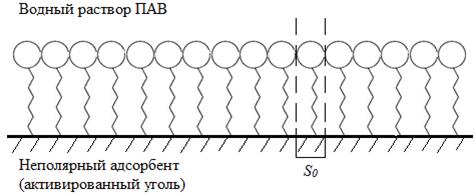
 (10.5)
(10.5) (10.6)
(10.6) – параметры уравнения, определяемые из экспериментальных данных, причем
– параметры уравнения, определяемые из экспериментальных данных, причем  (10.7)
(10.7)



