
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Буферная ёмкость – мера устойчивости буферного раствора.Содержание книги
Поиск на нашем сайте
Разные буферные растворы из области буферного действия не в равной мере эффективно противостоят изменению рН в результате добавок сильной кислоты или щёлочи. Мерой устойчивости буферного раствора к указанным выше внешним воздействиям является его буферная ёмкость. Буферной ёмкостью раствора с заданным значением рН называется число молей эквивалентов сильной кислоты или щёлочи, которые нужно добавить к 1 дм3 данного буферного раствора, чтобы изменить его рН на единицу и обозначается: по кислоте Вк , моль Н+ / дм3 буф. р-ра; по щёлочи Вщ , моль ОН- / дм3 буф. р-ра. Рассчитанную таким образом буферную емкость называют теоретической буферной емкостью. Буферная ёмкостьраствора зависит как от исходного значения рН раствора, так и от абсолютных концентраций (количеств) кислоты и сопряжённого основания в нём. Заметим, что согласно уравнениям (6.1–6.3), величина рН буферного раствора определяется только отношением
и не зависит от абсолютных значений этих величин.
1) зависимость буферной ёмкости от рН представлена на рисунке, из которого видно, что наиболее устойчивы растворы со значением рН близким к рК сопряженной кислоты: а) кислотный буфер:
б) основный буфер – форма зависимости сохраняется, а экстремум кривой приходится на значение рН = 14 - рКb. 2) увеличение абсолютных концентраций (количеств) компонентов буферного раствора с одним и тем же значением рН увеличивает их буферную ёмкость. Если приготовить, например, три буферные системы, которые подчиняются приведённым ниже требованиям:
то согласно уравнению (2) эти растворы будут иметь одинаковые значения рН, но разную буферную ёмкость: Вў< ВІ< ВІў. Экспериментальное определение буферной ёмкости связано с измерением рН буферного раствора на рН – метре до и после внесения добавки сильной кислоты или щёлочи к заданному объёму V буф. а) для буферного раствора объёмом V буф. измеряют рН(нач), вносят добавку кислоты:
обычно вносят небольшой объём концентрированного раствора сильной кислоты, который практически не изменяет величину V буф, т.е. V доб << V буф; измеряют рН(кон.) и определяют
ЅDрН Ѕ= ЅрН(кон) - рН(нач)Ѕ. Найденные величины подставляют в расчётную формулу:
б) аналогично определяют буферную ёмкость по щёлочи:
Расчет теоретической буферной ёмкости по кислоте для данного буферного раствора можно осуществить на основе уравнения (6.7), если положить в нём pH(кон) = рН(нач) – 1, и далее рассчитать величину добавки кислоты в количестве х моль, которая приведет к уменьшению рН на единицу в буферном растворе, содержащем первоначально n осн и n к моль сопряженных основания и кислоты, причем далее эта добавка пересчитывается на 1 дм3 буферного раствора:
где V буф, см3 – объём буферного раствора содержащего n осни n к моль сопряженных основания и кислоты. Аналогично проводят расчёт буферной ёмкости по щёлочи с использованием уравнения (6.8), в котором полагают pH(кон.) = рН(нач.) + 1. Дальнейший расчёт аналогичен предыдущему.
ОБУЧАЮЩИЕ ЗАДАЧИ 1. Определить рН ацетатного буферного раствора, приготовленного путем смешивания 100 см3 раствора уксусной кислоты (НAс) с молярной концентрацией 0,1 моль/дм3 и 200 см3 раствора ацетата натрия (NaAc) с молярной концентрацией 0,2 моль/дм3. Как изменится рН при добавлении к нему 30 см3 0,2М раствора NaOH? Решение: а) Рассчитаем количество компонентов в буферном растворе:
б) Рассчитаем число моль ионов ОН, - внесённых с добавкой щелочи: n (ОН-) = c (NaOH) Ч V доб = 0,2 Ч 0,03 = 0,006 [моль] В результате связывания ионов ОН- кислотой НАс происходит, изменение количеств сопряжённых кислоты и основания в буферном растворе:
2. Необходимо приготовить буферный раствор с рН = 4,3. В распоряжении имеются муравьиная и угольная кислоты, гидроксид натрия. Какие вещества и в каких молярных соотношениях следует смешать для приготовления нужного раствора? Решение: а) Проведём анализ возможных буферных систем, которые можно приготовить на основе указанных в задаче веществ:
Величина рН заданного буферного раствора лежит в области буферного действия формиатного буферного раствора, поэтому для его приготовления необходимо взять муравьиную кислоту и гидроксид натрия. б) Буферный раствор с заданным значением рН готовят методом частичной нейтрализации муравьиной кислоты гидроксидом натрия.
где n к – количество кислоты в исходном растворе, х – количество добавленного NaOH, приводящее к формиатному буферному раствору с рН = 4,3. Дальнейший расчёт ведут по уравнению Г-Х (1):
Таким образом, для приготовления буферного раствора с рН = 4,3 количество муравьиной кислоты должно превышать необходимое количество гидроксида натрия в 1,28 раза. Лабораторная работа №3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 287; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.2.6 (0.008 с.) |

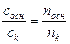


 ,
,
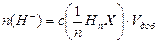
 (6.9)
(6.9) (6.10)
(6.10)
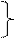

 HCOONa
HCOOH
HCOONa
HCOOH
 NaHCO3
H2CO3
NaHCO3
H2CO3
 NaHCO3
Na2CO3
NaHCO3
Na2CO3




