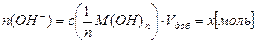Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности равновесий в буферных растворах и механизм буферного действия.Содержание книги
Поиск на нашем сайте
Все дальнейшее обсуждение свойств буферных растворов и расчёты будут проведены на примере гидрофосфатного буферного раствора: Na2HPO4 (осн), NaH2PO4 (к) Соль NaH2PO4 (к), выполняющая роль кислоты, диссоциирует в буферном растворе на ионы:
где сk – концентрация дигидрофосфата натрия (к) в буферном растворе, а a – степень диссоциации фосфорной кислоты по второй ступени. Соль Na2HPO4 (осн), выполняющая роль сопряжённого основания, диссоциирует в буферном растворе на ионы и частично гидролизуется по аниону:
где сосн – концентрация гидрофосфата натрия в буферном растворе, а h – степень гидролиза гидрофосфат - ионов. В буферной системе ионы H2PO4-, образующиеся при диссоциации NaH2PO4 (к) и являющиеся донорами протонов Н+, подавляют гидролиз ионов HPO42-, образующихся при диссоциации Na2HPO4 (осн) и выполняющих роль акцептора протонов, и наоборот, ионы HPO42- подавляют диссоциацию ионов H2PO4-. Это означает, что равновесные концентрации анионов практически совпадают с концентрацией соли в буферном растворе: [H2PO4-] = (1-a)Ч ck (NaH2PO4)a » 0» ck (NaH2PO4) [HPO42-] = (1-h)Ч c 0(Na2HPO4)h » 0» c 0(Na2HPO4). Буферное действие фосфатного буферного раствора обеспечивается за счёт смещения равновесия, существующего между ионами H2PO4- и HPO42- в буферном растворе при добавлении сильной кислоты или щелочи, которое является результатом протекания реакций между компонентами буферного раствора и добавляемыми ионами водорода или гидроксила: а) при добавлении сильной кислоты HnX в буферный раствор поступает количество добавленных ионов водорода:
сопряжённое основание буферной системы связывает ионы Н+, в результате чего общее содержание сопряженной кислоты в буферном растворе растёт, а основания – уменьшается, а активная кислотность буферного раствора – рН -остаётся неизменной или незначительно уменьшается:
HPO42- + H+(добавка) ® H2PO4- – ионная форма уравнения буферного действия.
б) при добавлении щёлочи М(ОН)n в буферный раствор поступает количество введенных гидроксид-ионов:
сопряженная кислота буферной системы связывает введенные ионы ОН-, в результате чего общее содержание сопряженного основания в буферном растворе растёт, а кислоты – уменьшается, но активная кислотность буфера – рН остаётся неизменной или незначительно увеличивается:
H2PO4- + OH-(добавка) ® HPO42- + H2O – ионная форма уравнения буферного действия.
Буферное действие по отношению к кислотам и щелочам сохраняются до тех пор, пока количества компонентов буферной системы, связывающих ионы Н+ или ОН-, будут больше количеств этих ионов, поступающих в буферный раствор извне.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 292; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.107.243 (0.009 с.) |