
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчёт концентраций ионов и недиссоциированных молекул в растворахСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
слабых электролитов ( a ® 0, с дисс. = a × с 0). Закон разбавления Оствальда. Диссоциация слабой кислоты Слабые кислоты диссоциируют обратимо; слабые многоосновные кислоты – обратимо и ступенчато. Пусть молярная концентрация приготовленного раствора слабой кислоты равна с 0, а ее степень диссоциации 0 < a << 1; к моменту установления равновесия продиссоциировало с дис. = a с 0 кислоты, тогда:
Молярные концентрации всех компонентов раствора в состоянии динамического равновесия называют равновесными концентрациями и записывают их в квадратных скобках. Связь между равновесными концентрациями осуществляется через константу диссоциации, величину которой при необходимости можно найти в справочнике: Кдис. =
где для слабых электролитов часто используют приближённую формулу, считая, что с 0 – [H+]» с 0, поскольку с 0 >> сдис. = [H+]. C другой стороны, в выражение для константы диссоциации, можно ввести степень диссоциации: Кдис . = Таким образом, a» Зависимость степени диссоциации слабого электролита от его природы (Кдис.) и концентрации в растворе называют законом разбавления Оствальда: при разбавлении раствора слабого электролита степень его диссоциации растет. Концентрацию ионов водорода в растворе слабой кислоты с учетом равновесия ее диссоциации рассчитывают по уравнению: [H+] = [X–] = a с 0 =
В случае диссоциации слабых многоосновных кислот используется аналогичная расчётная схема, в которой учитывается диссоциация только по первой ступени, а диссоциацией по следующим ступеням можно пренебречь, т.к. Кдис. по последующим ступеням достаточно низкие, что является основанием учета диссоциации по первой ступени. В этом случае для расчётов концентрации ионов водорода в растворах слабых многоосновных кислот используют справочныее значения их констант диссоциации по первой ступени. Константу диссоциации кислоты принято обозначать К а (от английского слова asid - кислота).
Диссоциация слабого основания. Диссоциация воды. Ионное произведение воды Кw. Аналогичные по форме соотношения можно получить при расчёте равновесия диссоциации слабого основания, например, гидроксида аммония NH4OH:
NH4OH Û NH4+ + OH- a» где с 0 – молярная концентрация аммиака в его растворе, а Кдис . – справочное значение константы диссоциации гидроксида аммония; константу диссоциации основания обозначают Кb (от английского слова base – основание). Диссоциация слабого электролита – обратимый процесс, в котором положение равновесия можно смещать влево (подавление диссоциации) за счёт добавления в раствор сильных электролитов, при диссоциации которых образуется ион, одноимённый с ионом слабого электролита. Смещение равновесия вправо достигается за счёт связывания продуктов диссоциации в менее диссоциирующие соединения. Например, диссоциацию уксусной кислоты можно подавить за счёт добавления в её раствор ацетата натрия или сильной кислоты, поставляющей в раствор Н+. Особый интерес представляет диссоциация воды – слабого амфотерного электролита: H2O Û H+ + OH-, где равновесные концентрации ионов связаны друг с другом через константу диссоциации: Кдис . = ее величина может быть вычислена при любой температуре на основании данных измерения электропроводности чистой воды. При 22 0С Кдис . равна 1,8·10-16; пренебрегая ничтожно малой степенью диссоциации воды, концентрацию молекул воды как в чистой воде, так и в разбавленных водных растворах можно считать величиной постоянной:
Тогда выражение для константы диссоциации можно переписать:
произведение [Н+]·[ОН-]=10-14 называют ионным произведением воды и обозначают Кw: [OH-]·[H+]= Кw =10-14 (5.11) Для чистой воды и для разбавленных водных растворов любых веществ ионное произведение воды Кw при данной температуре является величиной постоянной и равно 10-14. С повышением температуры Кw возрастает, с понижением – уменьшается. Так, например, при 100 0С ионное произведение воды Кw =10-12. Используя величину ионного произведения воды Кw и известную концентрацию одного из ионов воды, исходя из формулы (5.11), можно вычислить концентрацию ионов Н+ и ОН- в любом водном растворе:
В чистой воде из условия электронейтральности:
Растворы, в которых [Н+]=[ОН-] =10-7 моль/дм3, называются нейтральными. Если [H+] > [OH-] > 10-7 моль/дм3 (>10-6...10-1моль/дм3) растворы называются кислыми, если [H+] < [OH-] < 10-7моль/дм3 – щелочными растворами (<10-8...10-14 моль/дм3). На практике кислотность раствора в водных средах принято характеризовать не молярной концентрацией ионов водорода или гидроксила, а безразмерной величиной – водородным показателем рН. Водородный показатель рН – количественная характеристика кислотности среды – величина, равная отрицательному десятичному логарифму равновесной концентрации ионов водорода в растворе: рН = -lg[H+]. Аналогично гидроксильный показатель рОН: рОН = -lg[OH-]. В любом водном растворе [OH-]·[H+]=Кw=10-14 (при 220С). Логарифмируя это выражение и учитывая выражения для рН и рОН, получаем: рН + рОН = 14 (5.12) В нейтральной среде рН = рОН = 7,0; в кислой среде рН < 7,0; в щелочной – рН > 7,0. В разбавленных водных растворах различных веществ величина рН меняется от 0 до 14. ОБУЧАЮЩИЕ ЗАДАЧИ 1.Вычислить ионную силу в растворе 0,1 моль/дм3 сульфата натрия. Решение: Na2SO4→2Na+ + SO42- c [
2. Вычислить концентрацию ионов ОН-, рОН и рН для 0,1 моль/дм3 раствора аммиака (К b =1,76·10-5). Решение: NH3 + H2O Û NH4OH Û NH4+ + OH-
Ответ: [ОН-]=1,32·10-3; рОН=2,88; рН=11,12.
3. Константа диссоциации уксусной кислоты равна 1,75 10-5. Определите массу ацетата натрия, которую необходимо добавить к 300 см3 0,1 моль/дм3 раствора уксусной кислоты, чтобы понизить концентрацию ионов водорода в растворе в 100 раз. Найдём равновесную концентрацию ионов водорода в 0,1 моль/дм3 растворе CH3COOH:
При добавлении CH3COONa концентрация ионов H+ должна быть в 100 раз меньше (диссоциация частично подавлена), т.е. 1,32 ∙ 10-5 моль/дм3. Пусть необходимо внести в 1 дм3 исходного раствора кислоты х моль соли, что соответствует добавке x моль ацетат- ионов, тогда равновесные концентрации равны: [H+] = 1,32×10-5 моль/дм3 [CH3COO-] = (x + 1,32 ∙ 10-5) моль/дм3» x моль/дм3 [CH3COOH] = с 0 – [H+] = 0.1 – 1.32× 10-5» 0,1 моль/дм3 и, подставив значения равновесных концентраций в выражение для константы диссоциации уксусной кислоты:
находим x = 0,133 моль, что соответствует концентрации соли с (CH3COONa) = 0,133 моль/дм3. Масса добавки ацетата натрия к 300 см3 раствора равна: m (CH3COONa) = с (CH3COONa) × V р-р × M (CH3COONa) = 0,133 × 0,3 × 82 = 3,27 г Ответ: m (CH3COONa) = 3,27 г.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 620; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.247.237 (0.008 с.) |

 , (5.7)
, (5.7) ,
, (5.8)
(5.8) (5.9)
(5.9) и [OH-] = [NH4+] = a × с 0 =
и [OH-] = [NH4+] = a × с 0 =  ;
; .
.

 .
.
 ]: 0,1 0,2 0,1
]: 0,1 0,2 0,1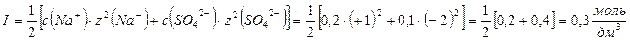 Ответ: ионная сила 0,1 моль/дм3 Na2SO4 равна 0,3 моль/дм3.
Ответ: ионная сила 0,1 моль/дм3 Na2SO4 равна 0,3 моль/дм3.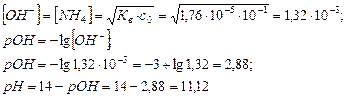
 .
.



