
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость рН раствора уксусной кислоты от ее концентрации.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Постройте график зависимости рН раствора СНзСООН от ее концентрации со(по теоретическим и экспериментальным данным).
Контрольные вопросы и задачи: 1.Что называют степенью диссоциации электролита? Чему равна степень диссоциации сильных электролитов? 2.В ряду электролитов NaOH, КОН, NH4OH, H2O, CH3COOH, H2S, HNO3, HC1 подчеркните те, диссоциация которых в водных растворах протекает обратимо. 3.Составьте уравнения электролитической диссоциации уксусной и сероводородной кислот (две ступени). Запишите выражения соответствующих констант диссоциации. 4.Вычислите ионную силу 0,05М раствора NaOH. Найдите активность иона ОН- ( 5.Рассчитайте концентрацию ионов ОН- в 0,05 М растворе NH4OH. Ответ: 9,4; 10-4 моль/л. 6.Рассчитайте активность ионов ОН- в растворе, если Ответ: 10 моль/л. 7.Активность ионов ОН- в водном растворе равна 10-3моль/л. Вычислите рН раствора. Ответ: 11,0. 8.Рассчитайте рН 0,05 М водного раствора HNO3 без учета ионной силы раствора. Ответ. 1,3. 9.Рассчитайте рН 0,005 М водного раствора КОН без учета ионной силы раствора. Ответ. 11,7. 10Найдите молярную концентрацию раствора НС1, рН которого 2,5 (считайте 11.Найдите молярную концентрацию раствора NaOH, pH которого 12 (считайте 12.Что называют разведением раствора? Какова размерность разведения? 13.Что является аргументом и функцией в законе разведения Оствальда? 14.Зная константу диссоциации гидроксида аммония NH4OH. найдите: а) степень диссоциации; б) концентрацию ионов ОН-; в) рН раствора, если концентрация раствора NH4OH 0,01 моль/л. Ответ: 4,2%; 4,2·10-4 моль/л; 10,62. 15.Учитывая только первую ступень диссоциации, вычислите водородный показатель среды 0,02М раствора Н2СО3. Ответ: 4,02. 16.Сколько миллилитров 0,5 н. раствора НС1 нужно взять для приготовления 100 мл 0,01 н. НС1? Ответ: 2 мл. ГИДРОЛИЗ СОЛЕЙ Цель работы: изучение некоторых свойств водных растворов солей, связанных с реакцией гидролиза.
Гидролизом называют обменные химические реакции, протекающие с участием воды. Если в обменную реакцию с водой вступает соль, то взаимодействие называют гидролизом соли. Признаком гидролиза соли является изменение нейтральной реакции среды воды. Например, при растворении в воде хлорида аммония NH4C1 образуется избыток ионов Н+ и раствор подкисляется (рН < 7):
NH4C1 + Н20 Û NH4OH + HC1 или в ионном виде Если же растворить в воде ацетат натрия CH3COONa, раствор подщелачивается (рН > 7) вследствие образования избытка ионов ОН-:
CH3COONa + Н20 Û СН3СООН4 + NaOH или CH3COO- + Н20 Û СН3СООН + OH- Следовательно, водные растворы солей могут иметь кислую или щелочную реакцию среды потому, что они вступают в химическое взаимодействие с водой. При гидролизе некоторых солей рН воды не меняется. Однако не все соли вступают в реакцию гидролиза. Если растворить в воде хлорид калия, нейтральная реакция среды (рН = 7) характерная для чистой воды, не изменится, т.е. в растворе сохранится равенство
KCl + H2O Û KOH + HCl
Можно утверждать, что соли, образованные сильным основанием и сильной кислотой (KCl, LiNO3, NaCl и т.п.), в реакцию гидролиза не вступают. С водой взаимодействуют: 1) соли, образованные слабыми основаниями и сильными кислотами (NH4Cl, CuCl2, NH4NO3 и т.п.); 2) соли, образованные слабыми кислотами и сильными основаниями (Na2S, KCN, Na2CO3 и т.п.); 3) соли, образованные слабыми основаниями и слабыми кислотами (NH4CH3COO и т.п.). Из рассмотренных примеров следует, что в реакцию с водой вступают катионы слабых оснований и анионы слабых кислот. Если эти ионы многозарядные (Fe3+, Cu2+, CO32-, SiO32- и т.п.), их взаимодействие с водой обычно идет до образования основного кислого иона (первая ступень гидролиза), например:
Fe3+ + H2O Û FeOH2+ + H+ CO32- + H2O Û HCO3+ + OH-
О глубине протекания процесса гидролиза при заданных условиях можно судить по степени гидролиза соли b, являющейся отношением концентрации гидролизованных ионов (с) к их исходной концентрации (с0):
b =с/с0 Реакция гидролиза соли обратима. В прямом направлении (®) она протекает в сторону образования молекул (основных ионов) слабых оснований или молекул (кислых ионов) слабых кислот, а в обратном () в сторону образования молекул воды. Реакцию образования молекул воды из ионов Н+ и ОН- называют реакцией нейтрализации. Следовательно, реакция гидролиза соли обратна реакции нейтрализации.
К реакции гидролиза соли применимы все положения и законы учения о химическом равновесии. Константа равновесия реакции гидролиза называется константой гидролиза соли Кг. Ее величина характеризует соотношение между равновесными концентрациями (активностями) всех компонентов системы. Связь между константой гидролиза соли (Кг) и степенью гидролиза (b) в растворе заданной концентрации (С0) выражается законом Оствальда:
если β«1, то Равновесие процесса гидролиза, отвечающее равенству скоростей реакции гидролиза и нейтрализации (
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 542; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.141.236 (0.01 с.) |

 ) в этом растворе. Ответ: 0,05; 0,0425 моль/л.
) в этом растворе. Ответ: 0,05; 0,0425 моль/л.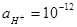 моль/л.
моль/л. ) Ответ: 0,003 М.
) Ответ: 0,003 М. ) Ответ: 0,01 М.
) Ответ: 0,01 М.
 :
:


 ,
,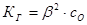

 ), подвижно и может быть смещено вправо (
), подвижно и может быть смещено вправо ( ) или влево (
) или влево ( ) в соответствии с принципом Ле Шателье. Так, например, при повышении температуры равновесие гидролиза смещается вправо, так как прямая реакция эндотермическая (DH > 0), а обратная (нейтрализация) – экзотермическая (DH < 0). При постоянной температуре Т равновесие гидролиза можно сместить вправо, уменьшая концентрацию раствора (разбавляя раствор); это следует из закона Оствальда: при КГ = constb тем больше, чем меньше с0.
) в соответствии с принципом Ле Шателье. Так, например, при повышении температуры равновесие гидролиза смещается вправо, так как прямая реакция эндотермическая (DH > 0), а обратная (нейтрализация) – экзотермическая (DH < 0). При постоянной температуре Т равновесие гидролиза можно сместить вправо, уменьшая концентрацию раствора (разбавляя раствор); это следует из закона Оствальда: при КГ = constb тем больше, чем меньше с0.


