
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взвешивание на технических весах.Содержание книги
Поиск на нашем сайте
Мерная химическая посуда. Мерной называют посуду, применяемую для измерения объемов жидкости. К ней относятся мерные цилиндры, пипетки, бюретки и мерные колбы. При измерении объемов необходимо, чтобы глаз наблюдателя и нижний мениск жидкости находился на одной горизонтальной линии. Нижний мениск жидкости должен быть на одном уровне с меткой. Мерные цилиндры применяются в тех случаях, когда измерение объема жидкости не требует большой точности. Мерные цилиндры – стеклянные сосуды с нанесенными на наружной стенке делениями, указывающими объем в миллилитрах. * Чтобы отмерить нужный объем жидкости, ее наливают в цилиндр до тех пор, пока нижний мениск жидкости не достигнет уровня нужного деления. Пипетки служат для отмеривания и переноса определенного объема жидкости. Обычные пипетки представляют собой стеклянные трубки небольшого диаметра с расширением посередине. Нижний конец пипетки слегка оттянут, и имеет диаметр около одного миллиметра. Пипетки бывают от 0,1 до 100 мл. В верхней части их имеется метка, до которой набирается жидкость. Для наполнения пипетки нижний конец ее опускают в жидкость с помощью резиновой груши набирают в нее жидкость, следя, чтобы кончик пипетки находился все время в жидкости. Жидкость набирают так, чтобы она поднялась на 2 – 3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем, придерживая в то же время пипетку большим и средним пальцами. Затем ослабляют нажим указательного пальца, в результате чего жидкость медленно вытекает из пипетки; как только нижний мениск жидкости опустится до метки, палец снова прижимают. Если на конце пипетки будет висеть капля, ее следует осторожно удалить. Введя пипетку в сосуд, в который нужно перенести жидкость, отнимают указательный палец и дают стечь жидкости по стенке сосуда. После того, как жидкость стечет, пипетку держат еще несколько секунд, прислоненной к стенке сосуда, слегка поворачивая ее. Жидкость выдувать из пипетки не следует, так как пипетка отградуирована с учетом оставшейся в ней капле. Бюретки позволяют отмерить любой объем жидкости в пределах ее емкости. Они представляют собой стеклянные градуированные трубки, снабженные притертым краном или имеющие несколько оттянутый конец, к которому с помощью резиновой трубки присоединяют стеклянный капилляр. Внутрь резиновой трубки закладывают стеклянную бусину, закрывающую выход жидкости из бюретки. При оттягивании резиновой трубки от бусины внутри ее образуется зазор для вытекания жидкости. Бюретку заполняют жидкостью через воронку. После этого, оттягивают резиновую трубку от бусины, полностью заполняют жидкостью стеклянный капилляр. Если этого сразу не удается, и в капилляре остается пузырек воздуха, поступают следующим образом: загибают резиновую трубку с капилляром так, чтобы кончик капилляра был направлен вверх, затем осторожно оттягивают резиновую трубку от бусины и вытесняют жидкостью весь воздух. Уровень жидкости устанавливают на нулевое деление после того, как работающий убедится, что в капилляре бюретки не осталось воздуха. Перед установкой уровня жидкости в бюретке должна быть на 2 – 3 см выше нулевого деления. Затем необходимо вынуть воронку из бюретки и осторожно слить жидкость до нулевого деления. *В системе СИ объем выражают в кубических метрах или его кратных долях (см3, дм3). Мерная посуда градуирована в миллилитрах (мл) или литрах (л); 1 мл соответствует 1 см3; 1 л соответствует 1 дм3. Мерные колбы применяют для приготовления растворов в определенном объеме. Они представляют собой плоскодонные стеклянные сосуды различной емкости. На горлышке колбы имеется метка, а на самой колбе число, указывающее ее емкость в миллилитрах. Для приготовления раствора в колбу наливают немного воды, вносят в нее растворяемое вещество и растворяют его в этом количестве воды, так как сразу налить нужный объем воды трудно, то сначала наливают ее на 0,5 – 1,0 см ниже метки, после чего доводят до метки, добавляя воду по каплям из пипетки. Затем плотно закрывают колбу пробкой и тщательно перемешивают раствор многократным переворачиванием колбы.
Правила взвешивания. 1.Перед взвешиванием проверяют, правильно ли по отвесу стоят весы: при правильной установке весов отверстие отвеса должно совпадать с вершиной конуса, находящегося у основания колонки. Подкручивать установочные винты, балансировочные гайки, сдвигать весы с установленного места не рекомендуется. При всех неисправностях весов обращаться к лаборанту. 2.Устанавливают нулевую точку весов. Для этого плавным поворотом арретира вправо приводят весы в рабочее состояние – дезориентируют и наблюдают колебания стрелки по нижней шкале. Если число делений при отклонении стрелки вправо и влево от центрального деления одинаково, то нулевая точка совпадает с центральным делением. Если же отклонения стрелки вправо и влево неодинаковы, то определяют среднее положение стрелки из трех – пяти показаний на шкале. Это положение стрелки и будет нулевой точкой весов. 3.Помещение или снятие взвешиваемого предмета и разновесок можно производить только при арретированнвх весах, т.е. когда, весы находятся в нерабочем состоянии. 4.Взвешиваемый предмет следует помещать на левую чашку весов, разновески – на правую. Как взвешиваемый предмет, так и разновески следует помещать на середину чашки. 5.Сыпучие вещества при взвешивании следует помещать на чашки весов в тиглях, бюксах или на листочках чистой бумаги. 6.По окончании взвешивания весы следует привести в полный порядок и убрать разновески. Титрование. Титрование - один из методов определения концентрации растворов, основанный на измерении объемов растворов, вступающих в реакцию. Титрование ведется до наступления точки эквивалентности, т.е. до момента, когда реакция в растворе пройдет до конца. Наиболее часто конец титрования определяется изменением цвета введенного индикатора. Зная концентрацию одного из растворов и их объемы, по закону эквивалентов (с. 10) рассчитывают концентрацию другого раствора. Для титрования в бюретку наливают раствор известной концентрации и приводят бюретку в рабочее состояние. Пипеткой отбирают точный объем раствора, концентрацию которого надо определить, и переносят его в коническую колбу. Если конец титрования определяется по индикатору, в колбу добавляют несколько капель индикатора. Колбу ставят на белый лист под бюретку и проводят титрование. Титрование заключается в осторожном сливании (по каплям) раствора из бюретки в колбу с анализируемым раствором, который непрерывно перемешивают. Титрование ведут до изменения цвета индикатора. Результат титрования (объем раствора, пошедшего на титрование) записывают. Выливают из колбы раствор, тщательно ополаскивают ее водой, вновь отмеривают пипеткой анализируемый раствор и переносят его в коническую колбу. Вновь приводят бюретку в рабочее состояние и повторяют титрование. Ели результаты титрования отличаются друг от друга более чем на 0,1 мл, титрование повторяют.
ЛАБОРАТОРНАЯ РАБОТА №2 Выполнение опыта
1.Проверьте герметичность прибора. Для этого закройте пустую пробирку пробкой с отводной трубкой от бюретки. Не трогая бюретку с пробиркой, переместите другую бюретку так, чтобы уровень воды в ней стал на 5-10 см выше, чем в первой бюретке. Если разница в уровнях не изменяется, прибор исправен, "держит"; если уровни в бюретках выравниваются, прибор негерметичен, пропускает воздух, о чем следует заявить преподавателю.
2.Получите навеску металла у преподавателя и запишите ее массу в г. В пробирку налейте соляной кислоты 3:1 (на одну пятую пробирки). Протрите внутренние стенки пробирки фильтровальной бумагой. Поддерживая пробирку в наклонном положении, поместите навеску металла (не опуская в кислоту) на стенку у отверстия пробирки и закройте пробирку пробкой с отводной трубкой от бюретки. 3.Приведите воду в бюретках к одному уровню и отметьте уровень воды в открытой бюретке до реакции V1. Наблюдение производить по нижнему мениску жидкости с точностью до 0,1. 4.Стряхните металл в кислоту (смойте его кислотой). Наблюдайте выделение водорода и вытеснение воды из бюретки. 5.По окончании реакции дайте пробирке охладиться на воздухе, после чего снова приведите воду в бюретках к одному уровню. Запишите новый уровень воды в бюретке V2.
Запишите в журнал: 1.навеску металла, г 2…...уровень воды в бюретке до реакции, мл 3.yровень воды в бюретке после реакции, мл 4.температура, К 5.атмосферное давление, кПа (мм рт. ст.) 6.давление насыщенного водяного пара, кПа (мм рт. ст.) 7.давление водорода, кПа (мм рт. ст.)
По полученным данным рассчитайте:
1.объем выделившегося водорода по разности уровней воды до и после реакции. Объем выделившегося водорода определяют по разности уровней воды в любой из бюреток до и после опыта при давлении в закрытой бюретке, равном атмосферному. Давление газа в закрытой бюретке равно атмосферному, если вода в обеих бюретках находится на одном уровне. Даже при комнатной температуре пар над поверхностью воды обладает заметным давлением. Это следует учитывать при вычислении объема газа, собранного над водой. 2. Парциальное давление водорода. Для определения парциального давления водорода необходимо от общего (атмосферного) давления, под которым находится водород, вычесть давление насыщенного водяного пара h.): РН = Ратм - h Таблица. Давление насыщенного пара.
3.Объем водорода при нормальных условиях, используя уравнение газового состояния
где: vо – объем выделившегося водорода при н.у., мл; Р0 – парциальное давление водорода при н.у., равное 101,3 кПа (760 мм рт. ст.); Т0 - температура, 273 K; V – объем выделившегося водорода при условиях опыта, мл; Р – парциальное давление водорода при данных условиях, Па (мм рт. ст.); Т – температура опыта, К. 4.Теоретическую молярную массу эквивалента Mg, Al, Zn; 5.Опытную молярную массу эквивалента данного Вам металла, используя закон эквивалентов; m г металла вытесняют - V0 мл водорода х г металла вытесняют - 11200 мл водорода
Сравните полученную в п.5 молярную массу эквивалента Вашего металла с молярной массой эквивалента предполагаемых металлов (Mg, Al, Zn). Для какого металла ближе Ваше значение? Определите, какой металл был взят для реакции. Результаты проверить у преподавателя.
6.Ошибки опыта: а) абсолютную Dе=Мэ(теор) - МЭ(опытн) б) относительную Запишите уравнение реакции взаимодействия Вашего металла с соляной кислотой.
ЛАБОРАТОРНАЯ РАБОТА № 3
ЭНЕРГИИ ГИББСА ПРОЦЕССОВ
Цель работы: выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикой химических реакций.
В любом процессе соблюдается закон сохранения энергии: теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии U и на совершение системой работы А над внешней средой (первый закон термодинамики): q=DU + A Если химическая реакция протекает в открытом сосуде при постоянной температуре (р, T=const) и единственным видом совершаемой работы является работа расширения (А=р DV), то тепловой эффект этой реакции равен изменению энтальпии системы: qP,T = DU +рDV = DH, где: H=U+pV При Н > 0 (когда теплота подводится к системе из окружающей среды и q < 0) реакцию называют эндотермической. При Н < 0 (когда теплота выделяется в окружающую среду и q > 0) реакцию называют экзотермической. Если в уравнении химической реакции указан ее тепловой эффект, уравнение называют термохимическим. Например, N2(г) + ЗН2(г) = 2NH3(г), DН°298 = - 92,4 кДж
При записи термохимческих уравнений указывают: а) агрегатные состояния или аллотропные модификации веществ; б) условия протекания процесса (DН°298 – стандартный тепловой эффект реакции при 298 К). Тепловой эффект химической реакции зависит от количества реагирующих и получающихся веществ. Так, например, при нейтрализации в водном растворе 0,1 моль NaOH избытком соляной кислоты выделяется 5,7 кДж теплоты, а при нейтрализации 10 моль NaOH – 570 кДж. Возможность и пределы самопроизвольного протекания реакции при p,T = const определяют с учетом энергии Гиббса G = H – TS, где Н – энтальпия, S – энтропия, Т – температура. Изменение энергии Гиббса в ходе химической реакции DG называют энергией Гиббса химической реакции. В тех случаях, когда DG < 0 реакция протекает самопроизвольно. Пределом самопроизвольного течения реакции является условие DG = 0. Величины DН, DS и DG вычисляют на основании следствий из закона Гесса. Изменение энтропии DS, энергии Гиббса химической реакции DG так же, как тепловой эффект реакции DН, зависят от количества веществ в системе.
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: изучение скорости химической реакции и ее зависимость от различных факторов (концентрации веществ, температуры).
Скорость химической реакции называют изменения концентрации реагирующих веществ в единицу времени. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, наличия катализатора и др.). Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна стехиометрическим коэффициентам. Например, для реакции: 2NO + O2 Þ 2NO2 Закон действия масс может быть записан:
где: Реакция в гетерогенной системе (например,) осуществляется на поверхности раздела между фаз. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации реагирующих веществ, но и от площади поверхности раздела. Так, для реакции: С(к) + О2(г) Þ СО2(г) закон действия масс имеет вид:
где: к – константа скорости; Зависимость скорости реакции от температуры выражается правилом Ван-Гоффа:
где: j - температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 100 С. Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующих в результате ее протекания. Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией молекул (активного комплекса) и средней энергии молекул исходных веществ. Скорость химической реакции при этом увеличивается.
Выполнение опыта 1.Налейте в три пробирки из бюретки по 5 мл серной кислоты. 2.В следующие три пробирки налейте из бюреток раствор тиосульфата натрия Na2S2O3 и воду следующим образом: в пробирку № 1 – 5 мл раствора Na2S2O3 + 10 мл воды; в пробирку № 2 – 10 мл раствора Na2S2O3+ 5 мл воды; в пробирку № 3 – 15 мл раствора Na2S2O3. 3.Заметив время, в пробирку № 1 прилейте 5 мл отмеренного раствора серной кислоты и быстро перемешайте полученную смесь. Отметьте время помутнения раствора. 4. Проделайте то же самое с пробирками № 2 и № 3. 5. Результаты опыта внесите в таблицу:
Таблица 1
Рассчитайте скорость реакции для второго и третьего случаев, учитывая, что скорость реакции и время протекания реакции до начала помутнения раствора обратно пропорциональны. Следовательно, где: На миллиметровой бумаге постройте кривую зависимости от концентрации Na2S2O3 (в относительных единицах). На этом же графике отметьте точками значения, полученные при вычислениях. Напишите уравнения реакции и сделайте вывод о зависимости скорости реакции от концентрации Na2S2O3 при данных условиях.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ Цель работы: изучение влияния различных факторов на химическое равновесие.
Понятие химическое равновесие применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции Для обратимой реакции: Н2(г) + I2(г) Û 2НI(г) константа равновесия имеет вид: Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе. Константа равновесия связана со стандартной энергией Гиббса данной реакции следующим соотношением: DG где: R – универсальная газовая постоянная (8,3 Дж/моль К); Т – абсолютная температура, К; Кс – константа равновесия. Химическое равновесие остается неизменным до тех пор, пока остаются постоянными параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в ту сторону той реакции, скорость которой при нарушении равновесия становится больше. В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
АДСОРБЦИОННОЕ РАВНОВЕСИЕ Цель работы: изучение зависимости величины адсорбции от равновесной концентрации адсорбата.
Процесс поглощения одного вещества поверхностью другого называется адсорбцией. Вещество, частицы которого поглощаются (газ, жидкость, растворенный компонент) называют адсорбатом, а поглотитель – адсорбентом. Взаимодействия между частицами адсорбата и адсорбента могут иметь различный характер. В зависимости от природы этого взаимодействия различают адсорбцию физическую и химическую (хемосорбцию). При физической адсорбции частицы адсорбата и адсорбента связываются относительно непрочными межмолекулярными силами взаимодействия (силы Ван-дер-Ваальса). Например, адсорбция кислорода металлами. Процесс отрыва адсорбата от поверхности адсорбента называется десорбцией. Если в системе «адсорбат – адсорбент» при заданных условиях скорость адсорбции равна скорости десорбции, то такое состояние называется адсорбционным равновесием. Количественно адсорбцию выражают в молях адсорбата на единицу поверхности адсорбента (моль/м2) или в молях на единицу массы адсорбента (моль/г). Величина адсорбции зависит от природы адсорбента и адсорбата, Т и концентрации (или давления) адсорбата. Кривую зависимости величины адсорбции Г от равновесных концентраций С или давлений р при постоянной температуре Т называется изотермой адсорбции: Г = f(С) или Г = f(р) при Т = const.
Опыт 1. Адсорбция уксусной кислоты активированным угл ем Адсорбцию (Г) уксусной кислоты рассчитывают как разность между исходной (Сисх) и равновесной (Ср) концентрациями уксусной кислоты: Г = Сисх – СР Концентрацию уксусной кислоты в растворах выражают в условных единицах – числом мл щелочи, пошедшей на титрование 10 мл раствора кислоты. В 3 колбы внесите по 1 г активированного угля и добавьте по 50 мл раствора уксусной кислоты различной концентрации (1, 2, 3). Периодически взбалтывайте содержимое колб. Для определения исходной концентрации раствора уксусной кислоты оттитруйте 10 мл раствора №1 с фенолфталеином раствором NaOH 0,1Н. Точно также оттитруйте растворы уксусной кислоты №2 и №3. Запишите объемы щелочи, пошедшей на каждое титрование. (Титрование каждого раствора уксусной кислоты необходимо провести 2 раза и взять среднее значение). Через 20 – 25 мин после начала адсорбции отфильтруйте растворы через бумажный фильтр в конические колбы и определите в фильтратах равновесные концентрации уксусной кислоты также титрованием NaOH. По результатам опыты рассчитайте адсорбцию уксусной кислоты для каждого раствора.
Полученные данные внесите в таблицу:
Постройте изотерму адсорбции уксусной кислоты активированным углем (на миллиметровой бумаге). ЛАБОРАТОРНАЯ РАБОТА № 8 Таблица №1. ГИДРОЛИЗ СОЛЕЙ Цель работы: изучение некоторых свойств водных растворов солей, связанных с реакцией гидролиза.
Гидролизом называют обменные химические реакции, протекающие с участием воды. Если в обменную реакцию с водой вступает соль, то взаимодействие называют гидролизом соли. Признаком гидролиза соли является изменение нейтральной реакции среды воды. Например, при растворении в воде хлорида аммония NH4C1 образуется избыток ионов Н+ и раствор подкисляется (рН < 7):
NH4C1 + Н20 Û NH4OH + HC1 или в ионном виде Если же растворить в воде ацетат натрия CH3COONa, раствор подщелачивается (рН > 7) вследствие образования избытка ионов ОН-:
CH3COONa + Н20 Û СН3СООН4 + NaOH или CH3COO- + Н20 Û СН3СООН + OH- Следовательно, водные растворы солей могут иметь кислую или щелочную реакцию среды потому, что они вступают в химическое взаимодействие с водой. При гидролизе некоторых солей рН воды не меняется. Однако не все соли вступают в реакцию гидролиза. Если растворить в воде хлорид калия, нейтральная реакция среды (рН = 7) характерная для чистой воды, не изменится, т.е. в растворе сохранится равенство
KCl + H2O Û KOH + HCl
Можно утверждать, что соли, образованные сильным основанием и сильной кислотой (KCl, LiNO3, NaCl и т.п.), в реакцию гидролиза не вступают. С водой взаимодействуют: 1) соли, образованные слабыми основаниями и сильными кислотами (NH4Cl, CuCl2, NH4NO3 и т.п.); 2) соли, образованные слабыми кислотами и сильными основаниями (Na2S, KCN, Na2CO3 и т.п.); 3) соли, образованные слабыми основаниями и слабыми кислотами (NH4CH3COO и т.п.). Из рассмотренных примеров следует, что в реакцию с водой вступают катионы слабых оснований и анионы слабых кислот. Если эти ионы многозарядные (Fe3+, Cu2+, CO32-, SiO32- и т.п.), их взаимодействие с водой обычно идет до образования основного кислого иона (первая ступень гидролиза), например:
Fe3+ + H2O Û FeOH2+ + H+ CO32- + H2O Û HCO3+ + OH-
О глубине протекания процесса гидролиза при заданных условиях можно судить по степени гидролиза соли b, являющейся отношением концентрации гидролизованных ионов (с) к их исходной концентрации (с0):
b =с/с0 Реакция гидролиза соли обратима. В прямом направлении (®) она протекает в сторону образования молекул (основных ионов) слабых оснований или молекул (кислых ионов) слабых кислот, а в обратном () в сторону образования молекул воды. Реакцию образования молекул воды из ионов Н+ и ОН- называют реакцией нейтрализации. Следовательно, реакция гидролиза соли обратна реакции нейтрализации. К реакции гидролиза соли применимы все положения и законы учения о химическом равновесии. Константа равновесия реакции гидролиза называется константой гидролиза соли Кг. Ее величина характеризует соотношение между равновесными концентрациями (активностями) всех компонентов системы. Связь между константой гидролиза соли (Кг) и степенью гидролиза (b) в растворе заданной концентрации (С0) выражается законом Оствальда:
если β«1, то Равновесие процесса гидролиза, отвечающее равенству скоростей реакции гидролиза и нейтрализации (
ПРИМЕР расчета величины константы гидролиза для соли
NH4C1 + Н20 Û NH4OH + HC1
Умножим числитель и знаменатель на сон-. Получим
или где: Кw = 10-14 – ионное произведение воды; К
ЛАБОРАТОРНАЯ РАБОТА № 11 Измерение ЭДС Гальванические элементы собирают из двух металлических электродов, помещенных в два отдельных стакана, соединенных электролитическим ключом, который представляет собой изогнутую стеклянную трубку, заполненную насыщенным раствором хлорида калия (рис. 1). Соберите гальванический элемент, для этого подготовьте две электродные схемы, состоящие из металлов, погруженных в растворы собственных солей. Конкретные металлы – Zn и Cu. Рисунок 1. Гальванический элемент с электролитическим ключом. 1. Электроды; 2.Сосуд; 3. Растворы электролита; 4.Электролитический ключ. Сосуды для растворов предварительно вымойте проточной водой под краном, ополосните дистиллированной водой, затем раствором соли соответствующего металла и залейте этот раствор на 2/3 объема сосуда. Металлические пластинки тщательно зачистите наждачной бумагой, промойте проточной водой под краном и погрузите в сосуды с раствором соли. Проследите, чтобы места спая металлической пластины с проводником не касались раствора. После этого подключаем гальванический элемент к высокоомному вольтметру и измеряем ЭДС. Это более простой, но менее точный метод измерения ЭДС, который заключается в прямом измерении напряжения на клеммах гальванического элемента с помощью вольтметра, имеющего высокое входное сопротивление. Вследствие высокого сопротивления мала сила тока, протекающего через элемент, поэтому невелика разница между ЭДС и напряжением элемента. Однако, даже малый ток в цепи приводит к потерям (І·R) и в результате измеряют не ЭДС, а напряжение гальванического элемента. В качестве высокоомного вольтметра в работе используется рН – метр.
1.Запишите уравнения электродных и токообразующей реакций. 2.По уравнению Нернста рассчитайте величины равновесных потенциалов электродов, использованных в элементе. Примите, что активность ионов равна концентрации. 3.Рассчитайте ЭДС и сравните ее с экспериментальным значением. Рассчитайте стандартную ЭДС элемента. 4.Используя измеренную величину ЭДС, определите энергию Гиббса токообразующей реакции и стандартную энергию Гиббса (см. Общая химия, Коровин Н.В. 2002г., стр.267). Определите стандартную энергию Гиббса по термодинамическим данным и сравните ее с расчетной.
Напряжение элемента. Измерение напряжения проводят на установке, состоящей из амперметра для прямого измерения тока в цепи, проходящего через измеряемый элемент, вольтметра для прямого измерения напряжения на клеммах элемента и сопротивления для регулирования тока в цепи (в отчете приведите схему установки). Соберите гальванический элемент и подключите его к установке для измерения напряжения. Постепенно повышайте плотность тока, записывая напряжение элемента. Снимите 3-4 показания в течение 15 минут. Результаты опыта сведите в таблицу:
Таблица 1 Зависимость напряжения гальванического элемента от плотности тока (или тока) в цепи.
По данным таблицы постройте кривую зависимости напряжения элемента от плотности тока (вольтамперную кривую). Объясните, почему напряжение элемента не равно ЭДС и уменьшается при повышении плотности тока.
Таблица 2 Зависимость потенциала электрода и ЭДС элемента от концентрации электролита.
По полученным данным постройте графики зависимости ЭДС и напряжения от концентрации (активности) ионов. Составьте схему элемента, уравнения электродных и токообразующей реакций. Объясните влияние концентрации ионов на ЭДС.
Контрольные вопросы и задачи. 1. Как устроен гальванический элемент? 2. Какое уравнение выражает связь между термодинамическими функциями реакции и ЭДС гальванических элементов? 3. Как устроен стандартный водородный электрод? 4. Какие факторы влияют на потенциал металлического электрода? 5. Какие факторы влияют на потенциал газовых электродов? 6. Как измерить ЭДС гальванического элемента? 7. От каких факторов зависит напряжение гальванического элемента? 8. Рассчитайте стандартную ЭДС гальванического элемента Pb | Pb2+ || Zn2+ | Zn по известным значениям стандартных потенциалов электродов. С учетом полученного значения стандартной ЭДС элемента определите стандартное значение энергии Гиббса, протекающей в элементе реакции. Определите энергию Гиббса из термодинамических данных и сравните обе величины. 9. Рассчитайте равновесный потенциал медного и серебряного электродов при Ag | Ag+ || Cu 2+ | Cu Ответ: 0,28; 0,68; 0,4 В. 10. Рассчитайте равновесные потенциалы двух медных электродов, у которых активности ионов меди Сu2+ соответственно равны 1,0 и 10-3 моль/л. Определите ЭДС следующих элементов: Cu| Cu 2+ || Cu 2+| Cu
Cu| Cu + || Cu +| Cu
Ответ: 0,34; 0,26; 0,09; 0,16 В. |

 ,
, , %
, % ,
, – скорость химической реакции; к – константа скорости;
– скорость химической реакции; к – константа скорости;  - концентрации реагирующих веществ.
- концентрации реагирующих веществ. ,
, - концентрация кислорода; S – площадь поверхности раздела между фазами.
- концентрация кислорода; S – площадь поверхности раздела между фазами.
 - скорости реакции при Т1 и Т2;
- скорости реакции при Т1 и Т2; ,
, - скорость реакции в первом случае (
- скорость реакции в первом случае ( );
);  - скорость реакции во втором, третьем случае;
- скорость реакции во втором, третьем случае;  - время протекания реакции до начала помутнения раствора в первом случае, С;
- время протекания реакции до начала помутнения раствора в первом случае, С;  - время протекания реакции до начала помутнения раствора во втором (третьем) случае, С.
- время протекания реакции до начала помутнения раствора во втором (третьем) случае, С.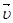 равна скорости обратной реакции
равна скорости обратной реакции 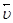 . Равенство
. Равенство 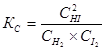
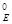 = - RTlnKC,
= - RTlnKC,
 :
:


 ,
,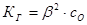

 ), подвижно и может быть смещено вправо (
), подвижно и может быть смещено вправо ( ) или влево (
) или влево ( ) в соответствии с принципом Ле Шателье. Так, например, при повышении температуры равновесие гидролиза смещается вправо, так как прямая реакция эндотермическая (DH > 0), а обратная (нейтрализация) – экзотермическая (DH < 0). При постоянной температуре Т равновесие гидролиза можно сместить вправо, уменьшая концентрацию раствора (разбавляя раствор); это следует из закона Оствальда: при КГ = constb тем больше, чем меньше с0.
) в соответствии с принципом Ле Шателье. Так, например, при повышении температуры равновесие гидролиза смещается вправо, так как прямая реакция эндотермическая (DH > 0), а обратная (нейтрализация) – экзотермическая (DH < 0). При постоянной температуре Т равновесие гидролиза можно сместить вправо, уменьшая концентрацию раствора (разбавляя раствор); это следует из закона Оствальда: при КГ = constb тем больше, чем меньше с0. ;
; ;
;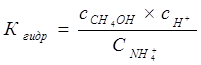 .
.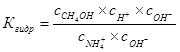 ;
; ;
;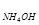 – константа диссоциации (в справочнике).
– константа диссоциации (в справочнике).

 и ЭДС элемента, составленного из этих электродов:
и ЭДС элемента, составленного из этих электродов:






