
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Зависимость скорости реакции от температурыСодержание книги
Поиск на нашем сайте
Зависимость скорости реакции от температуры изучают на примере реакции: Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S По правилу Ван-Гоффа (при j = 1,8)
Получаем, что при повышении температуры на 100С выше реакции увеличивается в 1,8 раза, на 200С – в 3,24 раза, на 300С – в 5,832 раза и т.д. В две пробирки налейте из бюретки по 5 мл серной кислоты. В следующие две пробирки налейте по 5 мл раствора тиосульфата натрия + 10 мл воды. По одной пробирке с серной кислотой и раствором тиосульфата Na2S2O3 поместите в термостат с температурой на 100С выше комнатной. Через 5-7 мин., когда растворы нагреются до нужной температуры, смешайте их и определите время помутнения раствора, как в опыте 1. Другую пару пробирок поместите в термостат с температурой на 20 0С выше комнатной. Через 5 – 7 минут смешайте растворы и определите время появления мути. Результаты опыта занесите в таблицу (экспериментальные данные для комнатной температуры возьмите из опыта № 1 пробирка № 1). Таблица 2
Рассчитайте скорость для второго и третьего случаев (методика расчета в опыте № 1). На миллиметровой бумаге постройте кривую зависимость от температуры. На этом же графике отметьте заранее рассчитанные значения. Рассчитайте значение температурного коэффициента, исходя из опытных данных. Сделайте вывод о зависимости скорости реакции от температуры. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Цель работы: изучение влияния различных факторов на химическое равновесие.
Понятие химическое равновесие применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции
Для обратимой реакции: Н2(г) + I2(г) Û 2НI(г) константа равновесия имеет вид: Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе. Константа равновесия связана со стандартной энергией Гиббса данной реакции следующим соотношением: DG где: R – универсальная газовая постоянная (8,3 Дж/моль К); Т – абсолютная температура, К; Кс – константа равновесия. Химическое равновесие остается неизменным до тех пор, пока остаются постоянными параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в ту сторону той реакции, скорость которой при нарушении равновесия становится больше. В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 361; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.147.19 (0.008 с.) |

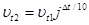
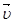 равна скорости обратной реакции
равна скорости обратной реакции 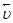 . Равенство
. Равенство 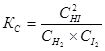
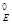 = - RTlnKC,
= - RTlnKC,


