
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В установку для измерения электропроводности поочередно вводят выше указанные реактивы и подключают установку К сети. Во всех случаях наблюдают за индикаторной лампой используемой установки.Содержание книги
Поиск на нашем сайте
Силу электролита определяют по яркости свечения лампы. Наблюдение заносят в таблицу:
Рассчитать α только для СН3СООН разных концентраций, считая что Построить на миллиметровой бумаге график зависимости степени диссоциации СН3СООН от ее концентрации. Сделать выводы о зависимости
Контрольные вопросы и задачи: 1.Какие вещества называют электролитами? 2.Почему электролиты называют проводниками электрического тока II рода? Какие вещества являются проводниками I рода? 3.Что называется степенью диссоциации электролита? Чему равна степень диссоциации сильного электролита? 4.Запишите уравнения электролитической диссоциации угольной кислоты и карбоната натрия. Объясните, в каком случае диссоциация протекает: а) обратимо; в) ступенчато. 5.Имеются сантимолярные растворы соляной и уксусной кислот. Объясните, в каком из них разница между значениями Сн+ и Ан+ более заметна. 6.Запишите три математические формулы, на основании которых можно: а) дать определение степени диссоциации электролита; б) вычислить степень диссоциации слабого электролита в растворе заданной концентрации; в) вычислить степень диссоциации слабого электролита, измерив электрическую проводимость его раствора. 7.Вычислите степень диссоциации гидроксида аммония и его деци-, санти- и милимолярных растворах, постройте график зависимости степени диссоциации NH4OH от концентрации раствора. Ответ: 0,0134; 0,0423; 0,1338. 8.Что называют разведением раствора? Сделайте необходимые расчеты и постройте кривую зависимости степени диссоциации азотистой кислоты от разведения. 9.Вычислите концентрацию ионов Н+ в 0,1м растворе СН3СООН и молярную электрическую проводимость этого раствора при 298К, если при этой температуре Ответ: 1,32·10-3 моль/л; 5,16 см2·Ом-1. 10.Почему при разбавлении раствора слабого электролита его удельная электрическая проводимость достигает максимума, а затем падает, а молярная – достигает максимума 11.Сопротивление ячейки, заполненной раствором KCl с удельной электрической проводимостью 5,79·10-3Ом-1·см-1 равно 103,6 Ом. Сопротивление той же ячейки, заполненной 0,01м раствором СН3СООН равно 5771 Ом. Определите молярную электрическую проводимость 0,01м раствора уксусной кислоты. Ответ: 10,39 см-2 Ом-1 моль-1.
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 292; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.91.59 (0.006 с.) |

 << 1.
<< 1.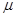
 = 390.7 см 2·Ом-1.
= 390.7 см 2·Ом-1.


