
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
IX/Растворы, как химическая система.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
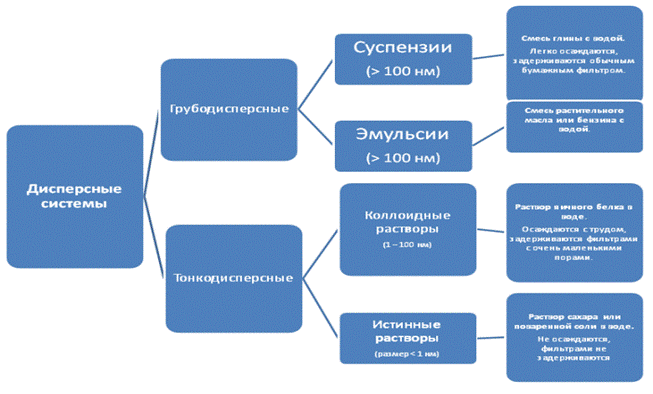
Раствор -твёрдая или жидкая гомогенная система, состоящая из двух или более компонентов. снову современной теории растворов создал Д.И. Менделеев. Он установил, что при растворении протекают одновременно два процесса: физический – равномерное распределение частиц растворяемого вещества по всему объему раствора, и химический – взаимодействие растворителя с растворяемым веществом. Последний процесс называют сольватацией (от лат. Solverе - растворять), а образующиеся соединения – сольватами. Применительно к водным растворам говорят о гидратации и гидратах. Диспе́рсная систе́ма — это система, образованная из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза. Дисперсионная среда- непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких твёрдых частиц, капелек жидкости или пузырьков газа. Д. с. может быть твёрдой, жидкой или газовой; в совокупности с дисперсной фазой она образует Дисперсные системы. Дисперсная фаза — совокупность мелких однородных твёрдых частиц, капелек жидкости или пузырьков газа, равномерно распределённых в окружающей (дисперсионной) среде. Д. ф. и дисперсионная среда образуют Дисперсные системы. Класификация: Коллоидный раствор - раствор, размер частиц которого составляет от 10-9 до 5х10-7 м (1-500 нм). В частности, отличается от истинного раствора (размер частиц менее 10-9 м) большей оптической активностью (как правило — непрозрачен). Выделяют коллоидные растворы газа в жидкости (пена), жидкости в жидкости (эмульсия), твердого тела в жидкости (суспензия) и др. Истинные растворы прозрачные. Отдельные частицы (молекулы, ионы) нельзя обнаружить даже при помощи ультрамикроскопа. Они не осаждаются и не задерживаются фильтрами. Класификация растворов: По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе. Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше. В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова. К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями. Концентрация — величина, характеризующая количественный состав раствора. концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин. Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах. Массовое процентное содержание компонента, m%. m%=(mi/Σmi)*100 Растворимость.- способность вещ-ва растворяться в том или ином растворителе. Мерой растворимости вещества служит его содержание в насыщенном растворе при данных условиях. Коэффициент растворимости вещества s -максимальная масса вещества, способная раствориться в 100 г воды при данной температуре с образованием насыщенного раствора. Растворимостью также называют молярную концентрацию вещества в его насыщенном растворе. Растворимость твердых вещест. По растворимости в воде твердые вещества делятся на хорошо растворимые, малорастворимые и практически нерастворимые. Примером хорошо растворимых веществ могут быть хлорид магния MgCl, карбонат натрия Na 2 CO 3 и нитрат серебра AgNO 3, растворимость которых (в граммах на 100 г воды с образованием насыщенного раствора) при обычной температуре составляет соответственно 20 г, 54 г и 215 г.
Вообще хорошо растворимыми называют такие вещества, растворимость которых при обычной температуре больше 10 г. малорастворимыми называют такие вещества, растворимость которых при обычной температуре менее 1 г, а практически нерастворимыми такие, растворимость которых меньше 0,01 г. Примером малорастворимых веществ могут служить сульфат кальция CaSO 4, растворимость которого составляет 0,21 г, и гидроксид кальция Ca (OH) 2,растворимость которого - 0,16 г. К практически нерастворимых веществ относятся сульфат бария BaSO 4, хлорид серебра AgCl, карбонат кальция CaCO 3, кварцевый песок SiO 2. Абсолютно нерастворимых веществ нет. С повышением температуры растворимость большинства твердых веществ увеличивается, причем для некоторых веществ очень резко, а для некоторых - совсем мало. Так, например, для хлорида натрия NaCl растворимость мало меняется с изменением температуры и составляет при обычной температуре 36 г (на 100 г воды), а при 100 С - 39 г. Для калийной селитры KNO 3, напротив, растворимость очень резко меняется с изменением температуры и составляет при обычной температуре 31,5 г, а при 100 С - 245 г. Поэтому когда речь идет о растворимости (коэффициент растворимости) вещества, то всегда следует указывать и температуру, потому растворимость одного и того же вещества при различных температурах различна. Зависимость растворимости твердых веществ от температуры для наглядности часто изображают графически кривыми растворимости. На оси абсцисс откладывают в определенном масштабе температуру, а на оси ординат - растворимость. Кривые растворимости дают возможность быстро находить растворимость вещества при любой температуре. Перенасыщенные растворы- раствор, в котором при заданной температуре и давлении концентрация растворенного вещества больше, чем в насыщенном растворе. Неустойчивая однофазовая система: внесение кристалла растворенного вещества или встряхивание вызывает кристаллизацию. Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Поместив в 100 г воды при 200C меньше 36 г NaCl мы получим ненасыщенный раствор. При нагревании смеси соли с водой до 1000C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 200C, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние. Ненасыщенный раствор - раствор, содержащий меньше вещества, чем в насыщенном. Электроли́т — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей иоснований . Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью. Неэлектролит ы- это вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся: кислород, водород, многие органические вещества (сахара, эфиры, бензол и др.). В молекулах этих веществ существуют ковалентные не полярные или малополярные связи.Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду ссольватирующей
Основные положения ТЭД Механизм растворения: Растворение часто сопровождается выделением или поглощением теплоты, а также увеличением или уменьшением объема раствора. Растворение некоторых веществ сопровождается выделением (концентрированные кислоты, щелочи) или поглощением тепла (растворение некоторых солей, хлорид натрия или калия). Все это указывает на то, что процесс растворения является сложным физико-химическим процессом. Диссоциация веществ с иным типом связи: В основе строения ионных соединений находится ионная кристаллическая решетка. Разрушение кристаллов происходит под воздействием полярных молекул воды(рисунок ниже). Особенностью диссоциации ионных соединений является то, что в этих веществах имеются уже готовые ионы и диполям воды остается только разрушить ионный кристалл. К электролитам с ионным типом связи относятся основания и соли. Основания диссоциируют в водных растворах на гидроксид-ионы и ионы металла. Диссоциация веществ с кавалентвной полярной связью: Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Степень диссоциации — величина, характеризующая состояние равновесия в реакциидиссоциации в гомогенных (однородных) системах. "Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
числа распавшихся на ионымолекул к общему числу растворенных молекул. Степень диссоциации Помимо константы диссоциации, мерой силы электролита может служить степень диссоциации α. Это отношение числа распавшихся на ионы молекул (n1) к общему числу молекул (n0), изначально попавших в раствор:
Если речь идет не о молекулярных, а ионных соединениях, то понятие «молекула» следует заменить понятием «формульная единица» (например, NaCl). Допустим, в опыте установлено, что при растворении в воде уксусной кислоты CH3COOH только одна из каждых 100 молекул распадается на ионы Н+ и CH3COO–.
Это означает, что степень диссоциации уксусной кислоты в растворе составляет примерно 1/100 или 0,01. Можно α выразить и в процентах (1%). На основании степеней диссоциации удобно разделять все электролиты на сильные и слабые: сильные электролиты – α близка к 1 (или 100%), Такое деление условно, но оно очень удобно для написания ионных уравнений химических реакций: достаточно принять за правило, что только сильные электролиты можно записывать в ионном виде, а слабые – нет. Диссоциация кислот, оснований и солей в водных растворах: Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водородаН3РО4
Равновесия в растворах электролитов: произведение растворимости. В растворах твердых электролитов (чаще всего это основания и соли) имеет место равновесие на границе двух фаз, например: AgCl(тв) = Ag+ + Cl–. Оба процесса – прямой и обратный – происходят очень быстро: достаточно в раствор с осадком AgCl добавить иодид калия и перемешать смесь, как почти сразу же весь белый хлорид серебра переходит в желтый иодид AgI; если же в раствор добавить бесцветный сульфид натрия, немедленно образуется черный сульфид серебра Ag2S. Для подобных процессов тоже можно записать выражение константы равновесия. Эта константа носит название произведения растворимости (ПР). В общем виде для равновесия A x B y (тв) Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается В общей реакции
где комплекс
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно. Закон разбавления Оствальда устанавливает зависимость между степенью диссоциации и константой диссоциации. Установим эту зависимость для диссоциации одно-одновалентного электролита, например уксусной кислоты. Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим Это соотношение называют законом разбавления Ошибка! Недопустимый объект гиперссылки.. Для очень слабых электролитов при α << 1 это уравнение упрощается:
Тогда
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице. Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда (6.1) можно записать в виде
Решая его относительно α, получим
Вода - чрезвычайно слабый электролит (H2O H2O ↔ H+ + OH- Ио́нное произведе́ние воды́ — произведение концентрацийионовводорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды. KB = [Н+] [ОН—] Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ, «пи эйч») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионовводорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифмактивности водородных ионов, выраженной в молях на литр: В зависимости от уровня рН воды можно условно разделить на несколько групп:
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена. В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода). В таких случаях реакции будут практически не обратимы.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 840; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.55.138 (0.014 с.) |

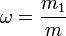 ,где:m1 — масса растворённого вещества, г;m — общая масса раствора, г.
,где:m1 — масса растворённого вещества, г;m — общая масса раствора, г.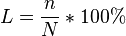
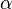 равна отношению числа диссоциированных молекул
равна отношению числа диссоциированных молекул 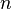 к сумме
к сумме  , где
, где 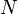 — число недиссоциированных молекул. Часто
— число недиссоциированных молекул. Часто 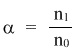
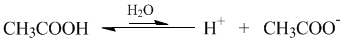
 Н+ + Н2РО-4(первая ступень)Н2РО-4
Н+ + Н2РО-4(первая ступень)Н2РО-4  x A y + + y B x + ПР = [A] x [B] y. Таким образом, произведение концентраций ионов в насыщенном растворе, возведенных в соответствующие степени, представляет собой величину постоянную при данной температуре. По величине ПР ряда однотипных соединений (индексы x и y у них одинаковые) можно судить об их относительной растворимости: чем меньше ПР, тем меньше растворимость.
x A y + + y B x + ПР = [A] x [B] y. Таким образом, произведение концентраций ионов в насыщенном растворе, возведенных в соответствующие степени, представляет собой величину постоянную при данной температуре. По величине ПР ряда однотипных соединений (индексы x и y у них одинаковые) можно судить об их относительной растворимости: чем меньше ПР, тем меньше растворимость.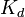 и обратнаконстанте ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
и обратнаконстанте ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.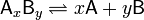
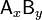 разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
разбивается на x единиц A и y единиц B, константа диссоциации определяется так: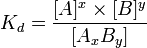
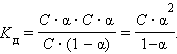
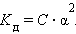
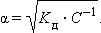
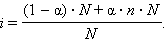
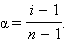
 Н+ + ОН−), электропроводность чистой (дистиллированной) воды весьма мала, поэтому электролиз воды проводят в присутствии сильных электролитов. Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):
Н+ + ОН−), электропроводность чистой (дистиллированной) воды весьма мала, поэтому электролиз воды проводят в присутствии сильных электролитов. Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):


