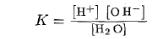Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модуль 2. Химическая термодинамика и кинетика. Химическое равновесиеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте К важнейшим величинам, характеризующим химические системы, относятся внутренняя энергия U, энтальпия Н, энтропия S и энергия Гиббса (изобарно-изотермический потенциал) G. Все эти величины представляют собой функции состояния, т. е. зависят только от состояния системы, но не от способа, которым это состояние достигнуто. Протекание химической реакции сопровождается изменением внутренней энергии реагирующих систем. Если внутренняя энергия системы уменьшается (ΔU < 0), то реакция протекает с выделением энергии (экзотермические реакции). Если же внутренняя энергия системы возрастает (ΔU > 0), то процесс сопровождается поглощением энергии из внешней среды (эндотермические реакции)/ Если в результате протекания химической реакции система поглотила количество теплоты Q и совершила работу А, то изменение внутренней энергии ΔU определяется уравнением: ΔU = Q-A. Согласно закону сохранения энергии, Δ U зависит только от начального и конечного состояний системы, но не зависит от способа осуществления процесса (реакции). Напротив, Q и А при разных способах осуществления процесса будут различаться: функцией состояния является только разность этих величин, но не каждая из них в отдельности. Функции U, Q и А обычно выражают в джоулях или в килоджоулях. Если реакция протекает при постоянном объеме (ΔV = 0, изохорный процесс), то работа расширения системы (А = PΔV) равна нулю. Если при этом не совершаются и другие виды работы (например, электрическая), то ΔU = Qv, где Qv — тепловой эффект реакции (т. е. количество поглощенной системой теплоты), протекающей при постоянном объеме. В случае экзотермической реакции Qv < 0, для эндотермической реакции Qv > 0. Химические реакции чаще осуществляются не при постоянном объеме, а при постоянном давлении Р (ΔР = 0, изобарный процесс). В подобных случаях для характеристики процесса удобнее пользоваться не внутренней энергией U, а энтальпией Н, которая определяется соотношением: Н = U + PΔV. Как видно, энтальпия имеет ту же размерность, что и внутренняя энергия, и поэтому обычно выражается в джоулях или килоджоулях. При постоянстве давления ΔH = ΔU + PΔV, т. е. изменение энтальпии равно сумме изменения внутренней энергии (ΔU) и совершенной системой работы расширения (PΔV). Если при этом никакие другие виды работы не совершаются, то ΔН = Qp, где Qp — тепловой эффект реакции, протекающей при постоянном давлении. Для экзотермической реакции Qp < 0, для эндотермической Qp > 0. Изменение внутренней энергии или энтальпии принято относить к тому случаю, когда все исходные вещества и все продукты реакции находятся в стандартных состояниях. Стандартным состоянием вещества при данной температуре называется его состояние в виде чистого вещества при давлении (в случае газов — при парциальном давлении данного газа), равном нормальному атмосферному давлению (101,325 кПа, или 760 мм рт. ст.). Условия, при которых все участвующие в реакции вещества находятся в стандартных состояниях, называются стандартными условиями протекания реакции. Отнесенные к стандартным условиям изменения соответствующих величин называются стандартными изменениями и их обозначения снабжаются верхним индексом °: ΔU° — стандартное изменение внутренней энергии при химической реакции, ΔН0 — стандартное изменение энтальпии при химической реакции (или, короче, стандартная энтальпия реакции). Стандартная энтальпия реакции образования 1 моля данного вещества из простых веществ называется стандартной энтальпией образования этого вещества. Эту величину обычно выражают в килоджоулях на моль. Энтальпия и внутренняя энергия образования простых веществ, согласно приведенному определению, равны нулю. Если элемент образует несколько простых веществ (графит и алмаз, белый и красный фосфор и т. п.), то стандартным считается состояние элемента в виде наиболее устойчивой при данных условиях модификации; энтальпия и внутренняя энергия образования этой, наиболее устойчивой модификации принимаются равными нулю. Химические уравнения, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями. Например, уравнение Рb О (к.) + С О (г.) = Рb (к.) + С 0 2 (г.), ΔH° = - 6 4 кДж означает, что при восстановлении 1 моля РЬО оксидом углерода(II) выделяется количество теплоты, равное 64 кДж. Сокращения «к.», «ж.» и «г.» указывают соответственно на кристаллическое, жидкое или газообразное состояние вещества. Следствием закона сохранения энергии является положение, экспериментально установленное в 1840 г. Г. И. Гессом (закон Геcса) и лежащее в основе термохимических расчетов: Тепловой эффект химической реакции (т. е. изменение энтальпии или внутренней энергии системы в результате реакции) зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса. Из закона Гесса следует, в частности, что термохимические уравнения можно складывать, вычитать и умножать на численные множители. Cледствие закона Гесса, применение которого упрощает многие термохимические расчеты: Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ. При каждом суммировании следует учитывать, в соответствии с уравнением реакции, число молей участвующих в реакции веществ. Пример 1. Пользуясь справочными данными приложения, вычислить ΔН° реакции: 2 Mg (к.) + С 02 (г.) = 2 Mg О (к.) + С (графит). Р е ш е н и е. По данным табл. стандартные энтальпии образования СО2 и MgO равны соответственно —393,5 и —601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Отсюда для стандартной энтальпии реакции находим: ΔН° = 2 ΔН (MgO) – ΔH(CO2) = -601,8 • 2 + 393,5 = -810,1 кДж.
Направление, в котором самопроизвольно протекает химическая реакция, определяется совместным действием двух факторов: 1) тенденцией к переходу системы в состояние с наименьшей внутренней энергией (в случае изобарных процессов — с наименьшей энтальпией) и 2) тенденцией к достижению наиболее вероятного состояния, т. е. состояния, которое может быть реализовано наибольшим числом равновероятных способов (микросостояний). Мерой первой из этих тенденций для изобарных процессов служит изменение энтальпии в химической реакции: отрицательный знак ΔH0 указывает на уменьшение, а положительный — на возрастание энтальпии системы. Мерой вероятности состояния системы в термодинамике принято считать энтропию S — величину, пропорциональную логарифму числа равновероятных микросостояний, которыми может быть реализовано данное макросостояние. Энтропия имеет размерность энергии, деленной на температуру; обычно ее относят к 1 молю вещества (мольная энтропия) и выражают в Дж/(моль-К). Из изложенного ясно, что энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии.
Пример 2 Не производя вычислений, определить знак изменения энтропии в рекциях
Функцией состояния, одновременно отражающей влияние обеих упомянутых выше тенденций на направление протекания химических процессов, служит энергия Гиббса, связанная с энтальпией и энтропией соотношением G = H-TS, где Т — абсолютная температура. Как видно, энергия Гиббса имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в джоулях или килоджоулях. Для изобарно-изотермических процессов (т. е. процессов, протекающих при постоянных температуре и давлении) изменение энергии Гиббса равно: ΔG = ΔН -TΔS. Как и в случае ΔН и ΔS, изменение энергии Гиббса ΔG в результате химической реакции (или, короче, энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ; суммирование производят с учетом числа молей участвующих в реакции веществ. Энергию Гиббса образования относят к 1 молю вещества и обычно выражают в кДж/моль; при этом ΔG0 образования наиболее устойчивой модификации простого вещества принимают равной нулю. При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (ΔG < 0). В таблице показана возможность' (или невозможность) самопроизвольного протекания реакции при разных сочетаниях знаков ΔН
Так, если для какой-либо реакции ΔН < 0 (экзотермическая реакция), a ΔS > 0, то из последнего уравнения следует, что при всех температурах ΔG < 0; это значит, что реакция может самопроизвольно протекать при любых температурах. Если Δ Н < 0 и ΔS < 0, то реакция возможна при условии, что член ΔН в уравнении для энергии Гиббса больше по абсолютному значению, чем член TΔS; поскольку абсолютное значение члена TΔS с ростом множителя Т увеличивается, то указанное условие будет осуществляться при достаточно низких температурах. Иначе говоря, при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается.
Пример 3 Определить знаки ΔН, ΔS, ΔG для реакции АВ(к.) + В2 (г.) = А В3 (к.), протекающей при температуре 298 К в прямом направлении. Как будет изменяться значение ΔG с ростом температуры? Р е ш е н и е. Самопроизвольное протекание реакции указывает на то, что для нее ΔG < 0. В результате реакции общее число частиц в системе уменьшается, причем расходуется газ В2, а образуется кристаллическое вещество АВз; это означает, что система переходит в состояние с более высокой упорядоченностью, т. е. для рассматриваемой реакции ΔS < 0. Таким образом, в уравнении ΔG = ΔН — TΔS величина ΔG отрицательна, а второй член правой части уравнения (—TΔS) положителен. Это возможно только в том случае, если ΔН. < 0. С ростом температуры положительное значение члена — TΔS в уравнении возрастает, так что величина ΔG будет становиться менее отрицательной.
Пример 4. Пользуясь справочными данными, установить, возможно ли при температурах 298 и 2500 К восстановление диоксида титана до свободного металла по схеме:
Скорость химической реакции измеряется количеством вещества вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции) В случае гомогенного процесса, протекающего при постоянном объеме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени. Это определение можно выразить уравнением v — ±ΔC/Δt, где знак «плюс» относится к изменению концентрации вещества, образующегося в результате реакции (ΔС > 0), а знак «минус» — к изменению концентрации вещества, вступающего в реакцию (ΔС < 0). Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется з а к о н ом д е й с т в и я масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Так, для реакции типа А + В2 —> АВ2 закон действия масс выражается следующим образом: v = k[A] [B2]. В этом уравнении [А] и [В2] — концентрации вступающих в реакцию веществ, а коэффициент пропорциональности к — константа скорости реакции, значение которой зависит от природы реагирующих веществ. Гораздо реже реакция осуществляется путем столкновения трех реагирующих частиц. Например, реакция типа А + 2В —АВ2 может протекать по механизму тройных столкновений: А + В + В + АВ2. В этом случае, в соответствии с законом действия масс, можно записать v = k[A] [В] [В], т. е. v = k [А] [В]2. При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс. Пример 5. Написать выражения закона действия масс для реакций а) 2 N О (г.) + С12 (г.)= 2 N О С1 (г.); б) С а С О3 (к.) =С а О (к.) + С 0 2 (г.) Р е ш е н и е, a) v = k[NO]2 [Cl2]. б) Поскольку карбонат кальция — твердое вещество, концентрация которого yе изменяется в ходе реакции, искомое выражение будет иметь вид: v — k, т. е. в lанном случае скорость реакции при определенной температуре постоянна. Пример 6. Как изменится скорость реакции 2 N О (г.) + O2 (г.) = 2 N 0 2 (г.), если уменьшить объем реакционного сосуда в 3 раза? Р е ш е н и е. До изменения объема скорость реакции выражалась уравнением: v = k[NO]2[02]. Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в три раза. Следовательно, теперь v' = k (3 [N О])2 (3 [02]) = 27k [N О]2 [О2]. Сравнивая выражения для v и v', находим, что скорость реакции возрастет в 27 раз.
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Пример 7. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 75° С? Р е ш е н и е. Поскольку Δt = 55°C, то, обозначив скорость реакции при 20 и 75° С соответственно через v и v', можем записать:
Отсюда v'/v = 287. Скорость реакции увеличится в.287 раз.
Как показывает последний пример, скорость химической реакции очень сильно возрастает при повышении температуры. Это связано с тем, что элементарный акт химической реакции протекает не при всяком столкновении реагирующих молекул: реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым создать возможность образования новых молекул. Поэтому каждая реакция характеризуется определенным энергетическим барьером; для его преодоления необходима энергия активации — некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции. Зависимость константы скорости реакции k от энергии активации (Еa, Дж/моль) выражается у р а в н е н и е м Аррениуса:
Здесь Z — число столкновений молекул в секунду в единице объема;е — основание натуральных логарифмов (е = 2,718...); R — универсальная газовая постоянная (8,314 Дж-моль- 1 ·К- 1); Т — температура, К; Р — так называемый стерический множитель. Скорость химической реакции возрастает в присутствии катализатора. действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции понижается и активными становятся некоторые молекулы, энергия которых была недостаточна для осуществления реакции в отсутствие Катализатора. В результате общее число активных молекул возрастает и скорость реакции увеличивается.
При протекании химической реакции концентрации исходных веществ уменьшаются; в соответствии с законом действия масс это приводит к уменьшению скорости реакции. Если реакция обратима, т. е. может протекать как в прямом, так и в обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. В случае обратимой химической реакции A + B =C + D зависимость скоростей прямой реакций от концентраций реагирующих веществ выражается соотношениями: vпрям = kпрям [А] [В]; vобр = kобр [С] [D]. В состоянии химического равновесия vпрям = vобр т. е. kпрям [А] [В]= kобр [С] [D]. K=[А] [В]/ [С] [D]. Здесь К — константа равновесия реакции. Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Константа равновесия — постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше константа равновесия, тем «глубже» протекает реакция, т. е. тем больше выход ее продуктов. В химической термодинамике доказывается, что для общего случая химической реакции
Катализатор не влияет на значение константы равновесия, поскольку он одинаково снижает энергию активации прямой и обратной реакций и поэтому одинаково изменяет скорости прямой и обратной реакций. Катализатор лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
Пример 8. В системе А (г.) + 2В(г.) = С (г.) равновесные концентрации равны: [А] = 0,0.6 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Ш а т е л ь е: Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено. Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т. е. охлаждением системы; повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т. е. в направлении, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу/
Пример 9. В каком направлении сместится равновесие в системах а) С О (г.) + С12 (r.) =C O Cl2 (г.), б) Н 2 (г.) + Cl2 (г.)= 2 Н Cl (г.), еcли при неизменной температуре увеличить давление путем уменьшения объема газвовой смеси? Р е ш е н и е, а) Протекание реакции в прямом направлении приводит к уменьшениюобщего числа молей газов, т. е. к уменьшению давления в системе. согласно принципу Ле Шателье, повышение давления вызывает смещение равновесия в сторону прямой реакции. б) Протекание реакции не сопровождается изменением числа молей газов и не приводит, следовательно, к изменению давления. В этом случае изменение давления не вызывает смещения равновесия.
Задачи 61. Вычислите энтальпию образования NO(г), исходя из следующих термохимических уравнений: 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж); Δ H 0 = –1168,80 кДж; 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); Δ H 0 = –1530,28 кДж. 62. Рассчитайте ΔG0 реакций: а) CO(г) + ½ O2(г) = CO2(г); б) ½ N2(г) + 3/2 H2(г) = NH3(г); в) C6H6(ж) + NH3(г) = H2(г) + C6H5NH2(ж). 63. При какой температуре наступит равновесие системы: 4НС1(г) + О2(г) = 2Н2О(г) + 2С12(г); ΔH0 = -114,42 кДж? 64. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция: Н2(г) + СО2(г) = СО(г) + Н2О(ж); AH0 = -2,85 кДж? На основании стандартных значений ΔH0 и ΔS0 соответствующих веществ определите ΔG0 этой реакции. 65. Вычислить ΔH0 2 9 8 реакций:. а) С2 Н6 (г.) + 7/2 O 2 (г.) = 2 С O 2 (г.) + 3 Н2 О (г.); б) С6 Н6 (ж.) + 15/2 O 2 (г.) = 6 С O 2 (г.) + ЗН2 О (ж.). 66. Пользуясь справочными данными, показать, что в стандартных условиях при 25°С реакция Сu (к.) + Zn О (к.) = Сu О (к.) + Zn (к.) невозможна. 67. Не производя вычислений, указать, для каких из перечисленных процессов изменение энтропии положительно: а) Mg О (к.) + Н2 (г.) = Mg (к.) + Н2 О (ж.); б) С (графит) + С O 2 (г.) = 2 С О (г.); в) С Н3 С О О Н (водн.) = С Н3 С О O- (водн.) + Н+ (водн.); г) 4Н С1 (г.) + O 2 (г.) = 2 С12 (г.) + 2 Н2 О (г.); д) N H 4N03 (к.) = N2 О (г.) + 2Н2 О (г.). 68. В каком из следующих случаев реакция возможна при любых температурах: а) ΔН < 0, ΔS > 0; б) ΔН < 0, ΔS < 0; в) ΔН > 0, ΔS > 0? 69. В каком из следующих случаев реакция неосуществима при любых температурах: а) ΔН > 0, ΔS > 0; б) ΔН > 0, ΔS < 0; 70. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: CaO, FeO, CuO, PbO, Fe203, Cr203? 71. Найти значение константы скорости реакции А + В —> АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5 • 10-5 моль/(л-мин). 72.. Во сколько раз следует увеличить концентрацию вещества, В2 в системе 2А2 (г.) + В2 (г.) = 2А2В(г.), чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась? 73. В системе С О + С12 = СО С12 концентрацию увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора — от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции? 74. Как изменится скорость реакции 2NO(r.) + 0 2 (г.) —>2N02 (r.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию NO в 3 раза? 75. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза? 76. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько, раз увеличится скорость этой реакции, если повысить температуру на 25 градусов? 77. При 150°С некоторая реакция заканчивается за 16 мин.принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 200°С; б) при 80°С. 78. Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции С 0 2 (г.) + С (графит) =2 С О (г.). 79 Как повлияет на равновесие следующих реакций 2Н2 (г.) + О 2 (г) = 2 Н2 О (г.), ΔН0 = -483,6 кДж; Са С О 3 (к.) = Са О (к.) + С О 2 (г.), ΔН0 = 179 кДж а) повышение давления; б) повышение температуры? 80. Какие из перечисленных воздействий приведут к изменению значения константы равновесия химических реакций: а) изменение давления; б) изменение температуры; в) замена катализатора; г) изменение концентраций реагирующих веществ?
МОДУЛЬ 3. Водные растворы Содержание растворенного вещества в растворе может быть Выражено либо безразмерными единицами — долями или процентами, либо величинами размерными — концентрациями. Ниже приведены наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе: 1. Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента cодержится в 100 г раствора. 2. Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации ‑ кг/м3, г/л. 3. Титр Т – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см3. 4. Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения - моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5 М. 5. Молярная концентрация эквивалентов сэк (нормальная концентрацияСн) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, сэк(KOH) = 1 моль/л, сэк(1/2H2SO4) = 1 моль/л, сэк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1моль вещества эквивалентов, называют нормальным и обозначают 1н. 6. Моляльность m - это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности моль/кг. Например, m(HCl/H2O) = 2 моль/кг.
7. Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1). Пример 1. Найти моляльность, нормальность и молярность 15%-ного (по массе) раствора H2SO4 (р = 1,10 г/мл).
Все вещества можно разделить на электролиты – вещества, проводящие электрический ток в водном растворе или расплаве и неэлектролиты – не проводящие электрический ток. Электролиты можно условно разделить на сильные и слабые. К классу сильных электролитов относятся кислоты – соляная НCl, азотная HNO3, серная H2SO4, хлорная HClO4 и др., гидроксиды щелочных и щелочноземельных металлов (Ca, Sr, Ba), а также большинство солей. К слабым электролитам относятся органические кислоты – муравьиная HCOOH, уксусная CH3COOH, щавелевая H2C2O4, сероводородная H2S, угольная H2CO3, циановодородная HCN, азотистая HNO2, большинство оснований, в т.ч. NH4OH, вода, малорастворимые соли. Молекулы всех электролитов подвергаются диссоциации – распаду на ионы, которые и являются проводниками электричества. Кислоты, основания и соли в водном растворе распадаются на положительные (катионы) и отрицательно заряженные ионы (анионы). Кислоты в водных растворах диссоциируют на ионы водорода и кислотные остатки. Многоосновные кислоты диссоциируют ступенчато:
Все основания диссоциируют с образованием гидроксид-ионов и катионов. Многокислотные основания подвергаются многоступенчатой диссоциации:
Гидроксиды металлов, которые в водных растворах могут диссоциировать по кислотному и по основному типу, называются амфолитами (амфотерными гидроксидами). Это Be(OH)2, Zn(OH)2, Al(OH)3, Ga(OH)3 и др. Схема диссоциации с учетом гидратации запишется так:
Соли при диссоциации образуют катионы и кислотные остатки:
В растворах слабых электролитов можно говорить о равновесии между ионами и реально существующими недиссоциированными молекулами. Отношение числа молекул, распавшихся на ионы, к общему числу молекул электролита называется степенью диссоциации. Допустим имеем слабую кислоту: НА⇄Н++А- Применив к равновесному процессу закон действия масс, можно получить константу равновесия, здесь она называется константой дисооциации слабого электролита:
Обозначим общую концентрацию слабой кислоты НА через С моль/л, тогда концентрация ионов Н+ и А- будет:
а концентрация недиссоциированных молекул:
Подставляя в выражение константы равновесия эти величины, получим:
Если
Приведенные выражения представляют собой закон разбавления Оствальда. Из него видно, что если концентрацию слабого электролита увеличить в 100 раз, то степень диссоциации уменьшится в Установившееся равновесие в растворе слабого электролита НА можно нарушить. Так, если увеличить концентрацию ионов Н+ в растворе слабого электролита, прибавив кислоты, то это вызовет смещение равновесия влево. При этом увеличится концентрация молекул слабого электролита НА, т.е. степень диссоциации уменьшится. Аналогичного эффекта можно добиться, добавив к раствору растворенную соль кислоты НА, содержащую ион А. Поскольку электролиты в водных растворах диссоциированы на ионы, то реакции в таких системах проходят между ионами. Скорость таких реакций является довольно высокой. Ионные реакции в большинстве случаев практически необратимы и проходят до конца слева направо, если продуктами их являются труднорастворимые вещества (осадки), легко летучие газы, либо вещества слабодиссоциирующие (слабые электролиты, комплексные соединения). Если в растворе электролита АХ степень его диссоциации равна а, то концентрации ионов А+ и Х- в растворе одинаковы и составляют: [А+] = [Х-] = аСм.
Пример2. Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,32 • 10-2. Найти константу диссоциации кислоты и значение рК.
Вода, будучи очень слабым электролитом, в незначительной степени диссоциирует, образуя ионы водорода и гидроксид-ионы Н 2 О = Н + + ОН-. Этому процессу соответствует константа диссоциации
Поскольку степень диссоциации воды очень мала, то равновесная концентрация недиссоциированных молекул воды [Н2 О] с достаточной точностью равна общей концентрации воды, т. е. 1000/18 = 55,55 моль/л. В разбавленных водных растворах концентрация воды мало изменяется, так что ее можно считать постоянной величиной. Тогда выражение для константы диссоциации воды можно преобразовать следующим образом:
Константа Кн2о, равная произведению концентраций ионов Н+ и ОН-, представляет собой постоянную при данной температуре величину и называется ионным произведением воды
При растворении некоторых солей в воде нарушается равновесие диссоциации воды. Это является результатом обменных реакций растворенного вещества с растворителем, приводящих к образованию труднорастворимых, газообразных и малодиссоциирующих соединений. Такое обменное взаимодействие растворенного вещества с водой называется гидролизом. В зависимости от природы растворенного вещества, его гидролиз может происходить по-разному. Так если соль образована сильной кислотой и основанием равной силы, то она полностью распадается в воде на свои составные части, а ее катионы и анионы, сталкиваясь с ионами Н+ и ОН-, практически ими не связываются. Происходит это по тому, что получающиеся в результате такого столкновения сильные кислота и основание, вновь моментально распадаются на ионы. Поэтому равновесие электролитической диссоциации воды не смещается, концентрация ионов водорода и гидроксида остается постоянной, равной 10-7моль/литр. Гидролизу подвергаются все остальные соли: · образованные катионом сольного основания и анионом слабой кислоты – происходит гидролиз по аниону; · образованные катионом слабого основания и анионом сильной кислоты – происходит гидролиз по катиону; · образованные катионом слабого основания и анионом слабой кислоты – происходит гидролиз и по катиону и по аниону. Процесс гидролиза количественно характеризуется степенью гидролиза (h) и константой гидролиза (Кг). Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу (Сгидр.), к общему числу растворенных молекул (Собщ.):
Степень гидролиза зависит от следующих факторов: 1. природы соли; 2. ее концентрации; 3. температуры раствора. Разбавление раствора равноценно увеличению концентрации одного из реагирущих веществ (воды) и приводит к усилению гидролиза. Гидролиз концентрированных растворов происходит слабее. Процесс гидролиза эндотермичен, по этому с повышением температуры протекает полнее. Следовательно при гидр
|
||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 1855; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.016 с.) |








 В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.

 ⇄
⇄  I-я ступень диссоциации
I-я ступень диссоциации ⇄
⇄  II-я ступень диссоциации
II-я ступень диссоциации ⇄
⇄ 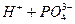 III-я ступень диссоциации
III-я ступень диссоциации ⇄
⇄  I-я ступень диссоциации
I-я ступень диссоциации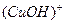 ⇄
⇄  II-я ступень диссоциации
II-я ступень диссоциации ⇄
⇄  ⇄
⇄ 
 ⇄
⇄ 
 ⇄
⇄ 
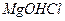 ⇄
⇄ 

 моль/л,
моль/л, моль/л
моль/л
 то можно принять
то можно принять  . Тогда
. Тогда , откуда
, откуда
 т.е. в 10 раз.
т.е. в 10 раз.