
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модуль 2. Химическая термодинамика и кинетика.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное образовательное учреждение высшего профессионального образования «РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ ЗАОЧНЫЙ УНИВЕРСИТЕТ» Владимирский филиал
ХИМИЯ Методические указания по выполнению контрольных работ
(для направлений подготовки 110800 Агроинженерия, 111100 Зоотехния)
Владимир 2013
Методические указания по выполнению контрольных работ «ХИМИЯ» предназначены для студентов первого курса направлений 110800 Агроинженерия, 111100 Зоотехния при подготовке и выполнении лабораторных работ. Методические указания содержат краткие теоретические сведения и задачи к каждому модулю. Методические указания составлены в соответствии с требованиями ФГОС ВПО и рабочими программами по дисциплине «Химия» для студентов направлений заочной форм обучения Цели и задачи дисциплины Цель дисциплины – формирование знаний и умений по химии и соответствующих компетенций у студентов в ходе освоения учебной дисциплины.
Задачи дисциплины: · сформировать знания об основных химических закономерностях, системах, методах и средствах химических исследований, необходимых в области агрономии, зоотехнии; · объяснить основные механизмы протекания химических процессов; · научить применению физико-химических методов анализа для определения показателей контроля качества продуктов и объетво окружающей среды;
Место дисциплины в структуре ООП: Дисциплина относится к базовой части математического и естественнонаучного цикла. Для изучения данной дисциплины студент должен обладать полным комплексом знаний и умений по химии, предъявляемых в рамках федерального государственного образовательного стандарта основного общего образования. Данная дисциплина предшествует изучению таких дисциплин как: органическая, биологическая и физколлоидная химия, экология, биохимия животных, кормопроизводство; производство продукции животноводства в крестьянских фермерских хозяйствах.
Требования к результатам освоения дисциплины: Процесс изучения дисциплины направлен на формирование следующих компетенций: · ОК-11 - использование основных законов естественнонаучных дисциплин в профессиональной деятельности; · ОК-12 - осознание сущности и значения информации в развитии современного общества; владение основными методами, способами и средствами получения, хранения, переработки информации; · ОК-13 - навыки работы с компьютером как средством управления информацией; · ОК-14 - способность работать с информацией в глобальных компьютерных сетях; · ПК-3 - готовность использовать современные информационные технологии; · ПК-5 - способность к обоснованию принятия конкретных технологических решений с учетом особенностей биологии животных; · ПК-9 - способность проводить зоотехническую оценку животных, основанную на знании их биологических особенностей.
В результате изучения дисциплины студент должен: Знать химические системы, методы, средства и правила интерпретации химических исследований: дисперсные, каталитические, электрохимические системы; химическое и фазовое равновесие, скорость реакции и методы ее регулирования; кислотно-основные и окислительно-восстановительные свойства веществ; аналитический сигнал, химический, физико-химический и физический анализ; химию элементов и их соединений; методы математического описания свойств важнейших свойств и классов соединений, особенности состава и свойств химических удобрений.
Уметь: использовать справочный, нормативный литературный материал; предсказывать свойства соединений, учитывая их принадлежность к определенному классу; прогнозировать протекание химических процессов; определять количество, массовую долю веществ, вступающих в реакцию и получающихся в ходе реакции, элемента в веществе по формуле, дозы удобрений и кормов с нужным соотношением дозируемых элементов, делать расчет по пересчету концентрации из одного вида в другой.
Владеть навыками самостоятельного освоения дисциплины с использованием современных информационных технологий; физико-химическими методами анализа показателей качества продуктов производства (методами определения рН растворов, качественного и количественного анализа) моделирования химических, и химико-биологических процессов Библиографический список 1. Глинка Н.Л. Общая химия: Учеб. пособие для бакалавриата нехим. вузов. изд. стер.- Л.: Химия, 2010 г. 702 с. и другие издания; 2. Ахметов А.С. Общая и неорганическая химия: Учеб.для вузов.-4-е изд, испр.-М.:Высш. шк.:Академия, 2010. –743с. 3. Общая химия: Учебник для вузов //Гузей Л.С., Кузнецов В.Н., Гузей А.С. Под ред. С.Ф.Дунаева. – М.:Изд-во Моск.ун-та, 1999.-332с. 4. Хомченко Г.П., Цитович И.К. Неорганическая химия: Учеб. для с.-х.вузов.- 2-е изд., перераб. и доп.- М.: Высш. шк., 2008 г 5. Князев Д.А., Смарыгин С.Н. Неорганическая химия: Учебник для вузов.- М.: Высш. шк., 2006. 430с 6. Неорганическая и аналитическая химия. Методические указания и задания для лабораторных занятий, Гузей А.С., Крутикова Е.В. М., Изд. РГАЗУ, 2011. 7. Неорганическая и аналитическая химия. Методические рекомендации по изучению дисциплины и задания для контрольных работ, Гузей А.С., Крутикова Е.В. – М., Изд. РГАЗУ, 2011. СОДЕРЖАНИЕ МОДУЛЬ 1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ. 1.1 ВЫВОД ХИМИЧЕСКИХ ФОРМУЛ. РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ И УРАВНЕНИЯМ……………………………………………………………………….....5 1.2 ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ……………………………………….7 1.3 ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ, СТРОЕНИЕ АТОМА. ХИМИЧЕСКАЯ СВЯЗЬ………………………………………………………………………………………..12 МОДУЛЬ 2. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ ………………………………………………………………………………17 МОДУЛЬ 3. ВОДНЫЕ РАСТВОРЫ ……………………………………………………………………..…24 МОДУЛЬ 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ. ЭЛЕКТРОХИМИЯ.......................................................................................................................................29 МОДУЛЬ 5. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ………………………………………………………….36 МОДУЛЬ 6. КАЧЕСТВЕННЫЙ АНАЛИЗ …………………………………………………………………37
Модуль 1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ. Задачи 1. Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода. 2. Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1: 3: 4: 7. 3. Найти простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла. 4. Вещество содержит (по массе) 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу. 5. Найти формулу кристаллогидрата хлорида бария, зная что 36,6 г соли при прокаливании теряют в массе 5,4 г. 6. Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5% углерода, 36,4% кислорода и 9,1% водорода, зная, что плотность ее паров по водороду равна 44. 7. Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41. 8. При сгорании 4,3 г углеводорода образовалось 13,2 г С02. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества. 9. При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема С02 и один объем N2. Найти молекулярную формулу газа. 10. Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2% (масс). 11. Вычислить массу азота, содержащегося в 1 кг: а) калийной селитры KNO3; б) аммиачной селитры NH4NO3; в) аммофоса (NH4)2HP04. 12. Вычислить процентное (по массе) содержание каждого из элементов в соединениях: a) Mg(OH)2; б) Fe (N03)3; в) H2S04; г) (NH4)2S04. 13. Какую массу железа можно получить из 2 т железной руды, содержащей 94% (масс.) Fe203? 13. К раствору, содержащему 10 г H2S04, прибавили 9 г NaOH. Какую реакцию имеет полученный раствор? 14. Раствор, содержащий 34,0 г AgN03, смешивают с раствором, содержащим такую же массу NaCl. Весь ли нитрат серебра вступит в реакцию? Сколько граммов AgCl получилось в результате реакции? 15. При сжигании 3,00 г антрацита получилось 5,30 л С02, измеренного при нормальных условиях. Сколько процентов углерода (по массе) содержит антрацит? 16. К раствору, содержащему 0,20 моля FeCl3, прибавили 0,24 моля NaOH. Сколько молей Fe (OH)3 образовалось в результате реакции и сколько молей FeCls осталось в растворе? 17. Сколько литров гремучего газа (условия нормальные) получается при разложении 1 моля воды электрическим током? 18. Какой объем ацетилена (условия нормальные) можно получить взаимодействием воды с 0,80 кг СаС2? 19. Сколько граммов NaCl можно получить из 265 г Na2C03? 20. При пропускании над катализатором смеси, состоящей из 10 молей S02 и 15 молей 02, образовалось 8 молей SO3. Сколько молей S02 и 0 2 не вступило в реакцию?
Задачи 21.. Составить уравнения реакций, с помощью которых можно осуществить указанные превращения: Ва—>ВаО —•Ва.Сi2 —>Ba(N03) 2 —>BaS04; Mg—>MgS04 —>Mg(OH)2 —MgO — MgCl2 • 22. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения: Zn—>K2Zn02; S—>H2S03; NH3—>HN03; Cu—>CuS. 23. Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НС1, H2S, N02, N2, Cl2, CH4, S02, NH3? Написать уравнения соответствующих реакций. 24. Какие соли можно получить, имея в своем распоряжении CuS04, AgN03, К3Р04, ВаС12? Написать уравнения реакций и назвать полученные соли, 25. Как доказать амфотерный характер ZnO, A1203, Sn(OH)2, Сг(ОН)3? 26. Можно ли осуществить в растворах указанные ниже реакции: CuS04 + BaCl2 —> BaS04 + CuCl2; FeS + K 2 S 0 4 —• F e S 0 4+K2 S; AgCl + KNО3 —• AgNO3 + KCl. Дать мотивированный ответ. 27. Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и НС1; б) СаС12 и Na2C03; в) NaCl и AgN03; г) KC1 и NaN03. Указать, какие комбинации невозможны и почему. 28. Какие из перечисленных кислот образуют кислые соли: HI, H2Se, H2Se03, H2C204, СН3СООН? 29. Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: P2Os, C02, N2Os, N02, S 02? 30. С какими из перечисленных ниже веществ будет реагировать соляная кислота: N205, Zn(OH)2, CaO, AgN03, H3P04, H2S04? Составить уравнения реакции. 31. Какие из указанных веществ реагируют с гидроксидом натрия: HNО3, СаО, С02, CuS04, Cd(OH)2, P205? Составить уравнения реакций. 32. Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs20, HgO, Bi203- 33. Написать уравнения реакций, доказывающих кислотный характер Se02, S03, Mn207, P205, Cr03. 34. Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль. 35. Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaN03, NaHS04, Na2HP04, K2S, Fe2(S04)3. 36. Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций. 37. Составить формулы нормальных и кислых солей калия и кальция, образованных: а) угольной кислотой; б) мышьяковистой кислотой. 38. Назвать соли: SbON03, [Fe(OH)2]2 C r 0 4, (A10H)S04, Cd(HS)2, Ca(H2P04) 2. 39. Написать уравнения реакций образования Mg2P207, Ca3(P04) 2, Mg(C104)2, Ba(N03)2 в результате взаимодействия: а) основного и кислотного оксидов; б) основания и кислотного оксида; в) основного оксида и кислоты; г) основания и кислоты. 40. Написать уравнения реакций, с помощью которых можно получить в лаборатории следующие вещества: а) хлороводород; б) сульфид свинца; в) сульфат бария; г) ортофосфат серебра; д) гидроксид железа (III); е) нитрат меди (II).
Пример3 Вычислить разность относительных электроотрицательностей атомов для связей Н — О и О — Э в соединениях Э(ОН)2, где Э — Mg, Ca или Sr, и определить: а) какая из связей Н — О или О — Э характеризуется в каждой молекуле большей степенью ионности; б) каков характер диссоциации этих молекул в водном растворе? Р е ш е н и е. По данным таблицы вычисляем разность электроотрицательностей
Т а к и м о б р а з о м: а) во всех рассмотренных молекулах связь Э — О более полярна, т. е. характеризуется большей степенью ионности; б) диссоциация на ионы в водных растворах будет осуществляться по наиболее ионной связи в соответствии со схемой: соединения будут диссоциировать по типу оснований. Для квантово-механического описания ковалентной связи и строения молекул могут быть применены два подхода: метод валентных связей и метод молекулярных орбиталей. В основе метода валентных связей (ВС) лежат следующие положения: 1. Ковалентная химическая связь образуется двумя электронами, обладающими противоположно направленными спинами и принадлежащими двум атомам, между которыми осуществляется связь. Такая общая электронная пара может образоваться как в результате спаривания двух неспаренных электронов, принадлежащих разным атомам (обычный механизм образования связи), так и за счет пары электронов одного атома — донора — и вакантной орбитали второго атома — акцептора (донорно-акцепторный механизм образования связи). 2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Поэтому ковалентная связь образуется в таком направлении, при котором это перекрывание максимально. Пример 4. Как изменяется прочность связи Н — Э в ряду Н2О— H2 S — Н2Sе—- Н2 Те? Р е ш е н и е. В указанном ряду размеры валентных электронных облаков элементов (О, S, Se, Те) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т. е. ослабление связи. К этому же результату приводит возрастающее экранирование ядер рассматриваемых элементов в ряду О — S — Se — Те вследствие увеличения числа промежуточных электронных слоев. Таким образом, при переходе от кислорода к теллуру прочность связи Н — Э уменьшается.
При образовании полярной ковалентной связи смещение общего электронного облака приводит к тому, что плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже — вблизи менее электроотрицательного атома. В результате первый атом приобретает избыточный отрицательный заряд, а второй — такой же по абсолютной величине избыточный положительный заряд. Подобную систему из двух равных по абсолютной величине и противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга, называют электрическим диполем. Напряженность поля, создаваемая диполем, пропорциональна дипольному моменту молекулы, представляющему собой произведение абсолютного значения заряда электрона q(l,60·10-19 Кл) на расстояние l между центрами положительного и отрицательного зарядов в диполе: µ = ql. Дипольный момент молекулы служит количественной мерой ее полярности. Дипольные моменты молекул обычно измеряют в дебаях (D).1D = 3,33 10-30 (Кл·м).
Дипольный момент — величина векторная, направленная от положительного конца диполя к отрицательному. Поэтому дипольный момент многоатомной молекулы следует рассматривать как векторную сумму дипольных моментов связей: он зависит не только от полярности каждой связи, но и от взаимного расположения этих связей. Так, молекула АВ2 может иметь линейную (а) или угловую (б) структуру:
Для объяснения геометрической структуры молекул, другими словами, для объяснения направленности ковалентных связей используют представление о гибридизации АО центрального атома. Согласно этому представлению, образованию химических связей может предшествовать изменение валентных орбиталей атома: исходные неравноценные атомные орбитали, как бы «перемешиваясь», образуют энергетически равноценные орбитали. При этом происходит перераспределение электронной плотности, которое требует затраты энергии и в изолированных атомах не реализуется. Но в результате гибридизации электронное облако вытягивается по направлению к взаимодействующему атому, благодаря чему увеличивается его перекрывание с электронными облаками последнего. Это приводит к образованию более прочной химической связи и, следовательно, к выделению дополнительной энергии, которая и компенсирует затраты энергии на гибридизацию. Число гибридных АО равно числу участвующих в гибридизации исходных АО атома. Если в гибридизации участвуют одна s- и jдна р-орбитали (sp- гибридизация), то образуются две равноценные sp-орбитали; из одной s- и двух р-орбиталей (sр2-гибридизация) образуются три sр2-орбитали и т. д. Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодействие между электронами было минимальным, т. е. как можно дальше друг от друга. Поэтому при sp-гибридизации электронные облака ориентируются в противоположных направлениях, при sp2 гибридизации —в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120° (т. е. в направлениях к вершинам правильного треугольника), при зр3-гибридизации — к вершинам тетраэдра (угол между этими направлениями составляет 109°28'). Взаимное расположение осей гибридных электронных облаков при некоторых видах гибридизации показано ниже (каждая стрелка передает направление оси одного из облаков):
Пространственная структура молекулы определяется видом гибридизации валентных орбиталей центрального атома и числом неподеленных электронных пар, содержащихся в его валентном электронном слое. Ионная связь не обладает направленностью и насыщаемостью. В связи с этим у ионных соединений проявляется склонность к ассоциации. Все ионные соединения в твердом состоянии образуют ионные кристаллические решетки, в которых каждый ион окружен несколькими ионами противоположного знака. При этом все связи данного иона с соседними ионами равноценны, так что весь кристалл можно рассматривать как единую молекулу. Свойства ионных соединений вО многом определяются взаимной поляризацией входящих в их состав ионов. Поляризация иона выражается в относительном смещении ядра и окружающих его электронов внешней электронной оболочки под действием электрического поля соседнего иона; при этом валентные электроны смещаются в сторону катионов. Подобная деформация электронной оболочки ведет к понижению степени ионности связи и к превращению ее в полярную ковалентную связь. Поляризуемость ионов (т. е. их способность деформироваться под действием внешнего электрического поля) характеризуется следующими особенностями: 1. При одинаковом абсолютном значении заряда и равных радиусах ионов поляризуемость анионов больше поляризуемости катионов. 2. Поляризуемость ионов с аналогичным электронным строением возрастает с ростом ионного радиуса (т. е. с увеличением числа электронных слоев). 3. При одном и том же заряде и одинаковом радиусе ионов поляризуемость ионов с 18-электронной оболочкой (например, Сu+, Cd2+) выше, чем ионов с благородногазовой электронной структурой (Na+, Ca2+ и т. п.). Поскольку размеры анионов, как правило, больше размеров катионов, то анионы обладают большей поляризуемостью и меньшей поляризующей способностью, чем катионы. Поэтому при взаимодействии катиона с анионом поляризации подвергается преимущественно анион; поляризацией катиона в большинстве случаев можно пренебречь.
Атом водорода, соединенный с атомом сильно электроотрицательного элемента, способен к образованию еще одной химической связи. Эта связь называется водородной. Наличие водородных связей приводит к заметной полимеризации воды, фтороводорода, многих органических соединений. Например, при невысоких температурах фтороводород — полимер (HF)n, где п может доходить до шести, муравьиная кислота — димер даже в газовой фазе.
Задачи 41 Чему равно число энергетических подуровней для данного энергетического уровня? Каким значением главного квантового числа характеризуется энергетический уровень, если он имеет 4 подуровня? Дайте их буквенное обозначение. 42 Какой элемент имеет в атоме три электрона, для каждого из которых n = 3 и l = 1? Чему равно для них значение магнитного квантового числа? Должны ли они иметь антипараллельные спины? 43 Напишите электронные формулы атомов с порядковыми номерами 18, 63. К какому электронному семейству они относятся? 44 Объясните, пользуясь правилом Клечковского, какие атомные орбитали заполняются раньше: а) 3d или 4р; б) 4f или 5p; в) 5p или 6s; г) 4d или 4f. 45 Укажите порядковый номер элемента у которого: а) заканчивается заполнение электронами 3d-орбитали; б) заканчивается заполнение электронами 4s-орбитали; в) начинается заполнение электронами 4p-орбитали;
46 Сколько неспаренных электронов содержат атомы в невозбужденном состоянии:а) магния; б) алюминия; в) углерода; г) бора; д) серы? 47 Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 39 и 41. Сколько свободных d-орбиталей в атомах этих элементов. 48 Напишите электронные формулы атомов элементов: а) цезия; б) брома; в) ванадия; г) молибдена; д) железа. 49 Атомы, каких элементов имеют следующее строение внешнего и предвнешнего электронного уровня:а) 2s22p63s23p3; б) 3s23p64s2; в) 3s23p64s23d5; г) 4s24p65s04d10. 50 Атомы, каких элементов имеют электронную конфигурацию: 51 Дайте современную формулировку периодического закона. Чем она отличается от той, которая была дана Д.И. Менделеевым? 52 Как учение о строении атома объясняет периодичность в изменении свойств химических элементов? 53 Какой физический смысл имеет порядковый номер и почему химические свойства элемента в конечном счете определяются зарядом ядра его атома? Какая из связей Сa - H, C - Cl, Br - Cl является наиболее полярной и почему? 54 Какой тип гибридизации электронных облаков в молекулах: а) BCl3; б)CaCl2; в) GeCl4; г) SiCl4; Какую пространственную конфигурацию имеют эти молекулы? 56 Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? 57 Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему плавиковая кислота и вода, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? 58 Почему молекула диоксида углерода неполярна, хотя связь углерод - кислород имеет электрический момент диполя 0,37·10-30 Кл-м? 59 Каково взаимное расположение электронных облаков при sp2-гибридизации? Приведите примеры. Какова пространственная структура этих молекул? 60 В каком из перечисленных веществ более выражен ионный характер связи: CCl4, SiO2, CaBr2, NH3? Пример 3 Определить знаки ΔН, ΔS, ΔG для реакции АВ(к.) + В2 (г.) = А В3 (к.), протекающей при температуре 298 К в прямом направлении. Как будет изменяться значение ΔG с ростом температуры? Р е ш е н и е. Самопроизвольное протекание реакции указывает на то, что для нее ΔG < 0. В результате реакции общее число частиц в системе уменьшается, причем расходуется газ В2, а образуется кристаллическое вещество АВз; это означает, что система переходит в состояние с более высокой упорядоченностью, т. е. для рассматриваемой реакции ΔS < 0. Таким образом, в уравнении ΔG = ΔН — TΔS величина ΔG отрицательна, а второй член правой части уравнения (—TΔS) положителен. Это возможно только в том случае, если ΔН. < 0. С ростом температуры положительное значение члена — TΔS в уравнении возрастает, так что величина ΔG будет становиться менее отрицательной.
Пример 4. Пользуясь справочными данными, установить, возможно ли при температурах 298 и 2500 К восстановление диоксида титана до свободного металла по схеме:
Скорость химической реакции измеряется количеством вещества вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции) В случае гомогенного процесса, протекающего при постоянном объеме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени. Это определение можно выразить уравнением v — ±ΔC/Δt, где знак «плюс» относится к изменению концентрации вещества, образующегося в результате реакции (ΔС > 0), а знак «минус» — к изменению концентрации вещества, вступающего в реакцию (ΔС < 0). Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется з а к о н ом д е й с т в и я масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Так, для реакции типа А + В2 —> АВ2 закон действия масс выражается следующим образом: v = k[A] [B2]. В этом уравнении [А] и [В2] — концентрации вступающих в реакцию веществ, а коэффициент пропорциональности к — константа скорости реакции, значение которой зависит от природы реагирующих веществ. Гораздо реже реакция осуществляется путем столкновения трех реагирующих частиц. Например, реакция типа А + 2В —АВ2 может протекать по механизму тройных столкновений: А + В + В + АВ2. В этом случае, в соответствии с законом действия масс, можно записать v = k[A] [В] [В], т. е. v = k [А] [В]2. При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс. Пример 5. Написать выражения закона действия масс для реакций а) 2 N О (г.) + С12 (г.)= 2 N О С1 (г.); б) С а С О3 (к.) =С а О (к.) + С 0 2 (г.) Р е ш е н и е, a) v = k[NO]2 [Cl2]. б) Поскольку карбонат кальция — твердое вещество, концентрация которого yе изменяется в ходе реакции, искомое выражение будет иметь вид: v — k, т. е. в lанном случае скорость реакции при определенной температуре постоянна. Пример 6. Как изменится скорость реакции 2 N О (г.) + O2 (г.) = 2 N 0 2 (г.), если уменьшить объем реакционного сосуда в 3 раза? Р е ш е н и е. До изменения объема скорость реакции выражалась уравнением: v = k[NO]2[02]. Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в три раза. Следовательно, теперь v' = k (3 [N О])2 (3 [02]) = 27k [N О]2 [О2]. Сравнивая выражения для v и v', находим, что скорость реакции возрастет в 27 раз.
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Пример 7. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 75° С? Р е ш е н и е. Поскольку Δt = 55°C, то, обозначив скорость реакции при 20 и 75° С соответственно через v и v', можем записать:
Отсюда v'/v = 287. Скорость реакции увеличится в.287 раз.
Как показывает последний пример, скорость химической реакции очень сильно возрастает при повышении температуры. Это связано с тем, что элементарный акт химической реакции протекает не при всяком столкновении реагирующих молекул: реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым создать возможность образования новых молекул. Поэтому каждая реакция характеризуется определенным энергетическим барьером; для его преодоления необходима энергия активации — некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции. Зависимость константы скорости реакции k от энергии активации (Еa, Дж/моль) выражается у р а в н е н и е м Аррениуса:
Здесь Z — число столкновений молекул в секунду в единице объема;е — основание натуральных логарифмов (е = 2,718...); R — универсальная газовая постоянная (8,314 Дж-моль- 1 ·К- 1); Т — температура, К; Р — так называемый стерический множитель. Скорость химической реакции возрастает в присутствии катализатора. действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции понижается и активными становятся некоторые молекулы, энергия которых была недостаточна для осуществления реакции в отсутствие Катализатора. В результате общее число активных молекул возрастает и скорость реакции увеличивается.
При протекании химической реакции концентрации исходных веществ уменьшаются; в соответствии с законом действия масс это приводит к уменьшению скорости реакции. Если реакция обратима, т. е. может протекать как в прямом, так и в обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. В случае обратимой химической реакции A + B =C + D зависимость скоростей прямой реакций от концентраций реагирующих веществ выражается соотношениями: vпрям = kпрям [А] [В]; vобр = kобр [С] [D]. В состоянии химического равновесия vпрям = vобр т. е. kпрям [А] [В]= kобр [С] [D]. K=[А] [В]/ [С] [D]. Здесь К — константа равновесия реакции. Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Константа равновесия — постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше константа равновесия, тем «глубже» протекает реакция, т. е. тем больше выход ее продуктов. В химической термодинамике доказывается, что для общего случая химической реакции
Катализатор не влияет на значение константы равновесия, поскольку он одинаково снижает энергию активации прямой и обратной реакций и поэтому одинаково изменяет скорости прямой и обратной реакций. Катализатор лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
Пример 8. В системе А (г.) + 2В(г.) = С (г.) равновесные концентрации равны: [А] = 0,0.6 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Ш а т е л ь е: Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено. Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т. е. охлаждением системы; повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т. е. в направлении, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу/
Пример 9. В каком направлении сместится равновесие в системах а) С О (г.) + С12 (r.) =C O Cl2 (г.), б) Н 2 (г.) + Cl2 (г.)= 2 Н Cl (г.), еcли при неизменной температуре увеличить давление путем уменьшения объема газвовой смеси? Р е ш е н и е, а) Протекание реакции в прямом направлении приводит к уменьшениюобщего числа молей газов, т. е. к уменьшению давления в системе. согласно принципу Ле Шателье, повышение давления вызывает смещение равновесия в сторону прямой реакции. б) Протекание реакции не сопровождается изменением числа молей газов и не приводит, следовательно, к изменению давления. В этом случае изменение давления не вызывает смещения равновесия.
Задачи 61. Вычислите энтальпию образования NO(г), исходя из следующих термохимических уравнений: 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж); Δ H 0 = –1168,80 кДж; 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); Δ H 0 = –1530,28 кДж. 62. Рассчитайте ΔG0 реакций: а) CO(г) + ½ O2(г) = CO2(г); б) ½ N2(г) + 3/2 H2(г) = NH3(г); в) C6H6(ж) + NH3(г) = H2(г) + C6H5NH2(ж). 63. При какой температуре наступит равновесие с
|
||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 1013; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |

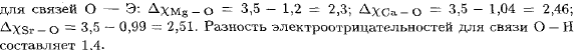
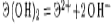 ; следовательно, все рассматриваемые
; следовательно, все рассматриваемые






 В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.



