Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Цели и задачи модульной программыСодержание книги
Поиск на нашем сайте
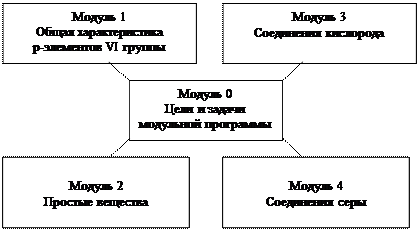
МОДУЛЬНАЯ ПРОГРАММА Р-ЭЛЕМЕНТЫ VI ГРУППЫ
МОДУЛЬ 0 ЦЕЛИ И ЗАДАЧИ МОДУЛЬНОЙ ПРОГРАММЫ
Изучив данную программу, студент должен знать: - электронное строение атомов р-элементов VI группы, - важнейшие степени окисления р-элементов VI группы, - валентность атомов в ковалентных соединениях, - изменение в группе атомных характеристик (атомный радиус, энергия ионизации, сродство к электрону, электроотрицательность), - нахождение в природе, - физические и химические свойства простых веществ, - получение и свойства соединений кислорода, - получение и свойства соединений серы.
Изучив данную программу, студент должен уметь: - выявлять и объяснять закономерности в изменении свойств простых веществ и важнейших соединений р-элементов VI группы, - проводить лабораторные опыты по получению и изучению свойств кислорода, серы, и их важнейших соединений.
МОДУЛЬ 1 ОБЩАЯ ХАРАКТЕРИСТИКА р-ЭЛЕМЕНТОВ VI ГРУППЫ
УЭ-0. Цели и задачи модуля. Изучив данный модуль, студент должен знать: - электронное строение атомов р-элементов VI группы, особенности строения атома кислорода, - закономерности изменения в VIА группе следующих свойств атомов: - радиус атома, - энергия ионизации, - сродство к электрону, - относительная электроотрицательность, - степени окисления и валентные состояния атомов, примеры соединений, - зависимость кислотно-основных и окислительно-восстановительных свойств соединений от степени окисления элемента, - нахождение р-элементов VI группы в природе.
Изучив данный модуль, студент должен уметь: - исходя из электронного строения атомов объяснять наличие определенных степеней окисления и валентных состояний, - объяснять закономерности изменения атомных характеристик в VIА группе, - давать общую характеристику соединениям р-элементов VI группы, исходя из степеней окисления атомов, - характеризовать важнейшие соединения кислорода – оксиды и гидроксиды, - сопоставлять кислотно-основные и окислительно-восстановительные свойства соединений р-элементов VI группы в зависимости от степени окисления элемента и устойчивости соединений.
УЭ-1. Вводный контроль. Задание 1. Изобразить электронно-графические формулы внешнего электронного уровня атомов р-элементов VI группы. Чем принципиально отличается электронное строение атома кислорода?
Задание 2. Как зависит атомный радиус от порядкового номера элементов в VIА группе? Какое влияние оказывает лантаноидное сжатие?
Таблица 1 Атомные характеристики р-элементов VI группы
Задание 3. В VIА группе наблюдается монотонное изменение энергии ионизации и электроотрицательности. В то же время в изменении сродства к электрону проявляется резкое отличие кислорода. Как это можно объяснить? Задание 4. Первая энергия ионизации атома бора равна 8,30 эВ, атома бериллия 9,32 эВ. Сравните с энергией ионизации атома полония. Можно ли на основе этих данных отнести полоний к металлам?
УЭ-2. Степени окисления. Задание 5. Почему так сильно отличается набор степеней окисления кислорода и серы? Приведите примеры соединений, соответствующих каждой степени окисления в таблице 2. Таблица 2 Степени окисления кислорода и серы
Задание 6. Почему соединения с нечетными степенями окисления р-элементов VI группы являются неустойчивыми? Задание 7. Нечетные, а также дробные степени окисления элементов образуются в соединениях, содержащих цепочки одинаковых атомов. Примером могут служить сульфаны H2Sn. Какие степени окисления принимает сера в этих соединениях, если 2<n< 8?
УЭ-3. Валентность р-элементов VI группы. Задание 8. Понимая под валентностью число ковалентных химических связей (число поделенных электронных пар), определите валентность серы в оксидах серы (IV) и (VI). Задание 9. Сколько валентных электронов в атоме кислорода? Чему равна максимальная валентность кислорода?
УЭ-4. Общая характеристика свойств соединений р-элементов VI группы. Задание 10. Как правило, чем выше степень окисления элемента в кислоте, тем более сильным электролитом является кислота. Выполняется ли это правило для серосодержащих кислот?
Таблица 3 Константы диссоциации некоторых серосодержащих кислот
Задание 11. От серы к полонию наблюдается усиление основных свойств оксидов и гидроксидов. Подтверждается ли это правило данными таблицы 4? Таблица 4 Константы диссоциации некоторых серо-, селен- и теллурсодержащих кислот
Задание 12. По данным таблицы 5 сделайте выводы, как меняется в ряду Н2О–Н2Те: а) длина связи, б) угол между связями, в) энтальпия образования, г) константа диссоциации, д) температуры плавления и кипения. По каким свойствам Н2О резко отличается? Таблица 5 Состав атмосферы
МОДУЛЬ 2 ПРОСТЫЕ ВЕЩЕСТВА
УЭ-0. Цели и задачи модуля. Изучив данный модуль, студент должен знать: - лабораторные методы получения кислорода, - важнейшие физические свойства кислорода и серы, - важнейшие химические свойства кислорода и серы.
Изучив данный модуль, студент должен уметь: - получать в лаборатории кислород и серу. - проводить лабораторные опыты по изучению свойств кислорода и серы.
УЭ-1. Вводный контроль. Задание 1. Аллотропные модификации элемента отличаются структурой и свойствами. Опишите строение молекулы О2, используя метод молекулярных орбиталей, и молекул О3, S8 с помощью метода валентных связей.
Таблица 8 МОДУЛЬ 3 СОЕДИНЕНИЯ КИСЛОРОДА
УЭ-0. Цели и задачи модуля. Изучив данный модуль, студент должен знать: - особенности физических и химических свойств воды, - получение и свойства кристаллогидратов, - классификацию оксидов по химическим свойствам, - химические свойства пероксида водорода и пероксида бария.
Изучив данный модуль, студент должен уметь: - объяснять особые физические свойства воды наличием водородной связи, - пользоваться диаграммой состояния воды, - проводить лабораторные опыты по изучению свойств воды, пероксидов и различных оксидов.
УЭ-1. Вводный контроль. Задание 1. Заполните таблицу 9 формулами оксидов элементов первого, второго и третьего периодов. Таблица 9 Классификация оксидов
Задание 2. Молекула воды имеет угловую структуру. Угол между связями больше прямого, но меньше тетраэдрического. Объясните этот факт тремя способами: а) связи образованы р-орбиталями атома кислорода, б) орбитали кислорода участвуют в sp3-гибридизации, в) наблюдается отталкивание неподеленных электронных пар. Задание 3. Прочность связи пропорциональна кратности связи. Сравните прочность связи в молекуле О2 и ионе О22–, используя теорию молекулярных орбиталей.
УЭ-2. Свойства воды. Опыт 9. Получение и свойства кристаллогидратов. В фарфоровую чашку поместить около 1 г безводного сульфата меди (II) и добавить 2-3 капли воды. Полученную соль прокалить в пламени горелки. Наличие какого иона придает медному купоросу голубой цвет? Задание 4. Равновесие лед D вода при увеличении давления смещается в сторону жидкой воды. Объясните этот факт, используя диаграмму состояния воды. УЭ-3. Пероксид водорода. Опыт 9. Получение Н2О2. В колбу вместимостью 50 мл налить 20 мл 5 %-ного раствора H2SO4 и охладить в смеси воды с льдом. Непрерывно взбалтывая содержимое колбы, добавить небольшими порциями около 1 г ВаО2. Декантировать раствор и сохранить для следующего опыта. Какова температура смеси воды с льдом? С какой целью использовалось охлаждение? Опыт 10. Окислительные свойства Н2О2. К части полученного раствора Н2О2, содержащего серную кислоту, добавить несколько капель раствора KI. После изменения окраски добавить раствор крахмала. Опыт 11. Восстановительные свойства Н2О2. К другой части раствора, полученного в опыте 9, добавить несколько капель разбавленного раствора KMnO4. Опыт 12. Разложение Н2О2. а) в пробирку налить концентрированный раствор Н2О2, оставить пробирку в штативе на несколько часов. Как объяснить образование пузырьков газа в пробирке? Назовите два фактора, определяющих неустойчивость Н2О2 в этих условиях; б) к концентрированному раствору Н2О2 добавить немного MnO2; какова роль диоксида марганца?
МОДУЛЬ 4 СОЕДИНЕНИЯ СЕРЫ
УЭ-0. Цели и задачи модуля. Изучив данный модуль, студент должен знать: - особенности физических и химических свойств концентрированного раствора серной кислоты, - классификацию сульфатов по растворимости, - окислительно-восстановительные свойства сульфитов, - классификацию сульфидов по растворимости, - восстановительные свойства сульфидов. - получение и окислительно-восстановительные свойства тиосульфатов, - отношение различных серосодержащих солей к гидролизу.
Изучив данный модуль, студент должен уметь: - объяснять отличия свойств концентрированной и разбавленной серной кислоты, - оценивать проявление окислительных или восстановительных свойств у различных соединений серы, - объяснять отношение различных серосодержащих солей к гидролизу, - проводить лабораторные работы по изучению свойств соединений серы.
УЭ-1. Свойства серной кислоты. Опыт 13. (Тяга!) Взаимодействие серной кислоты с металлами и неметаллами.
Изучить взаимодействие разбавленной и концентрированной H2SO4 с а) металлами: Mg, Zn, Fe, Cu; б) неметаллами: S, C. При отсутствии видимого взаимодействия пробирку с серной кислотой осторожно подогреть. Результаты наблюдений внести в таблицу 10. Таблица 10 МОДУЛЬНАЯ ПРОГРАММА Р-ЭЛЕМЕНТЫ VI ГРУППЫ
МОДУЛЬ 0 ЦЕЛИ И ЗАДАЧИ МОДУЛЬНОЙ ПРОГРАММЫ
Изучив данную программу, студент должен знать: - электронное строение атомов р-элементов VI группы, - важнейшие степени окисления р-элементов VI группы, - валентность атомов в ковалентных соединениях, - изменение в группе атомных характеристик (атомный радиус, энергия ионизации, сродство к электрону, электроотрицательность), - нахождение в природе, - физические и химические свойства простых веществ, - получение и свойства соединений кислорода, - получение и свойства соединений серы.
Изучив данную программу, студент должен уметь: - выявлять и объяснять закономерности в изменении свойств простых веществ и важнейших соединений р-элементов VI группы, - проводить лабораторные опыты по получению и изучению свойств кислорода, серы, и их важнейших соединений.
МОДУЛЬ 1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 270; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.230.170 (0.011 с.) |