
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика р-элементов VI группыСодержание книги
Поиск на нашем сайте
УЭ-0. Цели и задачи модуля. Изучив данный модуль, студент должен знать: - электронное строение атомов р-элементов VI группы, особенности строения атома кислорода, - закономерности изменения в VIА группе следующих свойств атомов: - радиус атома, - энергия ионизации, - сродство к электрону, - относительная электроотрицательность, - степени окисления и валентные состояния атомов, примеры соединений, - зависимость кислотно-основных и окислительно-восстановительных свойств соединений от степени окисления элемента, - нахождение р-элементов VI группы в природе.
Изучив данный модуль, студент должен уметь: - исходя из электронного строения атомов объяснять наличие определенных степеней окисления и валентных состояний, - объяснять закономерности изменения атомных характеристик в VIА группе, - давать общую характеристику соединениям р-элементов VI группы, исходя из степеней окисления атомов, - характеризовать важнейшие соединения кислорода – оксиды и гидроксиды, - сопоставлять кислотно-основные и окислительно-восстановительные свойства соединений р-элементов VI группы в зависимости от степени окисления элемента и устойчивости соединений.
УЭ-1. Вводный контроль. Задание 1. Изобразить электронно-графические формулы внешнего электронного уровня атомов р-элементов VI группы. Чем принципиально отличается электронное строение атома кислорода? Задание 2. Как зависит атомный радиус от порядкового номера элементов в VIА группе? Какое влияние оказывает лантаноидное сжатие?
Таблица 1 Атомные характеристики р-элементов VI группы
Задание 3. В VIА группе наблюдается монотонное изменение энергии ионизации и электроотрицательности. В то же время в изменении сродства к электрону проявляется резкое отличие кислорода. Как это можно объяснить? Задание 4. Первая энергия ионизации атома бора равна 8,30 эВ, атома бериллия 9,32 эВ. Сравните с энергией ионизации атома полония. Можно ли на основе этих данных отнести полоний к металлам?
УЭ-2. Степени окисления. Задание 5. Почему так сильно отличается набор степеней окисления кислорода и серы? Приведите примеры соединений, соответствующих каждой степени окисления в таблице 2.
Таблица 2 Степени окисления кислорода и серы
Задание 6. Почему соединения с нечетными степенями окисления р-элементов VI группы являются неустойчивыми? Задание 7. Нечетные, а также дробные степени окисления элементов образуются в соединениях, содержащих цепочки одинаковых атомов. Примером могут служить сульфаны H2Sn. Какие степени окисления принимает сера в этих соединениях, если 2<n< 8?
УЭ-3. Валентность р-элементов VI группы. Задание 8. Понимая под валентностью число ковалентных химических связей (число поделенных электронных пар), определите валентность серы в оксидах серы (IV) и (VI). Задание 9. Сколько валентных электронов в атоме кислорода? Чему равна максимальная валентность кислорода?
УЭ-4. Общая характеристика свойств соединений р-элементов VI группы. Задание 10. Как правило, чем выше степень окисления элемента в кислоте, тем более сильным электролитом является кислота. Выполняется ли это правило для серосодержащих кислот? Таблица 3 Константы диссоциации некоторых серосодержащих кислот
Задание 11. От серы к полонию наблюдается усиление основных свойств оксидов и гидроксидов. Подтверждается ли это правило данными таблицы 4? Таблица 4 Константы диссоциации некоторых серо-, селен- и теллурсодержащих кислот
Задание 12. По данным таблицы 5 сделайте выводы, как меняется в ряду Н2О–Н2Те: а) длина связи, б) угол между связями, в) энтальпия образования, г) константа диссоциации, д) температуры плавления и кипения. По каким свойствам Н2О резко отличается?
Таблица 5 Характеристики молекул и некоторые свойства воды и халькогеноводородов
Задание 13. В некоторых соединениях степень окисления р-элемента превышает номер группы. В каких кислотах серы это наблюдается? Дайте объяснение, исходя из структурных формул этих кислот. Задание 14. Заполните таблицу 6, используя формулы известных кислот серы (таблица 3). Таблица 6 Характеристики окислительно-восстановительных свойств кислот серы
УЭ-5. р-Элементы VI группы в природе. Задание 15. Кислород – сильный окислитель. Сера проявляет достаточно сильные окислительные и восстановительные свойства. Тем не менее, в природе много свободного кислорода и встречается свободная сера. Предложите объяснения. Задание 16. По данным таблицы 7 вычислите молярную массу воздуха.
Таблица 7 Состав атмосферы
МОДУЛЬ 2 ПРОСТЫЕ ВЕЩЕСТВА
УЭ-0. Цели и задачи модуля. Изучив данный модуль, студент должен знать: - лабораторные методы получения кислорода, - важнейшие физические свойства кислорода и серы, - важнейшие химические свойства кислорода и серы.
Изучив данный модуль, студент должен уметь: - получать в лаборатории кислород и серу. - проводить лабораторные опыты по изучению свойств кислорода и серы.
УЭ-1. Вводный контроль. Задание 1. Аллотропные модификации элемента отличаются структурой и свойствами. Опишите строение молекулы О2, используя метод молекулярных орбиталей, и молекул О3, S8 с помощью метода валентных связей.
Таблица 8
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 316; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.209.64 (0.007 с.) |

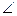 НЭН, °
НЭН, °



