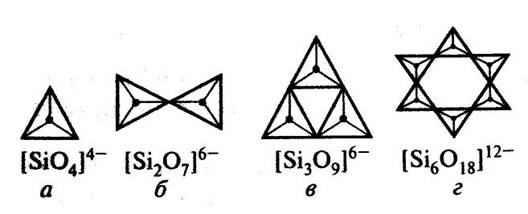Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модуль 1. Общая характеристика подгруппы, получение иСодержание книги
Поиск на нашем сайте
ОГЛАВЛЕНИЕ Введение 5 Модуль 1. Общая характеристика подгруппы, получение и Свойства простых веществ 7 Содержание модуля 7 Простые вещества 10 Химические свойства простых веществ. 13 1.2 Проектное задание 16 Тест рубежного контроля 17 Модуль 2. Водородные соединения, гидриды и их производные 18 Содержание модуля 18 Водородные соединения элементов подгруппы углерода 18 Карбиды 20 Силициды 22 Германиды, станниды, плюмбиды 23 2.2 Проектное задание 23 Тест рубежного контроля 24 Модуль 3. Оксид углерода (IV), угольная кислота и их соли 25 Содержание модуля 25 3.2 Проектное задание 28 Тест рубежного контроля 28 Модуль 4. Диоксид кремния, кремниевые кислоты и их соли 29 Содержание модуля 29 4.2 Проектное задание 37 Тест рубежного контроля 37 Модуль 5. Диоксиды германия(IV), олова(IV) и свинца (IV). Германиевые, оловянные и свинцовые кислоты и их соли 38 Содержание модуля 38 5.2 Проектное задание 43 Тест рубежного контроля 43 Модуль 6. Оксиды Э(II), гидроксиды Э(II) и их соли 44 Содержание модуля 44 Оксид углерода (II) и оксид кремния (II) 44 Оксиды германия, олова и свинца (II) 46 6.2 Проектное задание 49 Тест рубежного контроля 50 Модуль 7. Галогениды, сульфиды, серосодержащие и Азотсодержащие соединения 50 Содержание модуля 51 Галогениды элементов подгруппы углерода 52 Соединения с серой 64 Азотсодержащие соединения 66 7.2 Проектное задание 68 Тест рубежного контроля 68 Список литературы 69 ВВЕДЕНИЕ Данное учебно-методическое пособие предназначено для более детального изучения и разъяснения вопросов широкого круга, связанных с химией углерода, кремния, германия, олова и свинца. Пособие разбито на 7 модулей. Модуль № 1 посвящен вопросам общей характеристике всей подгруппы углерода на основе строения атомов, изменения радиусов, потенциалов ионизации, энергии сродства к электрону и изменения электроотрицательности. Кроме этого, рассматриваются физические свойства простых веществ, образованных атомами данных химических элементов, аллотропные модификации; химические свойства углерода, кремния, германия, олова и свинца, их взаимодействие с водой, кислотами и щелочами, отношение к другим простым веществам.
В модуле № 2 рассматривается строение водородных соединений элементов подгруппы углерода, оценивается изменение длины связи Э-Н, прочности связи, термодинамическая стабильность водородных соединений углерода, кремния и гидридов германия, олова и свинца; описываются физические свойства водородных соединений, химические свойства как водородных соединений, так и их производных – карбидов, силицидов, германидов, станнидов и плюмбидов. Модули 3,4 и 5 содержат сведения об оксидах углерода, кремния, германия, олова и свинца в степени окисления (+4), соответствующих гидроксидах и их солях; приводятся способы получения оксидов и гидроксидов; описываются их физические свойства; давается характеристика кислотно-основных свойств оксидов и гидроксидов и характеристика окислительно-восстановительных свойств. В связи с тем, что модуль №3 очень обширен, то вопросы, практические задания и тест рубежного контроля даются не к модулю в целом, а к каждому подразделу модуля в отдельности. Модуль № 6 содержит сведения об оксидах и гидроксидах элементов подгруппы углерода в степени окисления +2), их получении и физических свойствах; сравниваются кислотно-основные и окислительно-восстановительные свойства оксидов и гидроксидов (II). Модуль № 7 содержит подробное описание галогенидов, более краткое описание сульфидов, серо- и азотсодержащих соединений элементов подгруппы углерода. Научное обоснование методики изучения данного раздела: данное пособие предназначено для более углубленного изучения материала раздела неорганической химии – «Химия элементов подгруппы углерода», который дается в курсе соответствующих лекций; для самоподготовки к семинарским занятиям; для самостоятельной подготовки к лабораторным занятиям по темам - «Соединения углерода»; «Соединения кремния»; «Соединения подгруппы германия». Методика выполнения деятельности: а) прочитать материалы соответствующего лекционного материала; б) прочитать содержание учено-методического пособия «Химия элементов подгруппы углерода»; в) выполнить проектное задание соответствующего модуля; г) ответить на вопросы теста рубежного контроля.
Модуль 1. Общая характеристика подгруппы, получение и свойства простых веществ. Комплексная цель модуля: изучение строения атомов элементов подгруппы углерода; научиться давать общую характеристику подгруппы на основе строения атомов и положения в периодической системе Д. И. Менделеева; знать физические свойства простых веществ; описывать химические свойства простых веществ, используя уравнения химических реакций. Содержание модуля Простые вещества. По содержанию в земной коре (0,14 ат.%) углерод уступает многим элементам. Тем не менее, углерод – главная составная часть животного и растительного мира. Он входит в состав каменного угля, нефти, природных газов, а также многих минералов: мел, мрамор, известняк CaCO3, доломит CaCO3 · MgCO3, магнезит MgCO3, сидерит FeCO3, малахит (CuOH)2CO3 и др. В виде углекислого газа присутствует в воздухе. Аллотропия углерода. В свободном состоянии в природе углерод встречается в виде четырех простых веществ различного строения – графита, алмаза (структуры которых представлены на рис.1), карбина и фуллерена.
Рис.1 Кристаллические структуры алмаза (а) и графита (б)
Алмаз – бесцветное, прозрачное вещество с плотностью 3,5 г/см3. Он сильно преломляет лучи, не электропроводен, хрупок, плохо проводит тепло, является самым твердым из минералов. За счет sp3 – гибридизации каждый атом в алмазе образует четыре равноценные и прочные ковалентные σ- связи с соседними атомами углерода, что объясняет высочайшую твердость и отсутствие электропроводности в обычных условиях. Графит – мягкое слоистое кристаллическое вещество с гексагональной структурой, серовато-черного цвета, мягкий, жирный на ощупь, с плотностью 2,2 г/см3. Легко царапается ногтем и при трении оставляет черные полосы на бумаге. Хорошо проводит тепло и электрический ток, не пропускает свет, подобно металлам, отражая его своей поверхностью. Атомы углерода в графите расположены в вершинах правильных шестиугольников, расположенных в параллельных слоях. Расстояние между соседними слоями (93,4 Аº) больше, чем расстояние между атомами углерода в плоскости (1,415 Аº), вследствие чего связь между атомами в слоях гораздо прочнее, чем связь между атомами в различных слоях. sp2 – гибридное состояние «слоевых» атомов стабилизируется делокализованной π-связью, образованной оставшимися валентными электронами. Карбин – черный мелкокристаллический порошок с плотностью 1,9 – 2 г/см3, обладает полупроводниковыми свойствами (ΔЕ ≈ 1 эВ). Под действием света его полупроводниковые свойства значительно возрастают. Решетка карбина гексагональная, построена из прямолинейных цепочек Сn двух типов - различают α-карбин (−С ≡ С−С ≡ С−) и β-карбин (=С=С=С=С=). Фуллерены – эта аллотропная модификация углерода обнаружена в конце ХХ в. Шарообразные С60 или дынеобразные С70 полые молекулы, поверхность которых состоит из пяти- и шестиугольников из атомов углерода
Кремний. По распространенности на Земле кремний (20 ат.%) уступает только кислороду, но содержится в основном в виде кислородных соединений. Земная кора более чем на половину состоит из кремнезема SiO2, силикатных и алюмосиликатных пород. В связи с тем, что наиболее характерным типом гибридизации валентных орбиталей атома кремния является sp3-гибридизация, то наиболее устойчивой будет алмазоподобная (кубическая) модификация. Она тугоплавка, отличается высокой твердостью, но уступает по этим свойствам алмазу. Из-за частичной делокализации связи эта модификация имеет темно-серый цвет и металлический вид. При комнатной температуре кремний - полупроводник (ΔЕ ≈ 1,12 эВ).
Гексагональная (графитоподобная) модификация кремния неустойчива. В парах углерод и кремний содержат двухатомные молекулы, которые при охлаждении разрушаются и переходят в твердую фазу с алмазоподобной структурой.
Германий – тугоплавкое твердое вещество серебристо-белого цвета, по внешнему виду очень похож на металл, но имеет алмазоподобную решетку, поэтому очень хрупкий. Германий обладает высоким удельным сопротивлением, которое уменьшается при увеличении температуры.
Олово проявляет полиморфизм. Выше температуры 13,2ºС устойчивой является β- модификация, так называемое «белое» олово (плотность 7,3 г/см3) – серебристо-белый блестящий легкоплавкий металл тетрагональной структуры с октаэдрической координацией атомов. При охлаждении ниже 13,2ºС белое олово переходит в α-модификацию (серое олово) со структурой типа алмаза (ρ = 5,8 г/см3). Этот переход сопровождается увеличением удельного объема на 25,6 %, поэтому олово рассыпается в порошок. При нагревании белого олова выше 161ºС образуется третья модификация олова – γ-форма.
Свинец – темно-серый металл с синеватым оттенком, блести на свежем срезе, легкоплавкий, очень мягкий, ковкий и пластичный. Имеет типичную для металлов структуру гранецентрированного куба. Некоторые свойства простых веществ приведены в таблице. Таким образом, закономерное изменение в строении простых веществ, проявляется в изменении их физических свойств – в ряду Ge – Sn – Pb усиливаются металлические свойства простых веществ.
Бланк ответов
Содержание модуля. Карбиды С менее электроотрицательными элементами углерод дает соединения, которые называют карбидами. Их можно разделить на 3 группы. Ионно-ковалентные карбиды (солеподобные) – к ним относят метаниды и ацетилениды. Метаниды можно рассматривать как производные метана, содержащие ион С−4, например карбид бериллия Be2C или карбид алюминия Al4C3, тугоплавкие кристаллические вещества, которые реагируют с разбавленными кислотами с выделением метана: Al4C3 + 12HCl = 4AlCl3 + 3CH4↑. Ацетилениды являются производными ацетилена состава М+12 С2, М+2С2 и М+32 (С2)3, содержат ион С2−2 (где М – это s- и d-металлы I и II группы периодической системы или Al+3). Ацетилениды детонируют даже в сухом виде, разлагаются водой и разбавленными кислотами: CaC2 + 2H2O = Ca(OH)2 + C2H2 . Солеподобные карбиды получают при взаимодействии оксидов металлов с графитом при высокой температуре: CaO + 3C = CaC2 + CO↑; 2 Al2O3 +9C = Al4C3 + 6CO. Ацетилениды можно получить обменным взаимодействием ацетилена с солью соответствующего металла. Металлоподобные карбиды – это карбиды d-металлов IV – VIII групп нестехиометрического состава, который изменяется в широких пределах; проявляют металлические свойства: металлический блеск, высокую твердость, высокие температуры плавления. Карбиды титана, ванадия, ниобия, молибдена и вольфрама характеризуются еще и высокой коррозионной устойчивостью. Металлоподобные карбиды получают непосредственным взаимодействием металлов или их оксидов с углеродом в электропечах при высокой температуре: 3Fe + C = Fe3C; V2O5 + 7C = 2VC + 5CO. Карбиды состава M3C (где металл имеет небольшой радиус) термически и химически менее устойчивы, например, разлагаются разбавленными кислотами, выделяя смесь углеводородов с достаточно длинными цепями. Ковалентные карбиды с атомной кристаллической решеткой – B4C и SiC – продукты частичного замещения атомов углерода в структуре алмаза на атомы бора или кремния. Карбид бора очень тверд, царапает алмаз, химически достаточно инертен. Карборунд по твердости близок к алмазу, но более хрупок, химически стоек и окисляется кислородом только при температуре свыше 1000ºС. При сплавлении со щелочью в присутствии кислорода карборунд разрушается с образованием карбоната и силиката. SiC растворяется только в смеси концентрированных плавиковой и азотной кислот, в царской водке. Такие карбиды получают в электропечах при очень высокой температуре из смесей соответственно SiO2 или B2O3 с коксом, графитом или сажей. Применение. Металлические карбиды придают сталям и чугунам твердость, износоустойчивость. Карбиды вольфрама и тантала используют для изготовления режущих инструментов и получения сверхтвердых сплавов. Карборунд используют как абразивный материал, как компонент огнеупорных материалов, в качестве стержней сопротивления в электронагревательных приборах.
Силициды Силициды формально можно рассматривать как продукты замещения водорода в соответствующих гидридах кремния на атомы других элементов.
Ионно-ковалентный тип связи существует в силицидах, образованных щелочными и щелочно-земельными металлами и d-металлами I и II групп, например Ca2Si, CaSi, CaSi2. Такие солеподобные силициды химически неустойчивы, разлагаются водой, щелочами и особенно кислотами; являются проводниками: Na2Si + 4H2O = Na2H2SiO4 + 3H2↑; Ca2Si + (6+ n)H2O = 2Ca(OH)2 + SiO2 ∙ n H2O + 4H2↑; Mg2Si + 2H2SO4 = 2MgSO4 + SiH4↑. Такие силициды получают при сплавлении металлов или гидридов металлов с кремнием; либо восстановлением оксидов металлов кремнием или углеродом в присутствии диоксида кремния (при высоких температурах): 2Ca + Si = Ca2Si; CaH2 + Si = Ca2Si + 2H2; 2CaO + 2Si = Ca2Si + SiO2; 2CaO +SiO2 +2C = Ca2Si + 2CO↑. Металлоподобные силициды, образованые d- и f-металлами, имеют сложный, часто нестехиометрический состав (например, Mo3Si, Mo5Si3, MoSi, MoSi2), являются как полупроводниками, так и сверхпроводниками. В воде и разбавленных кислотах они не растворяются, многие не окисляются кислородом даже при высоких температурах. Силициды с высоким содержанием кремния устойчивы к действию всех кислот, даже плавиковой и царской водки, но будут растворяться в растворах щелочей и в смеси HF + HNO3. Большинство силицидов d- и f-металлов обладают высокой твердостью и тугоплавкостью. Такие свойства обусловливают применение металлоподобных силицидов для получения кислотоупорных и жаростойких сплавов; в качестве высокотемпературных полупроводниковых материалов. Некоторые силициды f-элементов используют как поглотители нейтронов в атомной энергетике.
Бланк ответов
Содержание модуля. Все элементы подгруппы углерода образуют оксиды с общей формулой ЭО2. СО2 и SiО2 проявляют кислотные свойства, GeО2, SnО2, PbО2 проявляют амфотерные свойства с преобладанием кислотных, причем в подгруппе сверху вниз кислотные свойства ослабевают. Степень окисления (+4) для углерода и кремния очень стабильна, поэтому окислительные свойства соединения проявляют с большим трудом. В подгруппе германия окислительные свойства соединений (+4) усиливаются, в связи с дестабилизацией высшей степени окисления.
Угольная кислота и ее соли Угольная кислота H2CO3 – соединение непрочное, существует только в водных растворах. Большая часть растворенного в воде углекислого газа находится в виде гидратированных молекул CO2, меньшая – образует угольную кислоту. Водные растворы, находящиеся в равновесии с CO2 атмосферы, являются кислыми: [CO2] = 0,04 М и рН ≈ 4. Угольная кислота – двухосновная, относится к слабым электролитам, диссоциирует ступенчато (К1 = 4, 4 ∙ 10−7; К2 = 4, 8 ∙ 10−11). При растворении CO2 в воде устанавливается следующее динамическое равновесие: H2O + CO2 ↔ CO2 ∙ H2O ↔ H2CO3 ↔ H+ + HCO3− ↓↑ H+ + CO32− При нагревании водного раствора углекислого газа растворимость газа понижается, CO2 выделяется из раствора, и равновесие смещается влево. Соли угольной кислоты Будучи двухосновной, угольная кислота образует два ряда солей: средние соли (карбонаты) и кислые (гидрокарбонаты). Большинство солей угольной кислоты бесцветны. Из карбонатов растворимы в воде лишь соли щелочных металлов и аммония. В воде карбонаты подвергаются гидролизу, и поэтому их растворы имеют щелочную реакцию: Na2CO3 + H2O ↔ NaHCO3 + NaOH. Дальнейший гидролиз с образованием угольной кислоты в обычных условиях практически не идет. Растворение в воде гидрокарбонатов также сопровождается гидролизом, но в значительно меньшей степени, и среда создается слабощелочная (рН ≈ 8). Карбонат аммония (NH4)2CO3 отличается большой летучестью при повышенной и даже обычной температуре, особенно в присутствии паров воды, которые вызывают сильный гидролиз Сильные кислоты и даже слабая уксусная кислота вытесняют из карбонатов угольную кислоту: K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑. В отличие от большинства карбонатов, все гидрокарбонаты в воде растворимы. Они менее устойчивы, чем карбонаты тех же металлов и при нагревании легко разлагаются, превращаясь в соответствующие карбонаты: 2KHCO3 = K2CO3 + H2O + CO2↑; Ca(HCO3)2 = CaCO3 + H2O + CO2↑. Сильными кислотами гидрокарбонаты разлагаются, как и карбонаты: KHCO3 + H2SO4 = KHSO4 + H2O + CO2 Из солей угольной кислоты наибольшее значение имеют: карбонат натрия (сода), карбонат калия (поташ), карбонат кальция (мел, мрамор, известняк), гидрокарбонат натрия (питьевая сода) и основной карбонат меди (CuOH)2CO3 (малахит). Основные соли угольной кислоты в воде практически нерастворимы и при нагревании легко разлагаются: (CuOH)2CO3 = 2CuO + CO2 + H2O. Вообще термическая устойчивость карбонатов зависит от поляризационных свойств ионов, входящих в состав карбоната. Чем больше поляризующее действие оказывает катион на карбонат-ион, тем ниже температура разложения соли. Если катион способен легко деформироваться, то карбонат-ион сам также будет оказывать поляризующее действие на катион, что приведет к резкому снижению температуры разложения соли. Карбонаты натрия и калия плавятся без разложения, а большинство остальных карбонатов при нагревании разлагаются на оксид металла и углекислый газ. MgCO3 = MgO + CO2. 3.2 Проектное задание: Укажите способы получения: оксида углерода (IV), солей угольной кислоты. Напишите уравнения процессов, происходящих при нагревании карбонатов. Тест содержит 6 заданий, на выполнение которых отводится 5 минут. Выберите наиболее правильный, по Вашему мнению, вариант ответа и отметьте его в бланке ответов любым значком (правильных ответов может быть несколько!)
Бланк ответов
Содержание модуля. Диоксид кремния SiO2 – бесцветное твердое вещество, с температурой плавления 1713ºС, нерастворимое в воде. SiO2 образует три стабильные кристаллические модификации: кварц, тридимит и кристобаллит. Стишовит и коусит являются метастабильными, но при обычных условиях могут существовать неограниченно долго. Различные модификации SiO2 отличаются расположением тетраэдров SiO4 в пространстве, поэтому различные кристаллические модификации SiO2 и безводный аморфный кремнезем представляют собой неорганические гетероцепные полимеры. β-Кристобаллит имеет кубическую решетку, β-тридимит – гексагональную, а структура стишовита образована из кремнекислородных октаэдров. Химическая активность модификаций возрастает от кварца к кристобаллиту и особенно кремнезему, полученному обезвоживанием геля кремниевой кислоты. Фтор, фтористый водород и плавиковая кислота энергично взаимодействуют с диоксидом кремния: SiO2 + 2F2 = SiF4 + O2; SiO2 + 4HF = SiF4 + 2H2O. В воде SiO2 практически нерастворим. Не реагирует он с кислотами (кроме плавиковой) и царской водкой. В щелочных растворах, особенно при нагревании, SiO2 легко растворяется, проявляя свою кислотную природу: SiO2 + 4NaOH = Na4SiO4 + 2H2O Диоксид кремния хорошо сплавляется со щелочами, оксидами металлов и карбонатами: SiO2 + PbO = PbSiO3; SiO2 + Na2CO3 = Na2SiO3 + CO2. Строение оксосиликатов Структурной единицей оксосиликатов, как и SiO2, является тетраэдрическая группировка атомовSiO4. Два соседних кремнекислородных тетраэдра SiO4 соединены друг с другом только через один атом кислорода. Если в кристаллах SiO2 каждый SiO4–тетраэдр дает на образование связей Si-O-Si четыре вершины (см. рисунок), то в оксосиликатах SiO4–тетраэдры на связь Si-O-Si могут давать три, две или одну вершину:
O− O− O− │ │ │ — O − Si − O− — O − Si − O — — O − Si − O — │ │ │ O− O− O │
Этим объясняется большое разнообразие возможных способов сочетаний друг с другом SiO4–тетраэдров; структур и типов оксосиликатов. Тетраэдры SiO4 могут объединяться попарно (Si2O76−), в замкнутые кольца из трех (Si3O96−), четырех (Si4O128−), шести (Si6O1812−) тетраэдров (рис. 2).
Рис.2 Кремнекислородные тетраэдры в силикатах с островными структурами
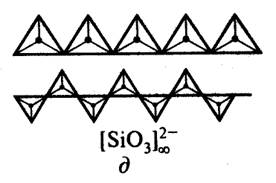
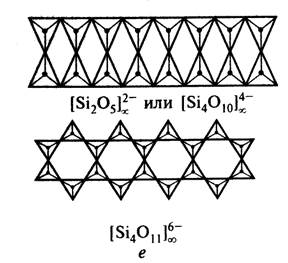
Эти относительно простые структурные единицы в свою очередь могут объединяться в полимерные цепочки, ленты, сетки (рис. 3).
Рис.3 Кремнекислородные тетраэдры в силикатах с цепочечными (д), ленточными (е) и слоистыми (ж) структурами
Простейшая формула такого аниона рассчитывается по числу атомов, приходящихся на одно повторяющееся в полимере звено: SiO32−, Si4O116−, Si2O52−. Цепной оксосиликатный анион состава (SiO32−)n содержат так называемые пироксены. Примерами последних являются энстатит Mg[SiO3], диопсид CaMg[SiO3]2 и сподумен LiAl[SiO3]2. Ленточные анионы состава (Si4O116−)n содержат так называемые амфиболы. Типичным представителем амфиболов является минерал тремолит Ca2Mg[Si4O11]2 (OH)2. Слоистые оксосиликатные анионы имеют состав (Si2O52−)n. Цепи, ленты и слои связаны между собой расположенными между ними катионами. В зависимости от типа оксосиликатных анионов силикаты имеют волокнистую (типа асбеста), слоистую (типа слюды), а SiO2 – координационную структуру. В оксосиликатах и SiO2, а также в кремнийорганических соединениях валентный угол SiOSi изменяется от 131 до 180º, т.е. ближе к 180, чем к 90º. Этот факт дает основание считать, что атом кислорода находится в состоянии sp -гибридизации. Стабилизация этого состояния и выпрямление угла обусловлены π-связыванием за счет 2 p -электронов кислорода и 3 d -орбиталей атома кремния.
Синтетические силикаты Силикаты щелочных металлов, полученные в результате сплавления кремнезема со щелочами, представляют собой стеклообразную массу и вследствие их растворимости в воде называются растворимым стеклом. В промышленности силикат натрия Na2SiO3 получают сплавлением песка с содой или со смесью сульфата натрия и угля: Na2CO3 + SiO2 = Na2SiO3 + CO2 ↑ 2Na2SO4 + 2SiO2 + C = Na2SiO3 + 2SO2 ↑ + CO2 ↑ Растворимое стекло в виде водных растворов, называемых жидким стеклом, применяется для пропитки тканей и дерева (придает им огнеупорность), приготовления огнезащитных красок по дереву, как клеящий материал и т.д. Обыкновенное стекло (оконное) изготовляют путем сплавления кремнезема (белого песка) с известняком и содой: Na2CO3 + CaCO3 + 6SiO2 = Na2O∙CaO∙6SiO2 + CO2 ↑ Варят стекло в специальных печах при t ≈ 1400°С. Переход горячего жидкого стекла в твердое состояние происходит постепенно. Это дает возможность выдувать из стекла различные изделия (бутыли, стеклянные банки, стаканы и т.д.). В зависимости от химического состава шихты получают стекла, отвечающие определенным требованиям. Так, при замене соды Na2CO3 поташом К2CO3 получают тугоплавкое стекло. Его применяют для изготовления химической посуды и химических приборов. Хрустальное стекло содержит оксид свинца PbO. Такое стекло обладает высоким коэффициентом преломления и применяется для изготовления художественной посуды. Стекло с преимущественным содержанием бора, алюминия, мышьяка и калия называют пирекс и применяют для изготовления высококачественной химической посуды. Весьма ценными свойствами обладает кварцевое стекло, получаемое плавлением кварца SiO2 в электрических печах при температуре ≈ 1 755°С. Незначительный коэффициент теплового расширения делает его нечувствительным к резким изменением температур. Например, раскаленное докрасна кварцевое стекло можно опустить в воду и оно не растрескается. Кварцевое стекло хорошо пропускает ультрафиолетовые и инфракрасные лучи (обычное стекло пропускает лишь около 1% ультрафиолетовых лучей). На этом свойстве основано применение кварцевого стекла для изготовления ртутных ламп, используемых в медицине в качестве источников ультрафиолетовых лучей. Цветные стекла получают введением в шихту при плавлении различных добавок. Так, добавление CoO придает стеклу синюю окраску, Cu2O – красную, Cr2O3 – ярко-зеленую; небольшое количество серебра в стекле придает ему желтую окраску, а золота – ярко-красную (рубиновое стекло). В настоящее время на основании обычного стекла получают различные технические материалы: стеклянную вату, пеностекло (строительное пористое стекло с плотностью 0, 2 – 0, 5 г/см3) с низкой звукопроводимостью и хорошими теплоизоляционными свойствами; сверхпрочное стекло, особым образом закаленное (сталинит) и высокопрочную стеклянную ткань, используемую для изготовления спецодежды. Таким образом, производство стекол сводится к получению различных силикатов. Стекольное производство является лишь частью силикатной промышленности. К природным силикатам относятся полевые шпаты, слюды, глины и др. Ниже приводится химический состав некоторых из них: Ортоклаз K2O∙Al2O3∙6SiO2; Слюда K2O∙3Al2O3∙6SiO2∙2H2O; Каолин (белая глина) Al2O3∙2SiO2∙2H2O; Асбест 3MgO∙CaO∙4SiO2. Чаще всего в природе встречаются силикаты, содержащие алюминий, алюмосиликаты (слюда, ортоклаз, глина и др.). Из природных силикатов большое практическое значение и применение имеют природные глины, являющиеся сырьем для производства керамических изделий и цемента. Различают изделия грубой и тонкой керамики. К грубой керамике относятся: строительные кирпичи, гончарные, кислотоупорные и огнеупорные изделия, дренажные трубы, кровельная черепица, облицовочные плитки, к тонкой керамике – фарфоровые и фаянсовые изделия. Изделия грубой керамики готовят из дешевых глин, в которых кроме каолина (Al2O3∙2SiO2∙2H2O) присутствует значительное количество примесей. Глину обжигают при относительно низкой температуре (не выше 1000°С). Изделия тонкой керамики (фарфоровые и фаянсовые) формируют из чистого каолина; обжиг производят при 1200-1400°С. Для производства цемента смесь глины с известняком в определенных количественных соотношениях обжигают в специальных печах при температурах 1400-1500°С. Полученную спекшуюся массу размалывают в тонкий порошок – цемент. По составу цемент – сложный силикат, состоящий в основном из оксидов кальция, алюминия, железа и кремния. Ценным свойством цемента является его способность при замешивании с песком и с водой образовывать камневидную массу, обладающую большой механической прочностью. Из цемента, песка, щебня, гравия, воды и некоторых других добавок получают важный строительный материал – бетон. Он хорошо сцепляется с железом, образуя прочную массу. Бетон, армированный железом, называют железобетоном. 4.2 Проектное задание. Описать химические свойства диоксида кремния, кремниевых кислот и их солей; привести уравнения реакций получения кремниевых кислот; объяснить, что является сырьем для производства стекла и цемента. Тест рубежного контроля Тест содержит 6 заданий, на выполнение которых отводится 5 минут. Выберите наиболее правильный, по Вашему мнению, вариант ответа и отметьте его в бланке ответов любым значком (правильных ответов может быть несколько!)
Бланк ответов
Содержание модуля Диоксиды германия и оло
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 364; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.130.58 (0.012 с.) |