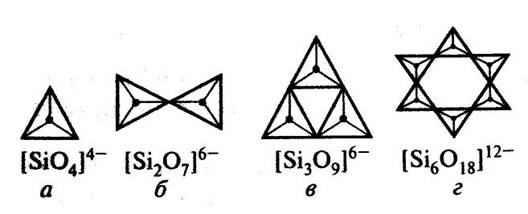Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модуль 4. Диоксид кремния, кремниевые кислоты и их солиСодержание книги
Поиск на нашем сайте
Комплексная цель модуля: знать способы получения оксида и гидроксида углерода (IV); описывать их физические свойства; знать характеристику кислотно-основных свойств; давать характеристику окислительно-восстановительных свойств. Содержание модуля. Диоксид кремния SiO2 – бесцветное твердое вещество, с температурой плавления 1713ºС, нерастворимое в воде. SiO2 образует три стабильные кристаллические модификации: кварц, тридимит и кристобаллит. Стишовит и коусит являются метастабильными, но при обычных условиях могут существовать неограниченно долго. Различные модификации SiO2 отличаются расположением тетраэдров SiO4 в пространстве, поэтому различные кристаллические модификации SiO2 и безводный аморфный кремнезем представляют собой неорганические гетероцепные полимеры. β-Кристобаллит имеет кубическую решетку, β-тридимит – гексагональную, а структура стишовита образована из кремнекислородных октаэдров. Химическая активность модификаций возрастает от кварца к кристобаллиту и особенно кремнезему, полученному обезвоживанием геля кремниевой кислоты. Фтор, фтористый водород и плавиковая кислота энергично взаимодействуют с диоксидом кремния: SiO2 + 2F2 = SiF4 + O2; SiO2 + 4HF = SiF4 + 2H2O. В воде SiO2 практически нерастворим. Не реагирует он с кислотами (кроме плавиковой) и царской водкой. В щелочных растворах, особенно при нагревании, SiO2 легко растворяется, проявляя свою кислотную природу: SiO2 + 4NaOH = Na4SiO4 + 2H2O Диоксид кремния хорошо сплавляется со щелочами, оксидами металлов и карбонатами: SiO2 + PbO = PbSiO3; SiO2 + Na2CO3 = Na2SiO3 + CO2. Кремниевые кислоты и их соли Поскольку кремниевый ангидрид не растворим в воде, кремневую кислоту получают косвенным путем – действием минеральных кислот на растворы силикатов или гидролизом галогенидов, сульфидов и некоторых других соединений кремния. В растворах существует несколько форм кремниевых кислот, их достаточно трудно разделить. Ортокремниевая кислота H4SiO4 хорошо растворима в воде, существует только в очень разбавленных растворах. Растворы кремниевой кислоты очень неустойчивы во времени, проявляется большая склонность к полимеризации, сопровождающейся поликонденсацией: OH OH │ │ HO─Si─OH + HO─Si─OH → (HO)3─Si─O─Si─(OH)3 + H2O │ │ OH OH
Сначала получаются линейные, затем разветвленные, слоистые и смешанные, наконец - трехмерные структуры. При полимеризации кремниевой кислоты образуются очень крупные частицы, имеющие диаметр в сотни ангстрем. Золи кремниевой кислоты самопроизвольно переходят в гели, «застудневают». Степень полимеризации кремниевой кислоты резко возрастает с увеличением кислотности, поэтому даже небольшая концентрация ионов водорода вызывает осаждение кислоты из силикатных растворов. Так, если к раствору силиката натрия Na2SiO3 приливать соляную кислоту, то в зависимости от концентрации взятых растворов, образующаяся кремниевая кислота выделяется из раствора в виде студенистого осадка (иногда весь раствор превращается в студнеобразную массу) или остается в растворе в коллоидном состоянии: х Na2SiO3 + 2 х HCl → 2х NaCl + x SiO3 ∙ y H2O↓ + (х-у)Н2О. Кислоты состава x SiO3 ∙ y H2O со значением x>1 называются поликремневыми. Простейшей поликремневой кислотой является двуметакремневая кислота Н2Si2O5 или 2SiO2∙H2O. При x=1, y=2 – ортокремневая кислота H4SiO4 или SiO3∙2H2O. Выделить каждую из кислот в отдельности не удается, вследствие их нестойкости. Формулы кремневых кислот были выведены на основе состава природных солей. Например, тальку Mg3H2Si4O12 соответствует поликремневая кислота H8Si4O12 или 4Si2O∙4H2O. Все кремневые кислоты – очень слабые. Поэтому их соли в растворах подвергаются сильному гидролизу. Водные растворы силикатов щелочных металлов вследствие сильного гидролиза имеют щелочную реакцию: 2Na2SiO3 + H2O ↔ Na2Si2O5 + 2 NaOH SiO32− + H2O ↔ HSiO3− + OH−; 2HSiO3− ↔ Si2O52− + H2O Уравнения реакций записаны в упрощенном виде, SiO32− не существует. Кремневая кислота x SiO3 ∙ y H2O содержит большое количество воды. При нагревании она постепенно теряет воду, а при прокаливании превращается в диоксид кремния.
Строение оксосиликатов Структурной единицей оксосиликатов, как и SiO2, является тетраэдрическая группировка атомовSiO4. Два соседних кремнекислородных тетраэдра SiO4 соединены друг с другом только через один атом кислорода. Если в кристаллах SiO2 каждый SiO4–тетраэдр дает на образование связей Si-O-Si четыре вершины (см. рисунок), то в оксосиликатах SiO4–тетраэдры на связь Si-O-Si могут давать три, две или одну вершину:
O− O− O− │ │ │ — O − Si − O− — O − Si − O — — O − Si − O — │ │ │ O− O− O │
Этим объясняется большое разнообразие возможных способов сочетаний друг с другом SiO4–тетраэдров; структур и типов оксосиликатов. Тетраэдры SiO4 могут объединяться попарно (Si2O76−), в замкнутые кольца из трех (Si3O96−), четырех (Si4O128−), шести (Si6O1812−) тетраэдров (рис. 2).
Рис.2 Кремнекислородные тетраэдры в силикатах с островными структурами
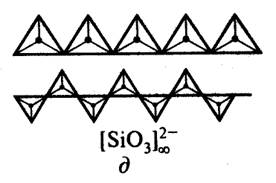
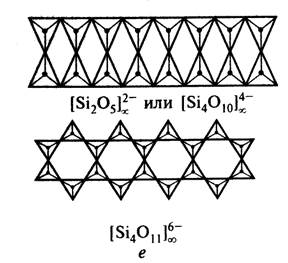
Эти относительно простые структурные единицы в свою очередь могут объединяться в полимерные цепочки, ленты, сетки (рис. 3).
Рис.3 Кремнекислородные тетраэдры в силикатах с цепочечными (д), ленточными (е) и слоистыми (ж) структурами
Простейшая формула такого аниона рассчитывается по числу атомов, приходящихся на одно повторяющееся в полимере звено: SiO32−, Si4O116−, Si2O52−. Цепной оксосиликатный анион состава (SiO32−)n содержат так называемые пироксены. Примерами последних являются энстатит Mg[SiO3], диопсид CaMg[SiO3]2 и сподумен LiAl[SiO3]2. Ленточные анионы состава (Si4O116−)n содержат так называемые амфиболы. Типичным представителем амфиболов является минерал тремолит Ca2Mg[Si4O11]2 (OH)2. Слоистые оксосиликатные анионы имеют состав (Si2O52−)n. Цепи, ленты и слои связаны между собой расположенными между ними катионами. В зависимости от типа оксосиликатных анионов силикаты имеют волокнистую (типа асбеста), слоистую (типа слюды), а SiO2 – координационную структуру. В оксосиликатах и SiO2, а также в кремнийорганических соединениях валентный угол SiOSi изменяется от 131 до 180º, т.е. ближе к 180, чем к 90º. Этот факт дает основание считать, что атом кислорода находится в состоянии sp -гибридизации. Стабилизация этого состояния и выпрямление угла обусловлены π-связыванием за счет 2 p -электронов кислорода и 3 d -орбиталей атома кремния.
Синтетические силикаты Силикаты щелочных металлов, полученные в результате сплавления кремнезема со щелочами, представляют собой стеклообразную массу и вследствие их растворимости в воде называются растворимым стеклом. В промышленности силикат натрия Na2SiO3 получают сплавлением песка с содой или со смесью сульфата натрия и угля: Na2CO3 + SiO2 = Na2SiO3 + CO2 ↑ 2Na2SO4 + 2SiO2 + C = Na2SiO3 + 2SO2 ↑ + CO2 ↑ Растворимое стекло в виде водных растворов, называемых жидким стеклом, применяется для пропитки тканей и дерева (придает им огнеупорность), приготовления огнезащитных красок по дереву, как клеящий материал и т.д. Обыкновенное стекло (оконное) изготовляют путем сплавления кремнезема (белого песка) с известняком и содой: Na2CO3 + CaCO3 + 6SiO2 = Na2O∙CaO∙6SiO2 + CO2 ↑ Варят стекло в специальных печах при t ≈ 1400°С. Переход горячего жидкого стекла в твердое состояние происходит постепенно. Это дает возможность выдувать из стекла различные изделия (бутыли, стеклянные банки, стаканы и т.д.). В зависимости от химического состава шихты получают стекла, отвечающие определенным требованиям. Так, при замене соды Na2CO3 поташом К2CO3 получают тугоплавкое стекло. Его применяют для изготовления химической посуды и химических приборов. Хрустальное стекло содержит оксид свинца PbO. Такое стекло обладает высоким коэффициентом преломления и применяется для изготовления художественной посуды. Стекло с преимущественным содержанием бора, алюминия, мышьяка и калия называют пирекс и применяют для изготовления высококачественной химической посуды. Весьма ценными свойствами обладает кварцевое стекло, получаемое плавлением кварца SiO2 в электрических печах при температуре ≈ 1 755°С. Незначительный коэффициент теплового расширения делает его нечувствительным к резким изменением температур. Например, раскаленное докрасна кварцевое стекло можно опустить в воду и оно не растрескается. Кварцевое стекло хорошо пропускает ультрафиолетовые и инфракрасные лучи (обычное стекло пропускает лишь около 1% ультрафиолетовых лучей). На этом свойстве основано применение кварцевого стекла для изготовления ртутных ламп, используемых в медицине в качестве источников ультрафиолетовых лучей. Цветные стекла получают введением в шихту при плавлении различных добавок. Так, добавление CoO придает стеклу синюю окраску, Cu2O – красную, Cr2O3 – ярко-зеленую; небольшое количество серебра в стекле придает ему желтую окраску, а золота – ярко-красную (рубиновое стекло). В настоящее время на основании обычного стекла получают различные технические материалы: стеклянную вату, пеностекло (строительное пористое стекло с плотностью 0, 2 – 0, 5 г/см3) с низкой звукопроводимостью и хорошими теплоизоляционными свойствами; сверхпрочное стекло, особым образом закаленное (сталинит) и высокопрочную стеклянную ткань, используемую для изготовления спецодежды. Таким образом, производство стекол сводится к получению различных силикатов. Стекольное производство является лишь частью силикатной промышленности. К природным силикатам относятся полевые шпаты, слюды, глины и др. Ниже приводится химический состав некоторых из них: Ортоклаз K2O∙Al2O3∙6SiO2; Слюда K2O∙3Al2O3∙6SiO2∙2H2O; Каолин (белая глина) Al2O3∙2SiO2∙2H2O; Асбест 3MgO∙CaO∙4SiO2. Чаще всего в природе встречаются силикаты, содержащие алюминий, алюмосиликаты (слюда, ортоклаз, глина и др.). Из природных силикатов большое практическое значение и применение имеют природные глины, являющиеся сырьем для производства керамических изделий и цемента. Различают изделия грубой и тонкой керамики. К грубой керамике относятся: строительные кирпичи, гончарные, кислотоупорные и огнеупорные изделия, дренажные трубы, кровельная черепица, облицовочные плитки, к тонкой керамике – фарфоровые и фаянсовые изделия. Изделия грубой керамики готовят из дешевых глин, в которых кроме каолина (Al2O3∙2SiO2∙2H2O) присутствует значительное количество примесей. Глину обжигают при относительно низкой температуре (не выше 1000°С). Изделия тонкой керамики (фарфоровые и фаянсовые) формируют из чистого каолина; обжиг производят при 1200-1400°С. Для производства цемента смесь глины с известняком в определенных количественных соотношениях обжигают в специальных печах при температурах 1400-1500°С. Полученную спекшуюся массу размалывают в тонкий порошок – цемент. По составу цемент – сложный силикат, состоящий в основном из оксидов кальция, алюминия, железа и кремния. Ценным свойством цемента является его способность при замешивании с песком и с водой образовывать камневидную массу, обладающую большой механической прочностью. Из цемента, песка, щебня, гравия, воды и некоторых других добавок получают важный строительный материал – бетон. Он хорошо сцепляется с железом, образуя прочную массу. Бетон, армированный железом, называют железобетоном. 4.2 Проектное задание. Описать химические свойства диоксида кремния, кремниевых кислот и их солей; привести уравнения реакций получения кремниевых кислот; объяснить, что является сырьем для производства стекла и цемента. Тест рубежного контроля Тест содержит 6 заданий, на выполнение которых отводится 5 минут. Выберите наиболее правильный, по Вашему мнению, вариант ответа и отметьте его в бланке ответов любым значком (правильных ответов может быть несколько!)
Бланк ответов
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1292; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.10.152 (0.01 с.) |