
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Далее составляем электронные уравненияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
И, наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Окончательное уравнение реакции будет иметь вид:
Правильность написания уравнения подтверждается подсчетом атомов кислорода: в левой части –2*4 + 3*4 = 20 и в правой –2*4 + 4 +8 = 20. В этом примере имеем дело с межмолекулярной ОВР, так как элемент –восстановитель (S-2) и элемент-окислитель (Mn+7) находятся в разных веществах. Переписываем уравнение в ионно-молекулярной форме: 5H2S + МnOֿ4 +6H+ = 5S +2Mn+2 + 8H2O
Пример 5. К какому типу относятся следующие ОВР:
(NH4)2Cr2O7 ® N2 + Cr2O3 + H2O
При помощи электронных уравнений составьте коэффициенты в этих реакциях. Решение:
Эта внутримолекулярная реакция, так как элемент-окислитель и элемент-восстановитель находятся в молекуле одного вещества.
В этом случае имеет место реакция самоокисления-самовосстановления (диспропорционирования), так как металлы одного и того вещества реагируют друг с другом как окислители как восстановитель. Электрохимические процессы – это окислительно-восстановительные процессы, протекающие под действием электрического тока, или вызывающие его. Количественной характеристикой окислительно-восстановительной способности веществ, находящихся в растворе (или в контакте с ними), служат электродные или окислительно-восстановительные потенциалы. Если пластинку металла поместить в раствор, содержащий ионы этого же металла (например, медную пластинку погрузить в раствор СuSО4), то на границе металла с раствором электролита возникает разность потенциалов, которая и называется электродным потенциалом. Абсолютное значение электродных потенциалов определить нельзя, поэтому находят потенциалы электродов по отношению к какому-то электроду сравнения. Обычно определяют электродные потенциалы по отношению к так называемому нормальному водородному электроду, потенциал которого условно принят равным нулю. Чем больше абсолютное значение положительного потенциала, тем больше окислительная способность иона по отношению к металлу, и наоборот, чем больше абсолютное значение отрицательного потенциала, тем больше восстановительная способность. Окислительно-восстановительный потенциал пары ион-металл зависит не только от их природы, но и от концентрации (активности) раствора и температуры. Эта зависимость выражается уравнением Нернста:
Где j - окислительно-восстановительный потенциал данной пары; j0 – Стандартный электродный потенциал; R – универсальная газовая постоянная, R = 8,31 Дж/(моль *К); Т – абсолютная температура, К; F - число Фарадея, F = 96500 Кл n - число молей электронов, принимаемых при превращении окисленной формы в восстановленную; a окисл и a восст. – активность окисленной и восстановленной формы. Активность является эффективной концентрацией и связана с ней уравнением
Для разбавленных растворов g = 1 и a = C. Подставляя в уравнение Нернста значения констант и переходя от натуральных логарифмов к десятичным, получаем при Т = 298 К:
Если электродный потенциал возникает в результате равновесия между металлом и ионами этого металла в растворе Ме = Ме + nе, то значение его определяется уравнением:
где n - заряд катиона; C -молярная концентрация ионов металла в растворе. Зная электродные потенциалы, можно определить электродвижущую силу (ЭДС) гальванического элемента. Гальваническим элементом называют устройство, в котором энергия химической реакции непосредственно превращается в электрическую (гальванические элементы называют также химическими источниками тока). Гальванический элемент состоит из двух полуэлементов, каждый из которых представляет собой металлический электрод, погруженный в раствор соли того же металла. Полуэлементы соединяются в электрическую цепь с помощью трубки, заполненной токопроводящим раствором (так называемого электролитического или солевого мостика). На рис.1 приведена схема медно-цинкового гальванического элемента ZnêZnSO4êêCuSO4êCu (знак êê в схематической записи гальванического элемента символизирует солевой мостик, а одиночные вертикальные линии символизируют границу металл-раствор).
Рис.1. Гальванический элемент медно-цинковый: 1-стаканчики; 2-подставка; 3-электролитный мостик; 4- рН-метр (иономер); 5-цинковый электрод; 6-медный электрод
Реакция, протекающая на левом электроде, соответствует процессу окисления Zn0 – 2eֿ ® Zn2+ А реакция на правом электроде – процессу восстановления. Cu2+ + 2eֿ ® Cu0 Электрод, на котором происходит окисление, является анодом; электрод, на котором происходит восстановление, является катодом. Суммарная реакция в гальваническом элементе выражается уравнением: Zn + Cu2+ = Zn2+ + Cu ЭДС гальванического элемента представляет собой разность электродных потенциалов окислителя и восстановителя, т.е. равна разности электродных потенциалов катода и анода. По значениям стандартных электродных потенциалов можно рассчитать стандартную ЭДС элемента:
Е0 = jокатод - jоанод = jоCu2+/Cu - jоZn2+/Zn = 0,34-(-0,76) = +1,1(B)
Гальванический элемент может быть составлен не только из электродов, изготовленных из разных металлов и погруженных в растворы, содержащие одноименные с ними ионы, но и из одинаковых электродов, погруженных в растворы одного и того же электролита с различной концентрацией ионов. Такой гальванический элемент называется концентрационным. ЭДС концентрационного элемента также равна разности электродных потенциалов, составляющих его электродов. Применительно к концентрационному гальваническому элементу значение n и jо в уравнении Нернста для обоих электродов одинаковы. Следовательно, ЭДС такого элемента может быть определена по формуле:
Металлы, применяемые в технике, почти всегда имеют примеси других металлов. При соприкосновении с раствором электролита система из двух металлов образует ряд непрерывно действующих гальванических микроэлементов. Работа этих элементов приводит к электрохимической коррозии – процессу разрушения металла в среде электролита, сопровождающемуся возникновением внутри системы электрического тока. Более активный металл посылает в раствор свои ионы, т.е. растворяется (анодное окисление). Менее активный металл выполняет роль катода, на нём идёт процесс восстановления. Электролизом называется совокупность окислительно-восстановительных процессов, которые протекают при пропускании постоянного электрического тока через раствор или расплав электролита. Под влиянием электрического тока движение ионов становится направленным: отрицательные анионы перемещаются к положительно поляризованному аноду, а положительные катионы - к катоду, который соединён с отрицательным полюсом источника питания. На катоде идёт процесс восстановления, а на аноде - окисления. В первую очередь на катоде идёт процесс восстановления того окислителя, величина которого имеет наибольшее значение электродного потенциала. Так, при электролизе кислого водного раствора соли меди возможно восстановление как иона меди: Cu2+ + 2eֿ ® Cu0, jо1 = +0,34 В, так и иона водорода: 2Н+ + 2еֿ ® Н2, jо2 = 0 В, но т. к. jо1 > jо2, то на катоде будет выделяться, именно медь. Т.е. в первую очередь на катоде идёт процесс восстановления ионов металлов, стоящих после водорода в ряду напряжений. Ионы металлов, стоящие в ряду напряжений между водородом и марганцем восстанавливаются одновременно с молекулами Н2О: 2Н2О + 2еֿ = Н2 + 2ОНֿ, jо = -0,83 В. На катоде не восстанавливаются ионы металлов, стоящие в ряду напряжений от начала до алюминия, вследствие низкого значения электродного потенциала. Вместо них восстанавливаются молекулы воды. В случае расплава электролита, идет процесс восстановления на катоде любого металла при соответствующем напряжении и условиях. На аноде в первую очередь будет идти процесс окисления того восстановителя, величина потенциала которого имеет наименьшее значение. Так, при электролизе водного раствора сульфата меди с инертными электродами (угольными) на аноде возможно окисление как сульфат иона: 2SO2־4 = S2О2־8 + 2еֿ, jо1 = +2,01 В, так и молекул воды: 2Н2О = О2+ 4Н+ + 4еֿ, jо2= +1,23 В. Но поскольку jо2 << jо1, то будет осуществляться процесс окисления воды с выделением кислорода, а в растворе пойдет вторичный процесс – образование кислоты: 2Н+ + SO2-4 = H2SO4. Но если инертный анод заменить растворимым - медным, то становится возможным протекание еще одного процесса – анодного процесса – растворения меди: Cu = Cu2+ + 2eֿ, jо3 = +0,34 В. Величина потенциала этого процесса имеет более низкое значение (jо3 << jо2, jо3 << jо1), поэтому на аноде будет происходить именно окисление меди. Количественно процессы электролиза оцениваются законами Фарадея: масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ. Закон выражается уравнением
где m - масса образовавшегося или подвергшегося превращению вещества; М - мольная масса этого вещества; n - число молей электронов, участвующих в процессе образования 1 моля вещества; I - сила тока, А; t - время электролиза, с; F - постоянная Фарадея, (96500 Kл/моль); Э - эквивалентная масса вещества;
Для вычисления объема выделяющегося газа (V) уравнение имеет вид:
где Vэ = При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода 5,6 л/моль. Выходом по току называют ту долю от общего количества электричества (Q = I*t), которая расходуется на данную электродную реакцию или отношение массы выделившегося вещества mпракт к теоретически возможной mтеор по уравнению Фарадея
Задачи 101. Укажите, какие из указанных веществ могут проявлять только окислительные свойства, только восстановительные свойства, проявляют окислительно-восстановительную двойственность: а) MnO2, KMnO4, P2O5, Na2S; б) K2SO3, HNO3, H2S, NO2; 102. - 105 Закончить уравнения реакций, записать их в ионно-молекулярной форме. Расставить коэффициенты методом полуреакций. 102. F e S О4 + О2 + H2О = 103. P + K M n О4 + H 2 0 = К Н 2 Р 0 4 + К 2 Н Р 0 4 +… 104. M n (N 0 3) 2 + N a B i 0 3+HN03 = HMn04 + 105. Na CI 0 3 + Н2 S = Н2 S 0 4 + 106. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом — анодом. Написать уравнения реакций, происходящих при работе этих элементов, и вычислить значения стандартных э. д. с. 107. Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgN03, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с? 108. Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 моль/л 109. Можно ли составить такой гальванический элемент, во внешней цепи которого электроны перемещались бы от электрода с более положительным стандартным потенциалом к электроду с более отрицательным стандартным потенциалом? Дать объяснение. 110. Составить уравнения процессов, протекающих при электролизе расплавов NaOH и Ni С1г с инертными электродами. 111. Написать уравнения электродных процессов, протекающих при электролизе водных растворов FeCl3 и Са(Г\Г.Оз)2 с инертным анодом. 112. Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный. 113. Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный. 114. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди? 115. Составить схему процессов, происходящих на медных электродах при электролизе водного раствора KN03. 116. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин. 117. Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А? 118. Как электролитически получить LiOH из соли лития? Какое количество электричества необходимо для получения 1 т LiOH? Составить схемы электродных процессов. 119. Найти объем кислорода (условия нормальные), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН. 120. Найти объем водорода (условия нормальные), который выделится при пропускании тока силой в 3 А в течение 1 ч через водный раствор H2SO4.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 788; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.118.36 (0.012 с.) |


 Восстановитель S־2 - 2еֿ S0 5 процесс окисления
Восстановитель S־2 - 2еֿ S0 5 процесс окисления Окислитель Mn+7+ 5eֿ MN+2 2 процесс восстановления
Окислитель Mn+7+ 5eֿ MN+2 2 процесс восстановления 5H2S + 2KMnO4 +3H2SO4 3S + 2MnSO4 + K2SO4 + 8H2O
5H2S + 2KMnO4 +3H2SO4 3S + 2MnSO4 + K2SO4 + 8H2O
 K2MnO4 + H2O KMnO4 + MnO2 + КОН
K2MnO4 + H2O KMnO4 + MnO2 + КОН (NH4)2Cr2O7 N2 + Cr2O3 + 4H2O
(NH4)2Cr2O7 N2 + Cr2O3 + 4H2O

 Окислитель Cr+6 + 3eֿ Cr+3 1- процесс восстановления
Окислитель Cr+6 + 3eֿ Cr+3 1- процесс восстановления
 3K2MnO4 + H2O 2KMnO4 + MnO2 + 4КОН
3K2MnO4 + H2O 2KMnO4 + MnO2 + 4КОН
 (1)
(1) (2)
(2) (3)
(3) , (4)
, (4)
 . (5)
. (5) или
или  , (6)
, (6)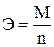 . (7)
. (7) , (8)
, (8) ; Vэ - эквивалентный объем газа.
; Vэ - эквивалентный объем газа. . (9)
. (9)


