
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Смещение химического равновесияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Переход равновесной химической системы из одного состояния равновесия (с одними равновесными концентрациями) в другое (с другими равновесными концентрациями) называется смещением химического равновесия, которое происходит в результате изменения температуры, концентрации, давления. Направление смещения химического равновесия определяется принципом Ле Шателье: Если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в таком направлении, которое ослабит эффект внешнего воздействия. При смещении равновесия, вызванного изменением концентраций и давления, константа равновесия остаётся постоянной, при изменении температуры константа равновесия меняется. Повышение температуры смещает равновесие в сторону эндотермической реакции, понижение — экзотермической. При увеличении концентрации хотя бы одного из исходных веществ равновесие смещается в сторону продуктов реакции, а при добавлении продуктов — в сторону исходных веществ. Повышение давления равновесие смещается в сторону той реакции, которая идёт с уменьшением числа молекул. Изменение давления вызывает смещение равновесия только в реакциях с участием газообразных веществ и притом лишь в тех случаях, где сумма стехиометрических коэффициентов в левой и правой части реакции не равны. Пример 1. Константа равновесия системы H2(г) + I2(г) = 2HI(г) при некоторой температуре равна 40. Определите равновесные концентрации реагирующих веществ, если исходные концентрации этих веществ составляют (в моль/л): [I2] = 0,01; [H2] = 0,03. Решение: Пусть уменьшение концентрации водорода и иода к моменту равновесия будет x. Тогда равновесные концентрации составят (в моль/л): [I2] =(0,01– x); [H2] = (0,03 – x); [HI] = 2x. Константа равновесия данной реакции равна: Кр = [HI]2 / [H2] ∙ [I2] = 40. 40= (2x)2 / (0,01 – x)(0,03 – x) = 4x2 / (x2 – 0,04x + 0,0003). 36x2 – 1,6x + 0,012 = 0. Решение этого уравнения даёт два корня: x1= 0,0349 моль/л и x2= 0,0096моль/л Так как исходная концентрация иода равна 0,01 моль/л, уменьшение концентрации не может превышать эту величину и, следовательно, решением задачи будет x2= 0,0096моль/л. Тогда равновесные концентрации реагирующих веществ будут равны (в моль/л): [[H2]р = 0,01 – 0,0096 = 0,0004; [I2]р = 0,03 – 0,0096 = 0,0204; [HI]р = 2∙0,0096 = 0,0192. Пример 2. Химическое равновесие реакции СО2(г) + Н2(г) =СО(г)+Н2О(г) установилось при следующих концентрациях реагирующих веществ (моль/л):[CO2] = 7,0; [H2] = 5,0; [CO] = 10; [H2O] = 14. Равновесие системы было нарушено вследствие уменьшения концентрации Н2О до 11 моль/л. Рассчитайте равновесные концентрации реагирующих веществ после сдвига равновесия. Решение. Уменьшение концентрации Н2О показывает, что равновесие сместилось в сторону прямой реакции. Таким образом, концентрация СО2 и Н2 уменьшилась, а концентрация СО и Н2О увеличилась. Пусть изменение концентрации реагирующих веществ будет х моль/л. Тогда новые равновесные концентрации после смещения равновесия будут равны (в моль/л): [CO2] = (7–x); [H2] = (5–x); [CO] = (10 + x); [H2O] = (11 + x). Константа равновесия данной реакции равна: Кс = [CO] [H2O] / [CO2][H2] = 10 · 14 / 7 · 5 = 4,0. 4 = (10 +x) (11 +x) / (7 – x)(5 – x) = (110 + 21x + x2) / (35 – 12x + x2). x2 – 23x +10 = 0; x1 = 22,56; x2 = 0,44. Реальное значение имеет второй корень. Следовательно, х = 0,44моль/л. Новые равновесные концентрации: [CO2] = 7,0 – 0,44 = 6,56 моль/л; [H2] = 5,0 – 0,44 = 4,56 моль/л; [CO] = 10,0 + 0,44 = 10,44 моль/л; [H2O] = 11,0 + 0,44 = 11,44 моль/л. Упражнения и задачи для самостоятельного решения
1. Напишите выражения констант химического равновесия Кс следующих обратимых реакций (V = const. Т = const) а)N2(г) + 3H2(г) = 2NH3(г) б)C(тв)+ CO2(г) =2CO(г) в)4HCl(г) +O2(г) = 2H2O(г) + 2Cl2(г) г)2NO2(г) =2NO(г) +O2(г) 2. В каком направлении смещено равновесие в реакции Н2(г)+ J2(г)= 2HJ(г), если при некоторой температуре константа равновесия Кс>1? Ответ: вправо; в сторону увеличения равновесной концентрации HI. 3. С ростом температуры равновесие в реакции N2(г) + O2(г)= 2NO(г) сдвигаетсяв сторону прямой реакции. Сделайте вывод о знаке энтальпии реакции. Ответ: ∆Нр-ции >0 4. При некоторой температуре константа равновесия реакции А=В равна 4. Как изменится константа равновесия реакции, если концентрацию вещества А увеличить в 10 раз? Ответ: не изменится 5. При температуре 298К константа равновесия реакции А=В равна 4×10-4, а при температуре 1000К равна 5×10-6. Экзотермическая или эндотермическая эта реакция? Ответ: экзотермическая 6. Как повлияет повышение давления на состояние равновесия системы: СН4(г) = С(тв) + 2Н2(г)? Ответ: равновесие сместится влево. 7. Как повлияет понижение температуры на величину константы равновесия реакции N2(г)+ ЗН2(г)=2 NH3(г), если стандартная энтальпия реакции –92,4кДж. Ответ: Величина константы равновесия увеличится. 8. Исходные концентрации СО и Н2О соответственно равны 0,08 моль/л, а СО2 и Н2 — 0 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе СО(г)+ Н20(г)= СО2(г)+ Н2(г), если равновесная концентрация СО2 оказалась равной 0,05моль/л. Ответ: [CO] = 0,03 моль/л; [H2O] = 0,03 моль/л; [H2] = 0,05 моль/л. 9. Равновесие реакции 4HCl(г) + 02(г)= 2H2O(г)+ 2Cl2(г) установилось при следующих концентрациях реагирующих веществ (в моль/л): [Н2О] = [Cl2 ] = 0.4; [HCl] = [О2] = 0.2. Вычислите константу равновесия Кс и исходную концентрацию кислорода в реакционной смеси. Ответ: Кс = 200; [O2]исх = 0,6 моль/л. РАСТВОРЫ
Основные понятия. Образование растворов
Растворами называются однородные системы, состоящие из двух и более компонентов, состав которых можно изменять в определённых пределах без нарушения однородности. Растворы бывают газовые, жидкие и твёрдые. В химии, биологии и медицине чаще всего приходится иметь дело с жидкими растворами. В жидких растворах принято различать растворитель и растворённое вещество. Растворителем называют (чаще всего) тот компонент раствора, которого больше, либо тот компонент, который не меняет своего агрегатного состояния при растворении. Причина образования истинного раствора ― уменьшение энергии Гиббса в результате взаимодействия компонентов раствора ΔGрастворения < 0. При внесении растворяемого вещества в растворитель процесс растворения идёт самопроизвольно (ΔGрастворения < 0) и раствор остаётся ненасыщенным. Когда энтальпийный и энтропийный факторы процесса станут одинаковыми, т.е. ΔGрастворения = 0, система окажется в состоянии истинного равновесия. Раствор становится насыщенным. Таким образом, раствор — это равновесная однородная система, которая достигла минимума энергии Гиббса в результате взаимодействия всех её частиц за счёт всех возможных типов взаимодействия между ними. Можно получить и пересыщенный раствор, т.е. такой, концентрация которого выше концентрации насыщенного раствора (при данной температуре и давлении). Такой раствор получается при осторожном и медленном охлаждении насыщенных при высокой температуре растворов. Пересыщенный раствор представляет собой систему, находящуюся в кажущемся равновесии (∆G>0). Встряхивание или внесение в раствор кристаллов того же вещества вызывает кристаллизацию и раствор становится насыщенным. Растворимость данного вещества определяется концентрацией его в насыщенном растворе. Эффекты, возникающие в результате взаимодействия молекул растворителя с частицами растворённого вещества, называются сольватационными. По своей природе они являются частично электростатическими (физическая сольватация), частично химическими (химическая сольватация). В растворителях неполярных и малополярных, не содержащих ни подвижных протонов, ни донорных атомов, способных к образованию координационных связей, возможна только физическая сольватация, обусловленная ван-дер-ваальсовыми силами (углеводороды и их галогенопроизводные).В полярных растворителях, имеющих донорные атомы, содержащих или не содержащих подвижных протонов (кетоны, простые эфиры, вода спирты, карбоновые кислоты, амины) возможна как физическая, так и химическая сольватация. Для недиссоциированных молекул и ионов, недостаточно склонных к образованию координационных связей (катионы большинства щелочных и щелочно-земельных металлов, органические ионы, многие анионы) характерна физическая сольватация. Химическая сольватация обусловлена образованием координационных связей между молекулами растворителя и частицами растворённого вещества. Она характерна для катионов d- и p- элементов. Такие катионы, например, образуют в воде аквакомплексы: [Cr(H2O)6]3+, [Zn(H2O)4]2+, [Al(H2O)6]3+ и т.д. Термодинамика процесса растворения ΔGрастворения =ΔHрастворения – TΔSрастворения Если имеет место сильное взаимодействие частиц растворяемого вещества и растворителя, то процесс растворения — экзотермический: ΔHрастворения < 0. В этом случае изменение энтропии может быть как положительной (ΔSрастворения >0), так и отрицательной величиной (ΔSрастворения<0). Часто процесс растворения сопровождается изменением агрегатного состояния. Тогда: ΔHрастворения =ΔНфазового перехода + ΔHсольватации ΔSрастворения =ΔSфазового перехода + ΔS сольватации Для кристаллов энтальпия фазового перехода ΔНф.п. равна энергии разрушения кристаллической решётки и, следовательно, ΔНф.п. > 0 и ΔSф.п.> 0. Сольватация — процесс экзотермический ΔНсольв.<0. Поэтому энтальпия процесса растворения может быть ΔНраств > 0 и < 0.Поскольку процесс растворения связан с взаимодействием растворяемого вещества и растворителя, растворение сопровождается изменением структуры и растворяемого вещества и растворителя. Сольватация означает упорядочение системы (происходит уменьшение числа частиц, образование новых структур). Следовательно: ΔSсольв.<0. Однако по абсолютной величине изменение энтропии мало и поэтому при растворении ΔS.> 0. По мере увеличения концентрации раствора усиливается интенсивность взаимодействия между содержащими его частицами и усложняется его структура. При разбавлении, наоборот, строение раствора упрощается, и взаимодействие между частицами ослабевает. Введение растворённого вещества может привести как к уменьшению энтропии растворителя, так и к её увеличению. Структурирующие ионы для воды (уменьшающими её энтропию) — это малые по размеру и многозарядные ионы: Li+, Na+, Mg2+, Al3+,Fe3+,OH и др. Деструктурирующие ионы (увеличивающие её энтропию) — это большие однозарядные ионы: K+, Rb+, Cs+, Cl-, NO3-, ClO4- и др.. Структурирующие ионы — ионы с высокой напряжённостью электрического поля, которые могут поляризовать молекулы воды за пределами первой гидратной оболочки. Это приводит к повышению вязкости растворов. Деструктурирующие ионы не могут поляризовать воду за пределами первой гидратной оболочки, в результате вязкость этих растворов меньше, чем у чистой воды.
4.2. Способы выражения состава растворов Массовая доля ω(в) растворённого вещества «В» — отношение массы растворённого вещества m(в) к сумме масс растворённого вещества и растворителя, чаще всего, воды (т.е. к массе раствора): w(в) = Массовая доля растворённого вещества выражается в долях или в %%(процентное содержание). Например, раствор с массовой долей серной кислоты ω(H2SO4)=0,2(т.е.20%) может быть обозначен как 20% - раствор серной кислоты. В биологии и медицине также часто используют мг% и мкг%. Число мг% показывает, сколько мг растворённого вещества содержится в 100 г раствора. Число мкг% показывает, сколько мкг растворённого вещества содержится в 100 г раствора. Содержание растворённого вещества в мг% и мкг% применяют для характеристики очень разбавленных растворов. Например, массовая доля раствора глюкозы равна 0,001% или 1мг% или 1000мкг%. Молярная концентрация с(в) растворённого вещества «В» — отношение количества вещества n(в) к объёму раствора: c(в)= Раствор, в котором молярная концентрация растворённого вещества равна с(в) моль/л, характеризуется молярностью, численно равной значению с(в). Например, раствор с молярной концентрацией серной кислоты с(H2SO4)= 0,1моль/л может быть обозначен как 0,1М H2SO4 (децимолярный раствор серной кислоты в воде). Нормальность (молярная концентрация химического эквивалента сeq (в) растворённого вещества «В» —это отношение эквивалентного количества вещества neq(в) к объёму раствора:
Раствор, в котором молярная концентрация эквивалента равна ceq(в) моль/л, характеризуется нормальностью, численно равной значению ceq(в). Например, раствор с молярной концентрацией эквивалента серной кислоты ceq(H2SO4)= 1моль/л может быть обозначен как 1н H2SO4 (однонормальный раствор серной кислоты в воде). Нормальность раствора определяется эквивалентным количеством растворённого вещества и, следовательно, как и последнее, зависят от эквивалентного числа z(в), постоянного только для конкретной реакции, причём величина ceq(в) всегда в z(в) раз больше его молярной концентрации c(в): сeq(в)=z(в)∙ с(в). Молярная доля χ растворённого вещества ― отношение количества данного компонента «В» в молях, содержащегося в растворе, к общему количеству всех веществ, включая растворитель: χ = n(в) / [n(в) + n(р-ль)] Молярная доля χ, как и массовая выражается в долях единицы, в процентах. Например, χ(H2SO4) = 0,01 = 1%. Моляльность раствора b – отношение количества данного растворённого вещества n(в) моль к массе растворителя (в кг): b = n(в) / m(р-ль). Например, b(H2SO4) = 0.1моль/кг.
Пример 1. В 450 г воды растворили 50 г CuSO4·5H2O. Вычислите массовую долю кристаллогидрата, безводной соли и ионов меди в растворе. Решение: ω (CuSO4·5H2O) = ω (CuSO4) = Пример 2. Какую массу 5%-ного раствора MgSO4 можно приготовить из 300 г MgSO4 ·7H2O? Решение: ω(MgSO4) = m(MgSO4) / m (р-р). m(р-р) = m(MgSO4) / 0,05. m(MgSO4) = m(MgSO4 ·7H2O) /M (MgSO4 ·7H2O) ·M(MgSO4) = =300 / 246 · 120 = 146,3(г) m(р-р) = 146,3 / 0,05 = 2926,8(г)
Пример3. Сколько воды следует прибавить к 200мл 20% -ного раствора серной кислоты с плотностью 1,14г/мл, чтобы получить 5% -ный раствор? Решение: m(р-ра H2SO4) = 200·1,14 = 228(г). m(H2SO4) = 228 · 0.2 = 45.6(г) Массовая доля серной кислоты в конечном растворе: 0,05 =45,6 / [228 + m(H2O)]. Отсюда: [228 + m(H2O)] = 45,6/0,05 = 912(г) m(H2O) = 912 – 228 = 684(г). Пример 4. Смешали 300г 40% раствора азотной кислоты и 700г 10% раствора той же кислоты. Определите массовую долю полученного раствора. Решение: m(р-ра HNO3) = 300 + 700 = 1000(г). m(HNO3) = 300 · 0,4 + 700 · 0,1 = 190(г). ω(нового раствора) = 190/1000 = 0,19=19% Пример 5. Определите массу 30% раствора серной кислоты, которую следует добавить к 600 г 80% раствора той же кислоты для получения 60% раствора. Решение: Пусть масса 30% раствора x. Тогда масса раствора после смешения: m(р-р) = 600 + x m(H2SO4) = 600 · 0,8 + x · 0,3. 0,6 = [600 · 0,8 + x · 0,3. 0,6] / (600 + x). x = 400(г). Пример 6. Как приготовить 500мл 1,5 М раствора серной кислоты из 96%-ного раствора с плотностью 1,84г/мл? Решение: n(H2SO4) = 1,5 · 0,5 = 0,75(моль). m(H2SO4) = 98 0,75 = 73,5(г). V(96% р-ра H2SO4) = 73,5/ 1,84 · 0,96 = 42(мл). Далее: необходимо долить воды, чтобы довести объём раствора до 500мл. Пример 7. Вычислите нормальность и молярную концентрацию раствора H3PO4 с массовой долей кислоты 49% и плотностью 1,33г/мл. Фактор эквивалентности кислоты равен 1/3. Решение: Масса 1л раствора: 1000 ·1,33 = 1330(г). m(H3PO4) = = 1330 · 0,49 = 650(г). n(H3PO4) = 650 / 98 = 6,6(моль). c(H3PO4) = 6,6 моль/л; c(1/3 H3PO4) = 6,6 / (1/3) = 19,8(моль экв), т.е.19,8н H3PO4. Пример 8. Рассчитайте нормальность и молярную концентрацию раствора гидроксида натрия, если 20мл этого раствора было нейтрализовано 10мл 0,1н H2SO4. Решение: В соответствии с законом эквивалентов: c(NaOH) ∙V(NaOH) = c(1/2H2SO4) ∙ V(H2SO4). Отсюда c(NaOH) = c(1/2H2SO4) ∙ V(H2SO4) / V(NaOH) = 0,1 ∙10 / 20 = = 0,05(моль/л). Задачи для самостоятельного решения
1. Определите массу растворённого вещества: а) в 250 г 8%-ного раствора K2CO3,. б) в 500 мл 5%-ного раствора азотной кислоты с плотностью раствора 1,03г/мл. Ответ: а)20г; б)25,75г. 2. Вычислите массовую долю растворённых веществ для растворов, содержащих: а)1 моль аммиака в 3 моль воды; б) 100г серной кислоты в 10 моль воды. Ответ: а)23,9%; б)35,7%. 3. Вычислите массовую долю безводной соли для раствора, приготовленного из 14,3г Na2CO3· 10H2O и 120г воды. Ответ: 3,95%. 4. Вычислите массовую долю безводной соли в растворе, полученном растворением 0,01 моль кристаллогидрата Al2(SO4)3 · 18 H2O в 1,0 моль воды. Ответ: 13,86%. 5. Какую массу хлорида калия следует добавить к 450 г 8%-ного раствора той же соли для получения 12%-ного раствора? Ответ: 20,45г. 6. Какую массу воды следует добавить к 1кг 40%-ного раствора серной кислоты для получения 25%-ного раствора? Ответ: 600г. 7. Из 750 кг 48%-ного раствора серной кислоты выпарили 300 кг воды. Определите массовую долю серной кислоты в полученном растворе. Ответ: 80%. 8. Какую массу 32%-ного раствора азотной кислоты следует добавить к 600 г 80%- ного раствора той же кислоты для получения 64%-ного раствора? Ответ: 300г. 9. Определите массу 8%-ного раствора гидроксида натрия, которая потребуется для нейтрализации 292 г 20%-ного раствора соляной кислоты. Ответ: 800г. 10. Какой объём 5,5%-ного раствора азотной кислоты (плотность равна 1,03г/мл) требуется для нейтрализации 60 мл 12%-ного раствора КОН (плотность равна 1,1г/мл)? Ответ: 157мл. 11. К 700 мл 84,5%-ного раствора серной кислоты (плотность 1,78г/мл) добавлено 1200 мл 42%-ного раствора гидроксида натрия (ρ = 1,45 г/мл). Какой объём 35%-ного раствора гидроксида калия (плотность 1,35 г/мл) потребуется добавить к раствору для достижения нейтральной реакции? Ответ: 380мл. 12. Определите массу растворённого вещества, содержащегося в 1л следующих растворов: а) 0,1н H2SO4(фактор эквивалентности ½); б) 0,5н Na2CO3 (фактор эквивалентности ½); в) 0,3н H3PO4 (фактор эквивалентности1/3). Ответ: а)4,9г; б)26,5г; в)9,8г. 13. Какой объём раствора 0,1н H2SO4 (фактор эквивалентности ½) можно приготовить из 70 мл 50%- ного раствора этой кислоты (ρ = 1,40 г/мл)? Ответ: 10л. 14. Вычислите нормальность и молярную концентрации следующих растворов: а) 40%-ный раствор гидроксида натрия(ρ = 1,43 г/мл); б)20%-ный раствор соляной кислоты (ρ= 1,1 г/мл); в) 18%-ный раствор аммиака (ρ=0,932 г/мл). Ответ: а) 14,3 моль/л; б) 9,87моль/л; в) 6,03моль/л. 15. Двумолярный раствор серной кислоты разбавили в 5 раз. Определите концентрацию полученного раствора. Ответ: с(H2SO4) =0,4 моль/л.. 16. Вычислите массовую долю одномолярного раствора нитрата никеля(II), плотность которого равна 1,14г/мл. Ответ: 16%. 17. Какой объём 0,5н NaOH требуется, чтобы осадить в виде Cu(OH)2 всю медь, содержащуюся в 15мл 1,2н CuCl2? Ответ: 36 мл. 18. Навеска оксалата натрия Na2C2O4 массой 1,6260г растворена в мерной колбе ёмкостью 250мл. Какой объём 0,09768 н KMnO4 будет израсходован на титрование 25,0мл раствора оксалата натрия в кислой среде? Ответ:24,84мл. 19. Рассчитайте массу дихромата калия, которая потребуется для приготовления 500мл раствора 0,05н K2Cr2O7 , необходимого для определения концентрации тиосульфата натрия Na2S2O3. Ответ: 1,23г 20. Какая масса Na2CO3 требуется для взаимодействия с 600 мл 0,5н HNO3? Ответ: 15,9г. 21. Какая масса BaCl2 · 2H2O потребуется для взаимодействия с 750 мл 0,12н H2SO4 (фактор эквивалентности ½)? Ответ: 11г. 22. Определите нормальную концентрацию 0,1 М H3PO4, используемого для получения гидрофосфатов. Ответ: c=0,2 мольэкв/л. 23. Рассчитайте нормальность соляной кислоты, если на титрование 20,0мл кислоты пошло 15,0мл 0,02н Na2B4O7. Ответ: c(HCl) = 0,015 моль/л. 24. Сколько миллилитров раствора соляной кислоты с массовой долей 30% и плотностью 1,15г/мл потребуется для приготовления 1,5л 0,2н HCl? Ответ: 32мл. 25. Навеска буры Na2B4O7 ∙10H2O массой 2,4г растворена в мерной колбе ёмкостью 200мл. На титрование 20,0мл раствора серной кислоты расходуется 33,9мл приготовленного раствора буры. Рассчитайте нормальность раствора серной кислоты. Ответ: c(1/2H2SO4) =0,1 моль/л. 26. В плазме крови содержится 152 ммоль/л ионов натрия. Считая, что ионы натрия находятся только в виде хлорида натрия, вычислите массовую долю хлорида натрия в плазме крови. Плотность плазмы крови 1,03 г/мл. Ответ: ω=0,86% 27. Для раствора сахарозы с концентрацией 0,1 моль/л рассчитайте массовую долю сахарозы(в %,мг%, мкг%), моляльность b, молярную долю χ. ρ (р-ра) = 1,03 г/мл. Ответ: ω=3,29%; 3290 мг%; 3290000 мкг%; b =0,0994 моль/кг, χ= 0,00179. 28. Массовая доля железа в крови в расчёте на элемент составляет 50 мг%. Рассчитайте массу железа в расчёте на элемент, содержащегося в 5,0 кг крови. Ответ: 2,5г.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1616; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.009 с.) |

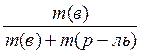
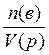 (моль/л).
(моль/л).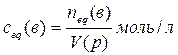
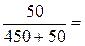 0,1 = 10%
0,1 = 10% 
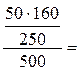 6,4% ω (Cu2+) =
6,4% ω (Cu2+) = 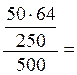 2,56%
2,56% 


