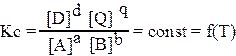Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетика химических реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химические реакции протекают с выделением или поглощением энергии. Обычно эта энергия выделяется или поглощается в виде теплоты. Закономерности превращения энергии при химических реакциях являются предметом химической термодинамики. В термодинамике оперируют понятиями «система». Система — любая совокупность изучаемых объектов; часть пространства, содержащего тело или совокупность тел, заключающего в себе большое число частиц. Термодинамическая система — система, в которой возможны энергообмен и диффузия между составляющими частями системы. Система, которая не может обмениваться с окружающей средой ни энергией, ни веществом называется изолированной. Закрытая (замкнутая) система — система, которая обменивается c окружающей средой энергией, но не веществом. Открытая (незамкнутая) система — система, которая обменивается с окружающей средой и энергией, и веществом. Система, в которой нет поверхности раздела, называется гомогенной. Если система состоит из различающихся по составу или свойствам частей, разграниченных поверхностью раздела, называется гетерогенной. Термодинамические параметры определяют состояние системы в данный момент времени: экстенсивные параметры (масса, объем, площадь поверхности и т. п.) прямо пропорциональны количеству вещества системы, интенсивные параметры не зависят от количества вещества (температура, давление). Термодинамические функции зависят от термодинамических параметров системы. Среди них выделяют функции состояния, зависящие только от состояния, в котором находится система, и не зависящие от пути, по которому система пришла к данному состоянию (например,внутренняя энергия, энтальпия ). Внутренняя энергия системы — суммарный запас энергии системы, который включает энергию поступательного и вращательного движения молекул, энергию взаимодействия между атомами, энергию электронов, энергию, заключённую в ядрах и т.д. В соответствии с первым началом термодинамики теплота Q, подводимая к системе расходуется на изменение внутренней энергии ∆U и на совершение работы A: Q = ∆U + A Если работа сводится к расширению или сжатию газа, то: Q = ∆U + P∆V При изохорных процессах (∆V=0) поглощаемая системой теплота расходуется на увеличение внутренней энергии системы: Q = ∆U. Гораздо чаще химические реакции проходят при постоянном давлении. В этом случае используется термодинамическая функция состояния системы— энтальпия H Она определяется соотношением H = U + PV При постоянном давлении ∆H = ∆U + P∆V, т.е. изменение энтальпии равно сумме изменения внутренней энергии ∆U и совершенной системой работы расширения P∆V. Раздел химической термодинамики изучающий тепловые эффекты химических процессов называется термохимией. Если энтальпия реагентов больше, чем энтальпия продуктов реакции, то реакция сопровождается выделением теплоты, т.е. является экзотермической. В ходе экзотермической реакции энтальпия системы уменьшается, в этом случае ∆ Н< 0.Наоборот, если энтальпия реагентов меньше энтальпии продуктов, то реакция происходит с поглощением теплоты, т.е. является эндотермической. В ходе эндотермической реакции энтальпия системы увеличивается, поэтому в этом случае ∆Н>0. Химические уравнения, в которых указан тепловой эффект реакции, называют термохимическими. В термохимических уравнениях справа от формул веществ в скобках указывается агрегатное состояние: (г)–газообразное, (ж)– жидкое, (т)– твёрдое,(к)–кристаллическое, (р)–растворённое. Например: CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж) ∆Н= – 802,3 кДж Для сравнения энтальпий различных реакций их необходимо приводить к одинаковым условиям. Как правило, тепловой эффект реакции приводится для стандартных условий: давления 102,3 кПа(1атм) и любой фиксированной температуры. Величины ∆Н в этих условиях называют стандартными и обозначают ∆НоТ. Верхний индекс о означает, что тепловой эффект приводится для стандартного давления, а нижний индекс характеризует фиксированную температуру. Чаще всего приводят значения ∆НоТ для 298,15К(25оС) и вместо ∆Но298,15 пишут просто ∆Но. Абсолютное значение внутренней энергии и энтальпии вычислить невозможно, можно только рассчитать относительные значения в сравнении с её значениями в стандартном состоянии. Для процесса образования сложного вещества из простых веществ в качестве стандартного выбрано наиболее устойчивое состояние при стандартных условиях, т.е. при давлении 101,3 кПа и заданной температуре. В справочниках чаще всего приводят стандартную молярную энтальпию образования при температуре 298,15 К, которую обозначают как ∆Ноf,298.Нижний индекс f — сокращение от английского слова formation(образование). Стандартная молярная энтальпия образования — изменение энтальпии при образовании 1 моль данного вещества в стандартном состоянии из простых веществ, также находящихся в стандартном состоянии. Стандартные энтальпии образования простых веществ в стандартных условиях принимают равными нулю. Определить экспериментально теплоты образования подавляющего большинства органических веществ не удаётся, так как невозможно получить их прямым синтезом из простых веществ. Поэтому в термохимических расчётах для органических соединений используют найденные опытным путём теплоты сгорания. Стандартная молярная энтальпия сгорания — изменение энтальпии при полном сгорании 1 моль вещества в его стандартном состоянии при стандартных условиях. Закон Гесса. Тепловой эффект химической реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода. Следствия из закона Гесса. 1 следствие: Тепловой эффект химической реакции при стандартных условиях равен сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ. Например: СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж) ∆ Нореакции = [∆Ноf,298(СО2) + 2 ∆Ноf,298(Н2О)] – [ ∆Ноf,298(СН4) + 2 ∆Ноf,298(О2)] = [– 393,5 + 2(– 241,8)] – [(– 74,8) + 2∙ 0] = – 802,3 кДж. 2 следствие: Тепловой эффект химической реакции при стандартных условиях равен сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции. Например: С2Н2 (г) + СО(г) + Н2О(ж) = СН2 = СНСООН(ж) ∆ Нореакции = [∆Носг ,298(С2Н2) + ∆Носг ,298(СО) + ∆Носг ,298(Н2О) – [ ∆Носг ,298(С2Н3СООН)] = [– 1299,6 – 282,5 + O] – [– 1370,0] = – 211,13 кДж Первое начало термодинамики не даёт ответа на вопрос о направлении самопроизвольно протекающих процессов при данных условиях. Самопроизвольные процессы—это процессы, происходящие вокруг нас, которые, исходя из опыта, мы считаем наиболее вероятными. Например, энтальпия реакции 12С(т) + 11Н2О(ж) = С12Н22О11(т), рассчитанная по закону Гесса ∆Н<O, хотя она реально неосуществима, а у реакции N2(г) + O2(г) = 2NO(г) ∆Н>O, но она протекает при высокой температуре. Таким образом, изменение энтальпии нельзя считать единственной причиной самопроизвольного протекания реакций. Существует ещё функция состояния системы, изменение которой оказывает влияние на направление процесса — энтропия S. Энтропия – функция состояния системы, величина которой показывает меру неупорядоченности, хаотичности системы. Одна из формулировок второго начала термодинамики — в изолированных системах самопроизвольно протекающие процессы сопровождаются увеличением энтропии. Для необратимых процессов в изолированных системах изменение энтропии ∆ S>O, для обратимых процессов ∆S = O. Все реальные процессы необратимы, лишь небольшое число из них можно приближённо рассматривать как обратимые. Следовательно, в результате реальных процессов энтропия изолированной системы всегда увеличивается. Чем ближе термодинамическое равновесие, тем больше хаотичность расположения молекул в теле или в системе. Таким образом, самопроизвольные процессы в изолированных системах протекают только в направлении возрастания энтропии S. ∆S = S2 – S1 >O идёт процесс 1→ 2 ∆S = S2 – S1 <O идёт процесс 2 ← 1 ∆S = O термодинамическое равновесие В неизолированной системе самопроизвольно протекают реакции, в результате которых химическая система достигает состояния, характеризующегося не только меньшей энтальпией, но и большей энтропией. Учесть одновременно оба фактора для систем находящихся при постоянном давлении и температуре позволяет функция состояния — свободная энергия Гиббса: G = H —TS. Абсолютные значения энергии Гиббса, так же как и абсолютные значения энтальпии, невозможно определить, поэтому используют уравнение ∆G =∆ H —T∆S Условием самопроизвольного протекания изобарно-изотермических процессов является неравенство ∆ G<O. Реакция продолжается до достижения минимального значения энергии Гиббса. В обратимых реакциях минимальная энергия системы достигается в состоянии химического равновесия. После установления химического равновесия ∆G = O. Величина энергии Гиббса складывается из энтальпийного вклада ∆H и энтропийного вклада T∆S. Рассмотрим различные варианты: 1. ∆H<O, ∆S >O ∆G <O, процесс протекает в прямом направлении независимо от величин ∆H, ∆S, T. 2. ∆H <O, ∆S <O ∆G <O, если |∆H|>|T∆S|, такие реакции возможны при низких температурах. 3. ∆ H >O, ∆S <O ∆G >O, процесс может протекать только в обратном направлении 4. ∆H > O,∆S >O∆G<O, если |T∆S|> |∆H|, процесс может протекать при высокой температуре. Пример 1. Рассчитайте стандартную энтальпию реакции 2SO2(г) + O2(г) = 2SO3(г) ΔHfo (кДж/моль) – 297 0 – 396 Решение: Δ Нор-ции = Σ ΔНопрод – Σ ΔНоисх = 2(– 396) – [2(– 297) + 1(0)] = = – 198 кДж Пример 2. Рассчитайте стандартную энтальпию образования этанола, если стандартные энтальпии сгорания углерода, водорода и этанола соответственно равны (в кДж/моль): – 393,5; – 285,8; – 1366,9. Решение: Уравнение реакции, соответствующей энтальпии образования этанола: 2С + 3Н2 + 0,5О2 = С2Н5ОН Δ Нор-ции =Σ ΔНосг.исх – Σ ΔНосг.эт. = 2(– 393,5) + 3(– 285,8) – (– 1366,9) = = – 277,6 кДж По определениюΔ Нор-ции = ΔHfo(С2Н5ОН). Пример 3. Рассчитайте стандартную энтропию ΔSo реакции: SO2(г) + 0,5O2(г) = SO3(г) Стандартные энтропии образования SO2(г),SO2(г),SO3(г) равны соответственно (в Дж/К моль): 248, 205, 257. Решение: ΔSo = Σ S fo прод. – Σ Sf oисх. = 2·257 – (2· 248 1· 205) = = – 187 Дж/К Пример 4. Пользуясь значениями ΔGof отдельных соединений, вычислите ΔGo реакции SO2(г) + NO2(г) = SO3(г) + NO(г) и определите её направление в стандартных условиях. ΔGof оксида серы()VI), оксида азота(II), оксида серы (IV), оксида азота(IV) соответственно равны (в кДж/моль): – 370,4; 86,6; – 300,4; 51,8. Решение: ΔGo р-ции = [ΔGof(SO3) + ΔGof(NO)] – [ΔGof(SO2) + ΔGof(NO2)] = (–370,4 + 86,6) – (–300,4 + 51,8) = –35,2 кДж.Величина ΔGo р-ции < О, значит реакция протекает в сторону образования SO3 и NO. Упражнения и задачи для самостоятельного решения
1. Стандартные энтальпии образования (в кДж/моль) аммиака и нитрата аммония равны соответственно: – 46,0 и – 365,4. Напишите уравнения реакций, к которым относятся эти тепловые эффекты. 2. При образовании 1,70г аммиака выделилось 4600Дж тепла. Определите стандартную теплоту образования аммиака. Ответ: ∆Нf(NH3) = – 46,0 кДж/моль 3. Рассчитайте энтальпию реакции (при стандартных условиях): SO2(г)+ 2H2S(г)= 3S(кр).+ 2Н2О(ж), если стандартные энтальпии образования SO2(г),H2S(г) и.H2О(ж) равны соответственно(в кДж/моль): –297,0; –21,0; –286,0. Ответ: ∆Нр-ции= – 233кДж 4. Окисление аммиака протекает по уравнению: 4NH3(г)+ 302(г)= 2N2(г) + 6Н2О(ж). Стандартная энтальпия реакции равна –1532 кДж. Определите стандартную энтальпию образования аммиака, если стандартная энтальпия образования воды –286,0кДж/моль. Ответ: ∆Нf(NH3) = –46,0 кДж/моль 5. Не производя вычислений, установите знак изменения энтропии реакции окисления аммиака (см.п.4). 6. Рассчитайте стандартную энергию Гиббса реакции: СО(г) + Н2О(ж) = СО2(г) + Н2(г).Установите, в каком направлении эта реакция может протекать самопроизвольно в стандартных условиях при 25оС. Стандартные энергии Гиббса образования СО2(г), Н2О(ж) и СО(г) соответственное(в кДж/моль): –394,0; –121,0; –137.0. Ответ:∆Goр-ции = –136 кДж ХИМИЧЕСКОЕ РАВНОВЕСИЕ Основные понятия и признаки химического равновесия Большинство химических реакций является обратимыми, т.е. протекают одновременно в двух противоположных направлениях, например: N2 + 3H2 = 2NH3. Реакция, протекающая слева направо (соединение азота с водородом), называется прямой. Реакция, протекающая справа налево (разложение аммиака), называется обратной. По истечении времени концентрации веществ, образующих данную систему, перестают меняться и остаются постоянными во времени, если не изменяются внешние условия ― установилось химическое равновесие. Равновесное состояние — термодинамическое состояние сиcтемы, которое при постоянных внешних условиях не изменяется во времени, причём стабильность характеристик системы (состав, давление и др.) не обусловлена протеканием какого-либо внешнего процесса. Признаки истинного равновесия системы: 1. Неизменность равновесного состояния системы при сохранении внешних условий. 2. Подвижность равновесия — самопроизвольное восстановление равновесие после прекращения внешнего воздействия. 3. Динамический характер равновесия — скорость прямого процесса равна скорости обратного процесса. 4. Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию. 5. Энергия Гиббса в состоянии истинного термодинамического равновесия минимальна Gmin, a изменение энергии Гиббса равно нулю ∆G=0. Концентрации реагентов и продуктов реакции в состоянии химического равновесия называются равновесными. Состояние равновесной химической системы характеризуется по закону действующих масс константой равновесия. Для обратимой химической реакцией, которую в общем виде можно изобразить уравнением aA + bB = dD + qQ константа равновесия имеет вид:
где Кс — концентрационная константа равновесия; [A], [B] — равновесные концентрации исходных веществ; [D], [Q] — равновесные концентрации продуктов реакции; a,b,d,q — стехиометрические коэффициенты. Выражение константы равновесия показывает: для идеальных систем в состоянии химического равновесия отношение произведений концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре давлении и в данном растворителе. Для реальных систем, в которых имеют место как электростатические, так и химические взаимодействия, значения концентрационных констант зависят от многих факторов. Значение концентрационной константы зависит от температуры, давления, природы растворителя и ионной силы раствора. Величина константы равновесия, выраженная через активности реагирующих частиц называется термодинамической константой равновесия. В общем случае формулировка закона действующих масс гласит: в состоянии химического равновесия отношении произведений активностей продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению активностей исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре, давлении и в данном растворителе.
Термодинамическая константа зависит от наименьшего числа факторов и, следовательно, являются наиболее фундаментальными характеристиками равновесия. В справочниках приводятся именно термодинамические константы равновесия. Факторы, влияющие на величину константы химического равновесия: 1. Природа реагирующих веществ 2. Температура. Факторы, не влияющие на величину константы равновесия: 1. Концентрации реагирующих веществ 2. Давление в реакционной системе 3. Наличие примесей
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1593; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.93.138 (0.009 с.) |