
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесия в растворах электролитовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вещества, которые в растворе(или в расплаве) состоят полностью или частично из ионов называются электролитами. Различают сильные и слабые электролиты. Сильные электролиты – вещества, которые при растворении практически полностью диссоциируют на ионы. Слабые электролиты – это электролиты, которые в растворе неполностью диссоциируют на ионы. Свойства растворов слабых электролитов в значительной степени обусловлены существующими в них равновесиями между непродиссоциировавшими молекулами и ионами, которые образуются в результате частичной диссоциации молекул. Реакции диссоциации слабых электролитов описываются законом действующих масс и характеризуются константой и степенью диссоциации. Равновесия в растворах кислот и оснований в химии выделяются в отдельный вид в связи с резким отличием катиона водорода от всех остальных ионов и важностью реакций с участием протона для большинства разделов химии, в том числе и биохимии. Существует несколько теорий кислотно-основных превращений. Первой теоретической концепцией была теория Аррениуса. Согласно теории электролитической диссоциации Аррениуса, например, в водном растворе уксусная кислота распадается на ацетат ионы и ионы водорода: CH3COOH(p) = CH3COO-(p) + H+(p) Выражение закона действующих масс для реакции диссоциации уксусной кислоты:
К – константа равновесия, которую для реакций диссоциаций называют константой диссоциации или константой ионизации; [CH3COO-],[H+] и [CH3COOH] – равновесные концентрации ацетат- ионов, ионов водорода и молекул уксусной кислоты. Но теория Аррениуса не учитывает влияние растворителя и нельзя, в частности, представить существование катиона Н+ в растворе, так как протон лишён электронной оболочки, меньше других ионов и очень подвижен. Многие растворители обладают способностью переносить протоны к соответствующим акцепторам или присоединять протоны к молекуле растворителя. Это учитывает протолитическая теория Н.Бренстеда и Т. Лоури. Одновременно с теорией Бренстеда и Лоури появилась теория Льюиса согласно которой кислоты—вещества, принимающие пару электронов, основания—вещества, отдающие её. Например, кислотами являются молекулы с незаполненной восьмиэлектронной оболочкой (BF3,SO3), катионы-комплеrсообразователи(Fe3+,Co2+), молекулы с поляризованными двойными связями (CO2,SO2), а основаниями— молекулы, содержащие свободные электронные пары(NH3,H2O), анионы, органические соединения с двойными и тройными связями. Разновидностью теории Льюиса является концепция жёстких и мягких кислот Пирсона. Таким образом, в круг кислотно-основных реакций включается комплексообразование. Наиболее общей теорией кислот и оснований является теория Усановича, в соответствии с которой кислоты — вещества, отдающие катионы или принимающие анионы или электроны; основания — вещества, отдающие анионы или электроны и принимающие катионы. Кислоты и основания Усановича включаюткислоты и основания Льюиса окислители и восстановители. Согласно протолитической теории кислотами являются вещества― доноры протона, а основаниями ― акцепторы протона. Кислотами и основаниями могут быть как нейтральные молекулы, так и ионы. Пример кислот: HCl, H3PO4, HCOOH, H2O, PCl5, Cl2, H3O+, [Al(H2O)6]3+,HCO3-,NH4+. Пример оснований: NH3, H2O, CH3NH2, C2H5OH, СаО, Cl–, CH3COO–, OH–, [Al(H2O)5OH]2+. Некоторые вещества способны быть и донором и акцептором протонов. Такие вещества называются амфолитами. Например, H2О,HCO3–, [Al(H2O)5OH]2+. Обратимые реакции с переносом протона от кислоты НА к основанию В называются кислотно-основными полуреакциями. Реакция между кислотой и основанием — «борьба» за протон между двумя основаниями: НА + HL = LН2+ + А– кислота 1 основание 2 кислота 2 основание 1 Кислота и получившееся при отдаче протона основание составляют сопряжённую пару. В этом уравнении это НА и А–, LН2+ и LH. Примеры протолитических равновесий: HCl + H2O = H3O+ + Cl– (1) кислота-1 основание-2 кислота-2 основание-1 HCl + OH- = H2O + Cl– (2) кислота-1 основание-2 кислота-2 основание- 1
H2O + NH3 = NH4+ + OH– (3) кислота-1 основание-2 кислота-2 основание-1 NH4+ + H2O = H3O+ + NH3 (4) кислота-1 основание-2 кислота- 2 основание-1 Растворитель является одним из участников протолитической реакции. Вода как амфолит обладает как кислотными, так и основными свойствами. Такие растворители являются амфипротными. Важнейшая особенность амфипротных растворителей ― способность к передаче протона от одной молекулы растворителя к другой. H2O + H2O = H3O+ + OH- Такие процессы, в которых одна молекула растворителя проявляет свойства кислоты, а другая — основания, называется автопротолизом. Название иона Н3О+ — «гидроксоний». Константа автопротолиза воды Кw или Кн2о называется ионным произведением воды: Кw = a(Н3О+) ∙a(ОН–) = 1,0 ∙ 10–14(25оС). Ионное произведение воды независимо от изменения концентраций ионов при неизменной температуре остаётся постоянным. В нейтральном растворе а(Н3О+)=а(ОН–) = 10–7 моль/л В кислой среде а(Н3О+)>а(ОН–). В щелочной среде а(Н3О+)<а(ОН–). Кислотность среды принято оценивать по водородному показателю рН, который равен отрицательному десятичному логарифму от активности иона Н3О+ (или Н+) рН = – lg а(Н3О+) или рН = – lg а(Н+). При малой ионной силе, когда активность иона практически равна его концентрации рН = – lg[H3O+]. Аналогично: гидроксильный показатель pOH = – lg a(OH–) или – lg[OH–]. Таким образом, в нейтральной среде рН = рОН = 7. В кислой среде: рН < 7, рОН >7. В щелочной среде: рН > 7, рОН < 7. рН + рОН = 14 (298К) При взаимодействии с амфипротными растворителями (например, водой) растворённые вещества могут проявлять как кислотные свойства (ур-ие 4), так и основными свойствами (ур-ие 3). Сила кислоты и основания характеризуется константами равновесий, которые называются соответственно константой кислотности Ка и константой основности Кb (см. табл. 4 Приложения). НА + НL = LН2+ + А– кислота-1 основание-2 кислота-2 основание-1
Эта константа показывает относительную кислотность кислоты НА по отношению основанию В, т.е. является константой кислотности Ка кислоты НА. Например, протолитическое равновесие в водном растворе уксусной кислоты: СН3СООН + Н2О = СН3СОО– + Н3О+. Константа кислотности уксусной кислоты Ка показывает, что уксусная кислота является более сильной кислотой, чем вода:
В уравнение не входит активность воды, которая принята равной единице. Протолитическое равновесие в водном растворе соли уксусной кислоты: СН3СОО– + Н2О = СН3СООН + ОН– Константа этого протолитического равновесия является константой основности ацетат иона:
Константа основности ацетат иона Kb показывает, что ацетат ион является более сильным основанием, чем вода. Константы кислотности и основности сопряжённой пары связаны между собой. Перемножив Ка (СН3СООН) и Кb(СН3СОО-), получим:
Или в общем виде: HA + HL = LH2+ + A-
A- + HL = HA + L-
Произведение констант кислотности и основности Ka∙Kb сопряжённой пары НА и А– равно:
Активность растворителя HL принята равной единице. При малой величине ионной силы константы кислотности и основности можно выразить через концентрации:
Константы химического равновесия, в том числе константы кислотности и основности, тоже принято выражать в логарифмической форме: pKa = – lg Ka, а pKb = – lg Kb. Для сопряжённых кислот и оснований pKa + pKb = 14 (298К) Степень протолиза α слабого электролита представляет собой отношение концентрации одного из продуктов протолиза к равновесной концентрации протолита. Например, степень протолиза уксусной кислоты: α = [H3O+] / [CH3COOH]равн. Математическая зависимость константы кислотности (или основности) и степень протолиза связаны законом разбавления Оствальда: НА + Н2О = Н3О+ + А- К = α2 ∙Сисх. / (1 – α). Для малой величины степени протолиза α (1 – α) ≈ 1 и упрощённая формула имеет вид: К = α2 ∙ Сисх. где К – константа кислотности (Ka) или основности (Kb), в зависимости от вида протолиза. Если α <<5% то можно считать, что Сисх = [НА]равн. и, если пренебречь автопротолизом воды: Ка = [H3O+] ∙ [A-] / [HA] = [H3O+]2 / Cисх. ______ [H3O+] = √Ka Cисх. Если α > 5%, то [HA]равн ≠ Сисх. и тогда [НА]равн. = Сисх – [Н3О+]. Ка = [Н3О+] [А-] / [НА] = [H3O+]2 / (Сисх – [Н3О+]) [H3O+]2 + Ka [H3O+] – Ka Cисх. = 0 Решая квадратное уравнение, получим: _____________ [H3O+] = 0,5 (–Ka + √Ka2 + 4Ka Cисх.) Например, для 0,01M молочной кислоты: _____________________ [H3O+] = 0,5 (–1,4∙10-4 + √ 1,96∙10-8 + 4∙1,4∙0-4∙10-2 = 1,12∙10-4моль/л; pH = 2,95 Протолитические равновесия в растворах амфолитов: Это― растворы кислых солей(NaHCO3,NaH2PO4 и т.п.), аминокислот и т.п. В таких растворах сосуществуют частицы и принимающие, и отдающие протоны. Так, в растворе дигидрофосфата натрия существуют следующие протолитические равновесия: H2PO4– + H2O = H3O+ HPO42– Ka(H2PO4–) = 6,2 ∙10–8 H2PO4– + H2O = H3PO4 + OH– Kb(H2PO4–) = 1,4 ∙10–12 В растворе гидрофосфата натрия — следующие: HPO42– + H2O = H3O+ + PO43– Ka(HPO42–) = 4,6 ∙10–13 HPO42– + H2O = H2PO4– + OH– Kb(HPO42–) = 1,6 ∙ 10–7 В растворе дигидрофосфата натрия Ka>Kb. В растворе рН <7. В растворе гидрофосфата натрия Kb>Ka. В растворе pH>7. Приведённые примеры показывают, что протолитические равновесия смещены в сторону образования более слабых кислот и оснований. Таким образом, протолитическое равновесие можно рассматривать как конкуренцию различных по силе оснований за протон. Пример 1 Рассчитайте степень диссоциации (протолиза), рН, с(Н3О +) и с(ОН-) в водном растворе уксусной кислоты с концентрацией 0,1моль/л. рКа(СН3СООН) = 4,76. Решение: Протолитическое равновесие: CH3COOH +H2O = CH3COO– + H3O+ Сопряжённые пары: кислота СН3СООН и сопряжённое с ней основание СН3СОО–; основание Н2О и сопряжённая с ним кислота Н3О+. Константа протолитического равновесия — константа кислотности уксусной кислоты Ка = Для слабых электролитов ионная сила мала и коэффициент активности можно принят равным 1. Тогда: Ка = Поскольку с(СН3СОО–) =с(Н3О+), предыдущее выражение можно представить в виде: Ка = Равновесная концентрация уксусной кислоты равна исходной за вычетом концентрации, подвергнутой протолизу: сравн= сисх― с(Н3О+) [или с(СН3СОО-)] Для слабых электролитов, в растворах которых концентрация ионов очень мала можно принять сисх – с(Н3О+) Тогда: 4,76 – lg0,1 = 2pH. pH = 2,88. pOH = 14 – 2,88 = 11,12. c(H3O+) =1,32·10-3; c(OH-) = 7,59·10-12. Степень протолиза:
Пример 2. Рассчитайте [HCO3–] и [CO32–] в 0,01М растворе угольной кислоты, если рН этого раствора равен 4,5. Ка1 = 4,45∙10–7 ; Ка2 =4,69∙10–11 . Решение: Протолитические равновесия: 1 ступень: H2CO3 + H2O = HCO3– + H3O+ 2 ступень: HCO3– + H2O = CO32– + H3O+ pH = 4,5. Отсюда [H3O+] = 3,16∙10-5 моль/л Константа протолиза (константа кислотности) по первой ступени:
Отсюда [HCO3–] = 4,45∙ 10-7 ∙ 10-2 / 3,16∙10-5 = 1,41∙10-4 моль/л.
Отсюда [CO32–]=4,69∙10–11∙1,41∙10–4 / 3,16∙10–5 = 2,09∙10–10 моль/л. Пример 3. Вычислите концентрационную константу кислотности уксусной кислоты в водном растворе при наличии в растворе соли Mg(NO3)2 с концентрацией 0,05 моль/л, если рКо = 4,75. Решение: Термодинамическая константа кислотности уксусной кислоты:
Концентрационная константа кислотности уксусной кислоты:
a(CH3COO-) = f(CH3COO-) ∙ [CH3COO-]; a(H3O+) = f(H3O+) ∙ [H3O+]; a(СH3COOH) = f(CH3COOH) ∙ [CH3COOH]. Отсюда: Kо = Kc f(CH3COO-)∙f(H3O+) / f(CH3COOH∙), но поскольку для уксусной кислоты коэффициент активности практически равен 1, то Kc = Kо / f(CH3COO- )∙f(H3O+). Ионная сила раствора в основном определяется сильным электролитом ―солью: I = 0,5(0,05∙ 22 + 0,1∙1) = 0,15. В соответствии с табл. 5 Приложения: f(CH3COO-) = 0,79, а f(H3O+) = 0,85. Если рКо = 4,75, то Ко = 1,78∙10-5. Тогда Кс = 1,78∙10-5 / 0,79∙0,85 = 2,65∙10-5 Пример 4. Рассчитайте рН 0,01М раствора молочной кислоты. Ка = 1,4 ∙ 10-4 Решение: Протолитическое равновесие: CH3CH(OH)COOH + H2O = CH3CH(OH)COO- + H3O+ Для слабых электролитов, у которых степень протолиза > 5%, уже нельзя считать концентрацию молекул, не подвергнутых протолизу, равной исходной концентрации электролита. Поэтому для молочной кислоты: [CH3CH(OH)COOH]равн = [CH3CH(OH)COOH] исх. – [H3O+]. Тогда: Ka = [H3O+] ∙ [CH3CH(OH)COO–] / [CH3CH(OH)COOH]равн = [H3O+]2 / [CH3CH(OH)COOH] исх. – [H3O+] [H3O+]2 + Ka[H3O+] – Ka[CH3CH(OH)COOH] исх. = 0 _______________________________ [H3O+] = 0,5(–Ka + √ Ka2 + 4Ka[CH3CH(OH)COOH]исх. _________________________ [H3O+] = 0,5(–1,4 ∙ 10–4 + √ (1,4 ∙10–4)2 + 4∙ 1,4 ∙10–4 ∙10–2 = = 1,12 ∙10–3 моль/л; pH = 2,9
Пример 5. Рассчитайте рН раствора HCN с концентрацией 10-6 моль/л. Ка = 6,2 ∙10–10 Решение: Для слабых электролитов с концентрацией < 10–4 моль/л, у которых константа протолиза < 10–8 , необходимо учитывать автопротолиз воды. Протолитическое равновесие: HCN + H2O = CN– + H3O+ Уравнение электронейтральности: [H3O+] = [CN–] + [OH–] [OH–] = Kw/ [H3O+]; Ka = [H3O+] ∙ [CN–] / [HCN]; [CN-] = Ka [HCN] / [H3O+]; Поскольку кислота очень слабая, можно считать: [HCN]равн= [HCN] исх. Тогда: [H3O+] = Ka ∙ [HCN]исх. / [H3O+] + Kw / [H3O+]; [H3O+]2 = Ka [HCN]исх. + Kw; ____________________ ____________________ [H3O+] = √ Ka [HCN]исх. + Kw = √ 6,2 ∙ 10–10 ∙ 10–6 + 10–14 = =1,03 ∙ 10–7 моль/л ; pH = 6,99. Пример 6. Рассчитайте рН раствора ацетата натрия с концентрацией 0,1 моль/л, а также степень протолиза (гидролиза) этой соли. Ка(СН3СООН) = 1,75 ∙10-5. Решение: Протолитическое равновесие: CH3COO– + H2O = CH3COOH + OH– Константа протолиза (константа основности иона ацетата): Kb = [CH3COOH] [OH–] / [CH3COO–] [CH3COOH] = [OH–] а) Для приближенных расчетов можно считать, что [CH3COO–]равн = [CH3COO–] исх. б) Для точных расчетов: [CH3COO–]равн = [CH3COO–] исх. – [OH–] Kb = Kw/ Ka = 10–14 / 1,75 ∙10–5 = 5,75 ∙10–10 а) Kw/Ka = [OH–]2 / [CH3COO–]; [OH–]2 = Kw/Ka [CH3COO–]; 2pOH = – lgKw + lgKa – lg[CH3COO–] = – lg10–14 + lg1,75 ∙10–5 – lg0,1= = 10,24. pOH = 5,12. pH = 14 – 5,12 = 8,88. б) Kw/Ka = [OH–]2 / ([CH3COO–] исх. – [OH–]); [OH–]2 = Kw/Ka ([CH3COO–] исх. – [OH–]); [OH–]2 = 5,75 ∙ 10–10 (0,1 – [OH–]); Пусть [OH–]= x. x2 + 5,75 ∙10–10 ∙ x – 5,75 ∙10–10 ∙ 0,1 = 0; x = 7,6 ∙10-6; [OH–] = 7,6 ∙10–6 моль/л; рОН = 5,12; pH = 8,88. Степень гидролиза соли: h = [OH–] / [CH3COO–] исх. = 7,6 ·10–6 / 10–1 = =7,6 ·10–5 = 0,0076%. Пример 7. Рассчитайте рН в растворе гидрокарбоната натрия с концентрацией соли с= 0,1моль/л. Ka1(H2CO3) = 4,5 ∙10–7; Ka2(HCO3–) = 5,0∙10–11. Решение В растворе гидрокарбоната натрия устанавливаются равновесия: НСО3– + Н2О = Н3О+ + СО32– НСО3– + Н2О = Н2СО3 + ОН– В отличие от раствора слабой кислоты [H3O+]≠ [CO32–], так как часть ионов Н3О+ присоединяется к НСО3– с образованием Н2СО3. Следовательно, [H3O+] = [CO32–] ― [H2CO3] Выразим [CO32–] и [H2CO3] через соответствующие константы кислотности угольной кислоты Кa1 и Ka2 Н2СО3 + Н2О = Н3О+ + НСО3– Ka1 = 4,5 ∙10–7 Отсюда [H2CO3] = [H3O+] ∙ [HCO3–] / Ka1 HCO3– + H2O = H3O+ + CO32– Ka2 Отсюда [CO32–] = Ka2 ∙[HCO3–] / [H3O+] Тогда [H3O+] = Ka2 ∙[HCO3–] / [H3O+] ― [H3O+] ∙ [HCO3–] / Ka1 После преобразования получим: [H3O+]2 = Ka2[HCO3–] ― [H3O+]2 ∙ [HCO3–] / Ka1 = [H3O+]2 (1 + [HCO3–] / Ka1) = Ka2[HCO3–]. [H3O+]2 = Ka1 ∙ Ka2 [HCO3–] / Ka1 + [HCO3–] Поскольку [HCO3–]» Ka1 , то Ka1 + [HCO3–] = [HCO3–] Тогда [H3O+]2 = Ka1 ∙Ka2 [HCO3–] / [HCO3–] = Ka1∙ Ka2 ________ _______________ [H3O+] = √ Ka1∙ Ka2 = √ 4,4 ∙10–7 4,7 ∙10–11 = 4,55 ∙10–9 моль/л. pH = 8,34 Упражнения и задачи для самостоятельного решения 1. Напишите уравнения протолитического равновесия и укажите сопряженные кислотно-основные пары в водных растворах: а) азотистой кислоты Ко (HNO2) = 5,1×10–4; б) аммиака Кo(NH3××H2O)= 1,76×10–5; в) угольной кислоты Ко (Н2СО3 )= 4,5 ∙10–7 Ко (НСО3–) = 4,8×10–11 От каких факторов зависит стандартная константа равновесия Ко ? 2. Вычислите концентрационную константу основности аммиака Кс(NH3×H2O) и рKc(NH3×H2O) в 0,02 н растворе КС1, если рКо (NH3×H2O)=4,75. Ответ: рКс = 4,86; Кс = 1,38 ∙10–5 3. Напишите уравнения реакций автопротолиза воды и безводной уксусной кислоты. 4. Как связаны константы кислотности и основности сопряженной пары NH4 + - NH3? Приведите вывод формулы. 5. Степень диссоциации (протолиза) уксусной кислоты равна 1,32∙ 10–2, Ко(СН3СООН)= 1,75 ∙ 10–5. Определите концентрацию кислоты, концентрацию ацетат-иона и рН раствора. Коэффициенты активностей ионов принять равными 1. Ответ:рН= 2,8; [CH3COOH] = 0,15моль/л; [CH3COO–] = 1,6 ∙10–3 моль/л. 6. В О,1 М водном растворе аммиака рН=11,12. Вычислите степень диссоциации (протолиза), константу основности и концентрацию ионов аммония в данном растворе. Коэффициенты активностей ионов принять равными 1. Ответ: α = 1,32 ∙10–2; Kb = 1,75 ∙10–5; [NH4+] = 1,32 ∙10–3 7. Напишите уравнение протолитического равновесия в водном растворе нитрата аммония. Сколько граммов NH4NO3 содержится в 100 мл его водного раствора, если рН=5,12? [Ко (NH3∙H2O) =1,76∙10–5 ]. Коэффициенты активностей ионов принять равными 1. Ответ: 0,8 г 8 Рассчитайте рН раствора, полученного при смешивании 10 мл 0,1 М HNO2 и 40 мл 0,025 М КОН, если плотности растворов равны 1,00 г/мл [Ко(HNO2)=5,1×10–4]. Коэффициенты активностей ионов принять равными 1. Ответ: рН= 7,8.
|
||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 2713; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.011 с.) |







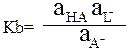


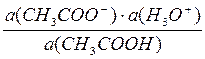

 ; Тогда: Ка·с(CH3COOH) = c(H3O+)2.Прологарифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH
; Тогда: Ка·с(CH3COOH) = c(H3O+)2.Прологарифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH сисх
сисх







