
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворы слабых электролитовСодержание книги
Поиск на нашем сайте
Пример 1 Рассчитайте степень диссоциации, рН, с(Н3О +) и с(ОН-) в водном растворе уксусной кислоты с концентрацией 0,1моль/л. рКа(СН3СООН) = 4,76.
Решение: Протолитическое равновесие: CH3COOH +H2O = CH3COO- + H3O+ Сопряжённые пары: кислота СН3СООН и сопряжённое с ней основание СН3СОО-, Основание Н2О и сопряжённая с ним кислота Н3О+. Константа протолитического равновесия- константа кислотности уксусной кислоты Ка = Для слабых электролитов ионная сила мала и коэффициент активности можно принять равным 1. Тогда: Ка = Поскольку с(СН3СОО-) =с(Н3О+) предыдущее выражение можно представить в виде: Ка = Равновесная концентрация уксусной кислоты равна исходной за вычетом концентрации, подвергнутой протолизу, т.е. сисх.- с(Н3О+)[или с(СН3СОО-), поскольку они равны] Для слабых электролитов, в растворах которых концентрация ионов очень мала можно принять сисх – с(Н3О+) Тогда: 4,76 – lg0,1 = 2pH. pH = 2,88. pOH = 14 – 2,88 = 11,12. c(H3O+) =1,32·10-3. c(OH-) = 7,59·10-12 Степень диссоциации Пример 2. Рассчитайте [HCO3-] и [CO32-] в 0,01М растворе угольной кислоты, если рН этого раствора равен 4,5. Ка1 = 4,45∙10-7 Ка2 =4,69∙10-11 .
Решение: Протолитические равновесия: 1 ступень: H2CO3 + H2O = HCO3- + H3O+ 2 ступень: HCO3- + H2O = CO32- + H3O+ pH = 4,5. Отсюда [H3O+] = 3,16∙10-5 моль/л Константа протолиза(константа кислотности) по первой ступени:
Отсюда [HCO3-] = 4,45∙ 10-7 ∙ 10-2 / 3,16∙10-5 = 1,41∙10-4 моль/л.
Отсюда [CO32-] = 4,69∙10-11 ∙ 1,41∙10-4 / 3,16∙10-5 = 2,09∙10-10 моль/л. Пример 3. Вычислите концентрационную константу кислотности уксусной кислоты в водном растворе Mg(NO3)2 с концентрацией соли 0,05 моль/л, если рКо = 4,75.
Решение: Термодинамическая константа кислотности уксусной кислоты:
Концентрационная константа кислотности уксусной кислоты:
аCH3COO- = fCH3COO- ∙[CH3COO-]; aH3O+ = fH3O+ [H3O+]; aСH3COOH = fCH3COOH∙[CH3COOH] Отсюда: Kо = Kc fCH3COO- fH3O+ / fCH3COOH∙, но поскольку для уксусной кислоты коэффициент активности практически равен 1, то Kc = Kо / fCH3COO- fH3O+ Ионная сила раствора в основном определяется сильным электролитом-солью: I = 0,5(0,05∙ 22 + 0,1∙1) = 0,15. В соответствии с таблицей: fCH3COO- = 0,79, а fH3O+ = 0,85. Если рКо = 4,75, то Ко = 1,78∙10-5 Тогда Кс = 1,78∙10-5 / 0,79∙0,85 = 2,65∙10-5 Пример 4. Рассчитайте рН 0,01М раствора молочной кислоты. Ка = 1,4 ∙ 10-4
Решение: Протолитическое равновесие: CH3CH(OH)COOH + H2O = CH3CH(OH)COO- + H3O+ Для слабых электролитов, у которых степень протолиза > 5%, уже нельзя считать концентрацию молекул, не подвергнутых протолизу, равной исходной концентрации электролита. Поэтому для молочной кислоты: [CH3CH(OH)COOH] = [CH3CH(OH)COOH] исх. - [H3O+] Тогда: Ka = [H3O+] [CH3CH(OH)COOH] / [CH3CH(OH)COOH] = [H3O+]2 / [CH3CH(OH)COOH] исх. – [H3O+] [H3O+]2 + Ka[H3O+] - Ka[CH3CH(OH)COOH] исх. = 0
[H3O+] = 0,5 (-Ka + √ Ka2 + 4Ka[CH3CH(OH)COOH] исх.;
pH = 2,9
Пример 5. Рассчитайте рН раствора HCN с концентрацией 10-6 моль/л. Ка = 6,2 ∙10-10
Решение: Для слабых электролитов с концентрацией < 10-4 моль/л, у которых константа протолиза < 10-8 необходимо учитывать автопротолиз воды. Протолитическое равновесие: HCN + H2O = CN- + H3O+ Уравнение электронейтральности: [H3O+] = [CN-] + [OH-]; [OH-] = Kw/ [H3O+]; Ka = [H3O+] [CN-] / [HCN]; [CN-] = Ka [HCN] / [H3O+]; Так как очень слабая, можно считать: [HCN] = [HCN] исх. Тогда: [H3O+] = Ka [HCN]исх. / [H3O+] + Kw/[H3O+]; [H3O+]2 = Ka [HCN]исх. + Kw;
[H3O+] = √ Ka [HCN]исх. + Kw = √ 6,2 ∙ 10-10 ∙ 10-6 + 10-14 = 1,03 ∙ 10-7 моь/л . pH = 6,99. Пример 6. Рассчитайте рН раствора ацетата натрия с концентрацией 0,1 моль/л, а также степень протолиза(гидролиза) этой соли. Ка(СН3СООН) = 1,75 ∙10-5.
Решение: Протолитическое равновесие: CH3COO- + H2O = CH3COOH + OH- Константа протолиза(константа основности иона ацетата): Kb = [CH3COOH] [OH-] / [CH3COO-] [CH3COOH] = [OH-] а) Для приближенных расчетов можно считать, что [CH3COO-] = [CH3COO-] исх. б) Для точных расчетов: [CH3COO-] = [CH3COO-] исх. - [OH-]
Kb = Kw/ Ka = 10-14 / 1,75 ·10-5 = 5,75 ·10-10 а) Kw/Ka = [OH-]2 / [CH3COO-]; [OH-]2 = Kw/Ka [CH3COO-]; 2pOH = -lgKw + lgKa - lg[CH3COO-] = -lg10-14 + lg1,75 ∙10-5 - lg 0,1 = 10,24. pOH = 5,12. pH = 14 - 5,12 = 8,88. б) Kw/Ka = [OH-]2 / ([CH3COO-] исх. – [OH-]); [OH-]2 = Kw/Ka ([CH3COO-] исх. – [OH-]); [OH-]2 = 5,75 · 10-10 (0,1 – [OH-]); Пусть [OH-] = x. x2 + 5,75·10-10 x - 5,75 ·10-10 · 0,1 = 0; x = 7,6 ·10-6; [OH-] = 7,6 ·10-6 моль/л; рОН = 5,12. pH = 8,88. Степень гидролиза соли: h = [OH-] / [CH3COO-] исх. = 7,6 ·10-6 / 10-1 = 7,6 ·10-5 = 0,0076%. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Напишите уравнения протолитического равновесия и укажите сопряженные кислотно-основные пары в водных растворах: а) азотистой кислоты Ко (HNO2) = 5,1×10-4; б) аммиака Кo(NH3××H2O)= 1,76×10-5; в) угольной кислоты Ко (Н2СО3 )= 4,5 • 10-7 Ко (НСО3-) = 4,8×10-11 От каких факторов зависит стандартная константа равновесия Ко ? 2.Вычислите концентрационную константу основности аммиака Кс(NH3×H2O) и рKc(NH3×H2O)в 0,02 н растворе КС1, если рКо (NH3×H2O)=4,75. 3. Напишите уравнения реакций автопротолиза воды и безводной уксусной кислоты. 4. Как связаны константы кислотности и основности сопряженной пары NH4 + - NH3? Приведите вывод формулы. 5. Степень диссоциации уксусной кислоты равна 1,32 • 10-2,Ко= 1,75 • 10-5. Определите концентрацию кислоты, концентрацию ацетат-иона и рН раствора. Коэффициенты активностей ионов принять равными 1. 6. В О,1 М водном растворе аммиака рН=11,12. Вычислите степень диссоциации, константу основности и концентрацию ионов аммония в данном растворе. Коэффициенты активностей ионов принять равными 1. 7. К 50 мл 0,1 М раствора муравьиной кислоты (р=1,00 г/мл) добавили 50 мл 0,01 М раствора соляной кислоты (р=1,00 г/мл). Определите рН и степень диссоциации муравьиной кислоты в полученном растворе (р=1,00 г/мл), если К о(НСООН)= 1,37×10-4? Коэффициенты активностей ионов считать равными 1. 8. Напишите уравнение протолитического равновесия в водном растворе нитрата аммония. Сколько граммов NH4NO3 содержится в 100 мл его водного раствора, если рН=5,12? [Ко (NH3H2O) =1,76 •10-5 ]. Коэффициенты активностей ионов принять равными 1. 9. Рассчитайте рН раствора, полученного при смешивании 10 мл 0,1 М HNO2 и 20 мл 0,05 М КОН, если плотности растворов равны 1,00 г/мл [К о (HNO2). =5,1×10-4]. Коэффициенты активностей ионов принять равными 1. БУФЕРНЫЕ РАСТВОРЫ Пример 1. Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 -)= 7,2.
Решение: рН буферного раствора равно: рН = рКа + lg Определяем ионную силу раствора. KH2PO4 = K+ +H2PO4- Na2HPO4 = 2Na+ + HPO42- 0,05 0,05 0,05 (моль) 0,1 0,2 0,1 (моль) Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л. Концентрации ионов в буферном растворе равны:
c(H2PO4-)= Ионная сила J= 0,5 (0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15. По таблице находим коэффициенты активности f ионов. f(H2PO4-) =0,81. f(HPO42-) = 0,41.Рассчитываем рН данного буферного раствора: pH= Пример 2 Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76. Ионная сила раствора J= 0,1. Решение: Коэффициент активности нейтральных молекул можно принять равными 1, а f(NH4+) = 0,81 в соответствии с ионной силой. pН данной буферной системы равно: рН = рКа(NH4+) + lg pKa(NH4+) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л. c(NH3·H2O) = Подставляем полученные данные в уравнение для рН буферной системы: 9,54 = 9,24 + lg
V(NH3·H2O) = 90мл V(NH4Cl) = 110мл
Пример 3 а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76. б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте. в) Рассчитайте рН данной буферной системы после добавления 10 мл1М NaOH и буферную ёмкость по щёлочи. Решение: а) рН ацетатной буферной системы равна: рН= 4,76 + lg Концентрации буферных кислоты и основания равны: c(CH3COO-) = с(СH3COOH) = Для определения коэффициента активности определяем ионную силу: J=0,5(0,05 + 0,05)= 0,05. Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем в виду их малости. Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84. Рассчитываем рН буферной системы: pН = 4,76 + lg б) При добавлении соляной кислоты протекает реакция: CH3COO- + H3O+ = CH3COOH +H2O, 0,02 0,01 0,01 моль В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01·1 = 0,01моль. При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия). В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль, а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль. Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним. Тогда рН = 4,76 + lg Буферная ёмкость по кислоте равна: Bк = в) При добавлении щёлочи в буферную систему протекает реакция: CH3COOH + OH- = CH3COO- + H2O 0,02 0,01 0,01 моль В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01·1моль. При этом сильное основание ОН- заменяется в эквивалентных количествах на слабое(буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало: 0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84. Тогда рН = 4,76 + lg Буферная ёмкость по щёлочи равна: Вщ = ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Напишите уравнения протолитических равновесии в следующих буферных растворах: а) уксусная кислота и ацетат натрия; б) угольная кислота и гидрокарбонат натрия; в) аммиак и хлорид аммония; г) дигидрофосфат калия и гидрофосфат натрия. 2. Рассчитайте рН буферного раствора, содержащего 0,01 моль КН2 РО4. и 0,02 моль Na2 НРО4 в 500 мл раствора [Ка(H3PO4) =7,1 • 10-3,Ка (H2PO4-) = 6,2×10-8, Kа (HPO42-) = 5,0 ×10 –13 ]. Какие реакции будут протекать при добавлении к этому раствору небольшого количества КОН или HNO3? Объясните механизм буферного действия. 3. Какие объёмы 0,2 М NH3 и 0,5 М NH4NO3 необходимовзять для приготовления 200 мл буферного раствора с рН=8,16 [Кв (NH3 ×H2O) =1,76 ×10-5] Вычислите рН после добавления в этому раствору 5 мл 0,2 М НС1 и напишите уравнения протекающих реакций. Плотности растворов считать равными 1,00 г/мл. 4. Рассчитайте молярное соотношение основания и сопряженной кислоты в буферном растворе, содержащем СН3 СООН и СН3 COONa, рН которого равен 4,86 [Ка(СН3СООН) =1,76 • 10-5 ].Какова буферная ёмкость этого раствора по кислоте ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Пример1. Рассчитайте растворимость фосфата бария, если ПР(Ba3(PO4)2) = 6,3·10-39.
Решение: Ba3(PO4)2 = 3Ba2+ + 2PO43- Если s- растворимость фосфата бария, то: [Ba2+]= 3s, [PO43-] = 2s. ПР = (3s)3 (2s)2 = 108s5 = 6,3 ·10-39.
Отсюда s = √ 6,3 ·10-39 / 108 = 9 10-9 моль/л.
1. Дайте определение понятиям: «произведение растворимости», «растворимость». 2. Вычислите произведение растворимости хромата серебра, если в 500 мл воды при 25°С растворяются 0,011 г Аg2 СгО4. 3. Произведение растворимости АgС1 равно 1,810-10 Вычислите растворимость соли (моль/л и г/л) в воде и 0,01М КС1. Коэффициенты активностей ионов принять равными 1. 4. Смешали 10 мл 0,01М раствора СаС12и 40 мл 0.01М раствора оксалата аммония (NH4)2C2O4. Выпадет ли осадок оксалата кальция, если ПР(CaC2O4) =2 10-9? 5. В раствор, содержащий 0,01 моль/л BaCl2, и 0,01 моль/л SrCl2, медленно добавляют раствор сульфата натрия. Какой осадок выпадет первым, если ПР(BaSO4) =1,1 10-10; ПР(SrSO4)=3,2 • 10-7?
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 898; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.91.111 (0.011 с.) |



 ; Ка·с(CH3COOH) = c(H3O+)2. Прологорифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH
; Ка·с(CH3COOH) = c(H3O+)2. Прологорифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH сисх.
сисх.





 [H3O+] = 0,5 (-1,4 ∙10-4 + √ (1,4 ∙ 10-4)2 + 4 ∙ 1,4 ∙10-4 ∙ 10-2) = 1,12∙ 10-3 моль/л..
[H3O+] = 0,5 (-1,4 ∙10-4 + √ (1,4 ∙ 10-4)2 + 4 ∙ 1,4 ∙10-4 ∙ 10-2) = 1,12∙ 10-3 моль/л..


 )=
)=  моль/л c(Na
моль/л c(Na  )=
)=  = 0,08моль/л
= 0,08моль/л = 0,03 моль/л c(HPO42-)=
= 0,03 моль/л c(HPO42-)= 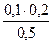 = 0.04 моль/л
= 0.04 моль/л
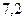 +lg
+lg 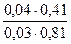 = 7,03.
= 7,03.

 =x(моль/л) c(NH4+)=
=x(моль/л) c(NH4+)=  =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л. lg
lg 
 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл  90мл.
90мл.
 моль/л
моль/л


 моль/л.
моль/л.
 моль/л.
моль/л.



