
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 8. Растворы электролитовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
По способности проводить электрический ток в водном растворе или в расплаве вещества делятся на электролиты и неэлектролиты. Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи. Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся, например, кислород, водород и многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи. Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887). 1. Молекулы электролитов при растворении или расплавлении распадаются на ионы (электролитическая диссоциация). Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд. 2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы – анионами. К катионам относятся: ион водорода Н+, ион аммония NH4+, ионы металлов Na+, K+, Fe2+, А13+, катионы основных солей CuOH+, А1(ОН)2+, FeOH2+ и т.д. К анионам относятся: гидроксид-ион ОН–, ионы кислотных остатков Сl– NO3–, SO42–, Сг2О72–, анионы кислых солей НСО3–, Н2РО4– и т.д. 3. Диссоциация – процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация). Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости (
Каждая молекула гидроксида аммония диссоциирует на ион аммония и ион гидроксида. Следовательно, в результате диссоциации одной молекулы образуется два иона. Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (т.к. растворы электролитов электронейтральны). Механизм электролитической диссоциации. Гидратация ионов. Причины и механизм диссоциации электролитов объясняются химической теорией растворов Д. И. Менделеева и природой химической связи. Растворители, в которых происходит диссоциация, состоят из полярных молекул (вода). Химическая теория растворов основана на представлении об определяющей роли явления сольватации при растворении веществ. Сольватация – процесс химического взаимодействия частиц растворенного вещества с молекулами растворителя, приводящий к образованию сольватов (гидратов, если растворителем является вода). Диссоциация электролитов с ионной и полярной связями протекает не одинаково. В растворах электролитов все ионы находятся в гидратированном состоянии. Растворение электролита можно представить в виде процесса, включающего следующие стадии: 1) ориентация вокруг частиц растворенного вещества полярных молекул растворителя; 2) поляризация молекул (частиц) растворенного вещества под действием полярных молекул растворителя; 3) разрыв связей между частицами растворенного вещества с образованием сольватированных ионов. Степень диссоциации. В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде. Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации). Степень электролитической диссоциации (a) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
где n – число молекул, распавшихся на ионы; N – общее число растворенных молекул. В зависимости от значения степени диссоциации все электролиты условно делят на три группы: a > 30% – сильные, a < 3% – слабые и средней силы 3% < a < 30%. Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов. В первом приближении можно сказать, что в воде диссоциируют полностью те вещества, в молекуле которых имеется ионная связь. Если связь полярная, то диссоциация будет частичной, а если связь неполярная, то диссоциация будет отсутствовать. При уменьшении концентрации слабого электролита, т.е. при разбавлении раствора, степень диссоциации увеличивается. При повышении температуры степень диссоциации, как правило, увеличивается. Константа диссоциации (ионизации). Для характеристики слабых электролитов применяют константу диссоциации (К д). В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами:
Применяя закон действующих масс, запишем выражение константы равновесия:
где [ Am +], [ Bn –] и [ AnBm ] – равновесные концентрации ионов Аm + и Вn – и недиссоциированных молекул AnBm,соответственно. Для слабого электролита константа диссоциации – постоянная величина, не зависящая от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Кислоты, основания и соли в свете теории диссоциации электроли- тов. Амфолиты. В свете теории электролитической диссоциации приняты следующие определения классов веществ: · кислотой называется соединение, диссоциирующее в водном растворе на ионы водорода и ионы кислотного остатка: HNO3 → H+ + NO3–; · oснованием называется соединение, диссоциирующее в водном растворе на ионы гидроксильных групп и ионы металла (или ион аммония): Ba(OH)2 → Ba2+ + 2OH–; · солями называются соединения, диссоциирующие в водном растворе на ионы металла и ионы кислотного остатка: Na2SO4 → 2Na+ + SO42–. Если при растворении соли в растворе присутствуют ионы водорода, ионы металла и ионы кислотного остатка, то такая соль называется кислой. Если при растворении соли в растворе присутствуют ионы гидроксильных групп, ионы металла и ионы кислотного остатка, то такая соль называется основной. Существуют электролиты, способные диссоциировать и как кислоты (с отщеплением ионов водорода), и как основания (с отщеплением гидроксильных групп): 2H+ + ZnO22– ← Zn(OH)2 → Zn2+ + 2OH– 2H+ + 2OH– ← 2HOH → H3O+ + OH– или HOH → H+ + OH–. Такие электролиты называются амфолитами. Ионное произведение воды, рН раствора. Для реакции диссоциации воды HOH ↔ H+ + OH– константа равновесия определяется следующим уравнением: К = [H+] [OH–] / [H2O]. Концентрация воды в водных растворах практически не меняется и вводится в константу равновесия (Кw). Кw = [H+] [OH–] = К [H2O]. Полученную константу (Кw) для воды называют ионным произведением воды,которое зависит только от температуры (Кw = 10–14). При диссоциации воды на каждый ион Н+ образуется один ион ОН–. Следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–]. Используя значение ионного произведения воды, находим [Н+] = [ОН–] = Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10–7 моль/л, в нейтральных [Н+] = 10–7 моль/л, в щелочных [Н+] < 10–7 моль/л. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода,называя эту величину водородным показателем и обозначая ее рН: рH = –lg[H+]. В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7. Взаимосвязь между константой и степенью диссоциации. В. Оствальдом при a << 1 получено уравнение (закон разбавления) a = (К д / С)1/2, из которого следует, что с увеличением разбавления, т.е. уменьшения концентрации, степень диссоциации возрастает. Ступенчатая диссоциация. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, последовательно отщепляя ионы водорода или ионы гидроксильных групп. Каждая ступень диссоциации характеризуется своим значением константы диссоциации. Легче всего происходит отщепление первого иона. Активность электролитов. Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами. Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный так называемый изотонический коэффициент (i), например: πосм. = iCRT, Δ T зам. = iKm или Δ T кип. = iЕm. Изотонический коэффициент связан со степенью диссоциации электролита: i = 1+ (n -1) α, где n – количество ионов, образующихся при диссоциации одной молекулы. Термодинамические свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона ai выражается в виде произведения концентрации иона с i на его коэффициент активности γ i: ai = γ i сi. Экспериментально определить можно только среднюю активность катиона a + и аниона a –. Коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от присутствия и других ионов, т.е. от ионной силы (I) раствора: I = 0,5Σ cizi 2, где zi – заряд иона (в единицах заряда протона); сi – его молярная концентрация. Таким образом, активность и коэффициент активности учитывают межионное взаимодействие в растворе.
Химическая реакция – взаимодействие реальных частиц (молекул, ионов, атомов), которое приводит к изменению их физико-химических свойств без изменения природы химических элементов. В ходе химической реакции одни вещества (исходные, реагенты) превращаются в другие (продукты реакции). Реакции неорганической химии классифицируются по признаку изменения числа реагентов и продуктов: – реакции разложения, в которых из одного исходного вещества образуется несколько продуктов: Mg(OH)2 – реакции соединения, в которых из нескольких реагентов образуется один продукт: 2Fe + 3Cl2 Реакции замещения – реакции, в которых часть сложного вещества замещается простым веществом: CuSO4 + Fe ® FeSO4 + Cu; 2KBr + Cl2 ® Реакции обмена – реакции, в которых реагенты обмениваются своими составными частями: AgNO3 + NaBr ® NaNO3 + AgBr¯. Если в обмене участвуют протоны и гидроксильные группы, то такие реакции называют кислотно-основными, или реакции нейтрализации: 2KOH + Одна и та же реакция может относиться одновременно к разным типам, в зависимости от признака, по которому проводят классификацию. В отдельный класс выделяют окислительно-восстановительные реакции, сопровождающиеся переносом электронов и приводящие к изменению степеней окисления атомов, входящих в состав реагентов: 2HCl + Zn ® ZnCl2 + H2; Сl2 + H2O ® HСl + HOCl. Степень окисления. Степень окисления – условный (формальный) заряд атома в соединении, вычисленный, исходя из предположения, что все атомы в молекуле являются ионами, а сама молекула электронейтральна. Атомы более электроотрицательных элементов имеют отрицательную степень окисления, а менее электроотрицательных – положительную. Все атомы можно разделить на три группы: атомы с постоянной степенью окисления; атомы, имеющие преобладающую степень окисления; атомы с переменной степенью окисления. К первой группе относятся атомы щелочных металлов (+1), щелочноземельных (+2), алюминия (+3) и фтора (-1). Ко второй можно отнести атомы водорода (почти всегда +1, но в соединениях со щелочными и щелочноземельными металлами -1); кислорода (как правило, -2, но в соединении со фтором +1 и +2, а в пероксидах -1). Сюда же можно отнести и атомы железа, имеющие две наиболее распространенные степени окисления (+2 и +3). Степень окисления остальных атомов зависит от их химического окружения. При определении степени окисления атомов в молекуле рекомендуется следующий порядок действий: 1. Установить степень окисления атомов, у которых она неизменна. 2. Сделать заключение о степени окисления атомов, имеющих преобладающую степень окисления. 3. Степень окисления оставшихся атомов определить математически, исходя из электронейтральности молекулы. Необходимо помнить также и следующее: а) степень окисления атомов в молекулах простых веществ (H2, C, O3) равна нулю; б) металлы во всех соединениях имеют только положительные степени окисления; в) степень окисления атома неметалла в соли всегда равна его степени окисления в соответствующей кислоте. Максимальная (высшая) степень окисления элемента (СОmax), как правило, равна номеру группы, в которой находится элемент в периодической системе (исключения: кислород, фтор, элементы подгруппы меди). Низшая (минимальная) степень окисления металлов равна нулю. Разные атомы одного и того же элемента, входящие в состав одной молекулы, могут иметь разные степени окисления. Такая ситуация наиболее распространена в органической химии. Окислитель – это вещество, содержащее элемент, который принимает электроны, при этом степень окисления этого элемента понижается. В результате реакции окислитель восстанавливается. В качестве окислителя в процессах электролиза выступает анод. Восстановитель – вещество, содержащее элемент, который отдает электроны, при этом степень окисления этого элемента повышается. В результате реакции восстановитель окисляется. В качестве восстановителя в процессах электролиза выступает катод. Так, в реакции 2FeCl3 + 2KI ® I2 + 2FeCl2 + 2KCl окислителем является Fe3+, а восстановителем – ион I-: Fe3+ + 1 e = Fe2+; 2I– = I2 + 2 e. Последние два уравнения называются полуреакциями. Окисленная (ox) и восстановленная (red) формы, участвующие в полуреакции, составляют так зываемую редокс-пару. Соединения, содержащие атом какого-либо элемента в низшей возможной степени окисления, будут за счет этого элемента только восстановителями. Напротив, соединения элемента, находящегося в высшей возможной степени окисления, будут за счет этого элемента только окислителями. Окислительно-восстановительные реакции бывают: 1) межмолекулярные, в которых степени окисления изменяют атомы разных молекул; 2) внутримолекулярные, в которых изменяют степени окисления атомы, входящие в состав одной молекулы; 3) диспропорционирования, в которых окислитель и восстановитель – атом одного и того же вещества. Направление течения окислительно-восстановительной реакции определяется на основании разности редокс-потенциалов (∆Е) (см. лекцию 10). Пользуясь таблицами редокс-потенциалов, определяют разность стандартных потенциалов ∆Е, которая должна быть величиной положительной. Величина ∆Е и изменение энергии Гиббса для данной окислительно-восстановительной реакции связаны соотношением D G 0298 = -nF ∆Е. Для составления уравнений окислительно-восстановительных реакций применяют два метода: электронного баланса и полуреакций. Основным требованием обоих является то, что число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. В методе электронного баланса сначала определяют степень окисления каждого атома и затем составляют схемы, отражающие процесс передачи электронов. После этого подбирают множители по правилу нахождения общего кратного, которые и будут представлять собой коэффициенты при окислителе и восстановителе. Рассмотрим окислительно-восстановительную реакцию: KMnO4 + HCl ® Cl2 + MnCl2 + KCl + H2O
2KMnO4 + 10HCl ® 2MnCl2 + 5Cl2 + KCl + H2O. Теперь уравниваем количество атомов, не участвующих в окислительно-восстановительной реакции: а) ионов металлов, не изменивших степени окисления (калий): 2KMnO4 + 10HCl ® 2MnCl2 + 5Cl2 + 2KCl + H2O; б) ионов кислотных остатков (в данной реакции хлорид-ионов): KMnO4 + 10 HCl + 6 HCl → 5 Cl2 + 2MnCl2 + 2 KCl + H2O; в) ионов водорода: 2KMnO4 + 16HCl ® 5Cl2 + 2KCl + 2MnCl2 + 8H2O. В заключение можно проверить правильность расстановки коэффициентов подсчетом общего количества атомов кислорода слева и справа. В методе полуреакций коэффициенты окислительно-восстановительных реакций определяют с учетом конкретной формы ионов, участвующих в процессе. Преимуществом метода является отсутствие необходимости пользоваться понятием степени окисления. Кроме того, он позволяет учесть влияние среды реакции на характер процесса. Кислотность среды влияет на изменение степеней окисления атомов, например, продукты восстановления перманганат-иона в разных средах можно представить следующей схемой:
В полуреакции восстановления окислителя слева записывают ион MnO4–, а справа Mn2+. Освобождающийся кислород в кислой среде связывается в четыре молекулы H2O, для образования которых в левую часть полуреакции необходимо добавить восемь катионов водорода. Уравняв количество атомов элементов в левой и правой частях полуреакции, подсчитывают суммарный заряд ионов слева и справа и вычисляют количество электронов, принятых окислителем, исходя из того, что сумма зарядов слева должна быть равна сумме зарядов справа.
Аналогично можно записать полуреакцию окисления восстановителя:
Далее, как и в методе электронного баланса, находят наименьшее кратное и дополнительные множители:
Затем суммируют обе полуреакции и после сокращения одинаковых слагаемых (H2O и H+) получают сокращенное ионное уравнение окислительно-восстановительной реакции, коэффициенты из которого переносят в молекулярное уравнение:
В молекулярной форме это взаимодействие описывается уравнением (с учетом одной дополнительной молекулы K2SO4 за счет двух ионов К+ из KMnO4) 2KMnO4 + 5K2SO3 + 3H2SO4 ® 2MnSO4 + 6K2SO4 + 3H2O. Метод полуреакций применим лишь для описания и подбора коэффициентов окислительно-восстановительных процессов, протекающих в растворах. Метод же электронного баланса позволяет установить стехиометрические отношения в любых реакциях окисления–восстановления, независимо от среды. Лекция 10. Электрохимия. Электродный потенциал Возникновение электродного потенциала металла. Электроны в металле занимают энергетические уровни, образующие зоны. Эти зоны расположены ниже уровня энергии свободного электрона. Если мы хотим удалить электрон из металла - перенести его от нижнего края зоны проводимости до уровня свободного электрона, мы должны затратить работу. Эта работа называется внешней работой выхода электрона. Если два разных металла приведены в тесное соприкосновение - контакт, то определенное количество электронов переходит от того металла, у которого работа выхода меньше, к тому, у которого она больше, в результате чего один металл зарядится отрицательно, а другой положительно. Это явление лежит в основе возникновения контактной разности потенциалов. Погрузим теперь металл в любой раствор электролита или в воду. Кристаллическая решетка металлов образована катионами, между которыми движутся нелокализованные электроны. Характер взаимодействия полярных молекул воды (растворителя) с катионами решетки металла зависит от энергии его кристаллической решетки (энергии сублимации и ионизации атомов) и энергии гидратации его ионов. При этом может два возможных случая. Первый случай. Если энергия гидратации (Егидр) больше энергии кристаллической решетки (Е кр.р.), то более вероятен процесс отрыва от поверхности металла положительных ионов, которые взаимодействуют с полярными молекулами воды и в гидратированном состоянии переходят в раствор. Поверхность металла приобретает отрицательный заряд, а слой раствора, примыкающий к ней - положительный. Переход первых катионов металлов требует меньшей затраты энергии, чем удаление последующих, т.к. поверхность металла уже приобрела отрицательный заряд. По мере увеличения концентрации катионов в растворе у поверхности, вероятность выхода ионов из металла уменьшается, а вероятность входа их в металл (адсорбция) из раствора увеличивается. Если скорости этих процессов сравниваются, то устанавливается динамическое равновесие на границе металл-раствор. Между отрицательно заряженным металлом и положительно заряженным раствором возникает двойной электрический слой, строение которого напоминает строение конденсатора, между обкладками которого существует разность потенциалов, называемый в электрохимии равновесный потенциал. Согласно Конвенции Международного Союза химиков потенциалу условились приписывать тот знак, который возникает на поверхности металла в двойном электрическом слое. Схематически этот процесс можно изобразить так: окисление M + mH2O = [Mn+(H2O)m] + ne в растворе на металле Такое поведение металла в растворе электролита характерно для активных металлов (Mg, Zn, Fe, Ni...) Второй случай. Если энергия гидратации будет меньше энергии кристаллической решетки металла (это характерно для неактивных металлов: Cu, Hg, Bi), то преобладает процесс адсорбции катионов из раствора на поверхности электрода, заряжая его положительно; раствор же заряжается отрицательно за счет избытка аниов соли. На границе двух фаз металл-электролит также возникает двойной электрический слой с определенным электродным потенциалом. На примере медной пластины в растворе сульфата меди процесс схематично можно изобразить следующим образом: [Cu] + Cu2+ + SO42- = [Cu]Cu2+ + SO42- на металле в растворе Если индифферентный - нерастворимый, например платиновый электрод погружен в электролит, содержащий окислитель и восстановитель (редокс-) систему, то в такой системе протекает два электродных процесса, или две окислительно-восстановительные полуреакции, сопровождающиеся переходом электронов между участвующими в реакции молекулами или (и) ионами. В общем виде этот процесс может быть изображен: Ох + ne ↔Red, где Ox и Red - окисленная и восстановленная формы частицы или частиц, n- число электронов, участвующих в реакции. Для раствора содержащего одновременно ионы Fe+3 и Fe+2, вышеприведенная реакция запишется следующим образом: Fe+3 + е ↔ Fe+2 . В данном случае материал электрода служит переносчиком электронов. Электрод отдает окислителю или принимает электроны от восстановителя в растворе. Окислительно-восстановительный потенциал, возникающий в таких системах, зависит от природы редокс-реакции и от концентрации обоих электроактивных соединений, а также от других веществ, например концентрации ионов водорода, и не зависит от материала электрода. Измерение потенциала металла. Электрод сравнения. Непосредственно измерить абсолютную величину потенциала электрода в настоящее время не представляется возможным. Ее измеряют относительно величины другого электрода - электрода сравнения, потенциал которого принято считать постоянным при стандартных условиях. В электрохимии принято в качестве электрода сравнения используют водородный электрод, потенциал которого условно принят за нуль. Он состоит из платиновой пластины, покрытой платиновой чернью и погруженной в раствор H2SO4, где [H+] = 1 моль/л, давление газообразного водорода 101,325 кПа, температура 25 оС. На границе раздела фаз устанавливается равновесие: 1/2 Н2 + Н2О = Н3О+ + е Схему водородного электрода обозначают так: H+ │ H2, Pt Если составить электрическую цепь из водородного электрода и пластины металла, опущенную в раствор своей соли, где концентрация ионов металла равна 1 моль/л при стандартных условиях, то возникшая разность потенциалов электродвижущая сила (э.д.с.) будет являться величиной стандартного электродного потенциала металла (Е0). Например: цинковая пластина опущена в 1-молярный раствор своей соли и соединена со стандартным водородным электродом: схема: Zn │ Zn2+│ H2S4 │ H2, Pt (+) В элементе осуществляется реакция: Zn + 2H+ = Zn2+ + H2 Электроны по внешней цепи движутся от цинкового к водородному электроду. Стандартный электродный потенциал цинкового электрода равен -0,763 В. Взяв в качестве электрода медь при тех же условиях в сочетании со стандартным водородным электродом, получим электрическую цепь из двух полуэлементов,которую можно изобразить в виде схемы: (-) Pt, H2 │ H2SO4││ Cu2+ │ Cu (+) Его э.д.с., а следовательно, и стандартный электродный потенциал (Е0) меди равны +0,34 В. В этом случае протекает реакция Cu2+ + H2 = 2H+ + Cu, а электроны во внешней цепи движутся от водородного электрода к медному. Потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры. Эта зависимость выражается уравнением Нернста: E = E0 + RT/nF ln C или при температуре 298 К E = E0 +0,059/n lg Cмет. где R - универсальная газовая постоянная равная 8,31 Дж/моль К, Т - температура в Кельвинах, n - число электронов участвующих в реакции, F - постоянная Фарадея равная 96500 Кл, E0 – стандартное значение электродного потенциала, который равен электродному потенциалу при концентрации электроактивной частицы равной 1 моль/л. Потенциал окислительно-восстановительной системы: Ох + ne +z H+ ↔ Red определяется аналогичным образом, а зависимость от концентрации обоих электроактивных соединений и концентрации ионов водорода выражается уравнением: E=E0 +0,059/n lg (СОх СH+z)/СRed. Ряд стандартных электродных потенциалов металлов (ряд напряжений). Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов (Е0) получают ряд стандартных электродных потенциалов металлов в водных растворах или ряд напряжений металлов. Ряд напряжений характеризует: 1.Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность металла и тем ниже окислительная способность его ионов. 2.Каждый предыдущий металл, т. е. расположенный в ряду напряжения левее или имеющий меньший стандартный потенциал, вытесняет последующие металлы из водных растворов их солей. Например: Mg + NiSO4=MgSO4 + Ni; 3.Все активные металлы, т.е. расположенные в ряду до водорода, вытесняют водород из кислот, где он выполняет функцию окислителя (HCl разб. и конц.; H2SO4 разб.). 2HCl + Zn = ZnCl2 + H2 4.Большой энергией гидратации иона Li(-515 кДж/г-ат) обусловливается высокоотрицательное значение его потенциала (Е0 = -3,045 B) в сравнении с Na, K и даже Cs (E0 = - 2,923 B). Это относится и к кальцию, который активнее в растворе, чем натрий.
Электрохимия –естественнонаучная дисциплина, котораяизучает физико-химические свойства ионных растворов и расплавов, а также явления, которые протекают на границе раздела фаз с участием заряженных частиц. Химические источники тока (ХИТ) – это устройства, в которых энергия химической реакции преобразуется в электрическую. В гальванических элементах могут использоваться только те реакции, которые идут самопроизвольно и для Δ G < 0. При погружении цинковой пластинки в раствор сульфата меди самопроизвольно протекает реакция Zn + CuSO4 = ZnSO4 + Cu в результате, которой атомы цинка окисляются, а ионы меди восстанавливаются. При таком проведении процесса энергия химической реакции превращается в тепловую энергию, но если провести процессы окисления и восстановления раздельно и осуществить передачу электронов через внешнюю цепь, можно использовать энергию химической реакции для совершения работы. Активные вещества (окислители и восстановители) в совокупности с электролитом и электродами образуют электрохимическую систему (гальванический элемент (ГЭ)), которая условно изображается следующим образом: (–) вещество (1)! электролит (1)!! электролит (2)! вещество (2) (+). Электрохимическая реакция протекает на границе раздела фаз между электродом и электролитом. Одним из наиболее простых ГЭ является элемент Даниэля–Якоби,состоящий из двух электродов – цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди. Вся совокупность этих процессов выражается уравнением полуреакции: Zn – 2 е – = Zn2+ Е 0 = –(–0,76) В Cu2+ + 2 e – = Cu Е 0 = +0,34 В. Общий процесс является суммой процессов, протекающих на отдельных электродах: Zn + Cu2+ = Zn2+ + Cu. Схематическое изображение элемента Даниэля–Якоби имеет вид (–) Cu Zn! ZnSO4!! CuSO4! Cu (+). Электрический ток, протекающий по внешней цепи ГЭ, может производить полезную работу (А), которая определяется произведением количества прошедшего по цепи электричества (Q = It, где I – ток; t – время) на напряжение (V), измеренное на концах гальванического элемента: A = I t V. Максимальное значение напряжения ГЭ, соответствующее обратимому протеканию реакции, называется электродвижущей силой (эдс – Δ Е), которая для элемента Даниэля–Якоби равна Δ Е = 0,34 – (–0,76) = 1,1 В. Между эдс (Δ Е) гальванического элемента и энергией Гиббса химической реакции имеется простая связь, которая выражается уравнением –Δ G = nF Δ Е. Компонентами сухого марганцово-цинкового элемента являются твердые вещества или влажные пасты, помещенные в плотно закрывающую их оболочку. Роль анода играет цинковая оболочка самого элемента. Вокруг угольного стержня, являющегося катодом, расположена паста, состоящая из MnO2, NH4Cl и H2O. На аноде происходит окисление цинка до Zn2+, а на катоде – восстановление MO2 до Mn3+, который образует смесь нескольких соединений. Схематическое изображение марганцево-цинкового элемента следующее: (–)Zn NH4Cl, H2O MnO2(+); анод: Zn – 2 e – = Zn2+ Е 0 = –(–0,76) В катод: 2MnO2 + 8NH4+ + 2 e – = 2Mn3+ + 4H2O + 8NH3 Е 0 = +1,25 В, Δ Е = +0,76 + 1,25 = 2,01 В. ГЭ могут обладать свойством обратимости: это означает, что если к элементу приложить внешнее напряжение, которое превышает собственное напряжение элемента, то протекающие в нем реакции могут пойти в обратном направлении, и таким образом удается запасти в элементе электрическую энергию. ГЭ, работоспособность которых после разряда может быть восстановлена путем заряда, называются аккумуляторами. Обратимым является элемент Даниэля–Якоби. Для того чтобы элемент можно было перезарядить, электродные продукты должны оставаться вблизи электродов и допускать обратное превращение при зарядке элемента. Примером такого элемента является свинцовый аккумулятор, который схематически изображается следующим образом: (–)Pb!H2SO4!! PbO2(+) В качестве анода в нем используется пластина из пористого свинца, который окисляется в сульфат свинца, Аналогично при восстановлении на катоде оксида свинца в сульфат свинца продукт восстановления остается на месте. анод: Pb – 2 e – = Pb2+ Е 0 = –(–0,13) В; катод: PbO2 + 2 e – + 4H+ + SO42- = PbSO4 + 2H2O Е 0 = +1,69 В; Δ Е = 1,69 – (–0,13) = 1,82 В. Если последовательно соединить несколько таких элементов, получатся аккумуляторные батареи, дающие напряжение 6 или 12 В. После того как произойдет разрядка свинцового аккумулятора, его можно перезарядить, в результате чего сульфат свинца превращается в свинец и оксид свинца. Топливные ХИТ в своей работе преобразуют химическую энергию реакции горения какого-то вещества в кислороде в электрическую, например 2H2 +O2 = 2H2O. Газообразный кислород и водород пропускается у соответствующих электродов, а в качестве электролита используется раствор гидроксида калия.
Электролизом называются процессы окисления и восстановления веществ, происходящие на поверхности электродов под действием электрического тока. При электролизе происходит превращение электрической энергии в химическую, т.е. под
|
||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 4445; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.014 с.) |

 ). В левой части уравнения записывают формулу молекулы электролита, в правой – формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
). В левой части уравнения записывают формулу молекулы электролита, в правой – формулы ионов, которые образуются в процессе электролитической диссоциации. Например: .
. ,
, .
. ,
, моль/л. Таковы концентрации ионов Н+ и ОН– в чистой воде. При добавлении соляной кислоты, которая диссоциирует в воде на ионы Н+ и Сl–, концентрация ионов Н+ в растворе увеличится, но ионное произведение воды от концентрации не зависит – в таком случае уменьшается концентрация [ОН–]. Напротив, если к воде добавить щелочь, то концентрация [ОН–] увеличится, а [Н+] уменьшится. Концентрации [Н+] и [ОН–] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
моль/л. Таковы концентрации ионов Н+ и ОН– в чистой воде. При добавлении соляной кислоты, которая диссоциирует в воде на ионы Н+ и Сl–, концентрация ионов Н+ в растворе увеличится, но ионное произведение воды от концентрации не зависит – в таком случае уменьшается концентрация [ОН–]. Напротив, если к воде добавить щелочь, то концентрация [ОН–] увеличится, а [Н+] уменьшится. Концентрации [Н+] и [ОН–] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.

 MgO + H2O;
MgO + H2O; 2FeCl3.
2FeCl3.


 .
. .
.
 + 16H+ +
+ 16H+ +  + 5H2O ® 2Mn2+ + 8H2O +
+ 5H2O ® 2Mn2+ + 8H2O + 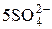 + 10H+
+ 10H+



