Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1: Растворы и их роль в жизнедеятельностиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вариант 3 Занятие №1 Задача 1 В 100г водного раствора содержится 5г мочевины СО(NH2)2. Следовательно, учитывая давление пара чистой воды Ро = 3,166кПа при температуре 250С, давление насыщенного пара (кПа) раствора при этой температуре равно: а) 3,119+ б) 1,105 в) 3,458 г) 2,214 + Задача №2 Для приготовления лекарственных настоек используется 40% раствор этилового спирта. В лаборатории имеется 96% раствор этилового спирта плотностью 0,81 г/мл. Вопросы: 1. Что называется истинным раствором? 2. Как можно из 96% раствора этилового спиртаприготовить 40% раствор? 3. Какая масса этилового спирта и воды содержится в 1 кг 40% раствора? 4. Какой объем 96% раствора следует взять для приготовления 1 кг 40% раствора этилового спирта? 5. Какой объем воды требуется для приготовления этого раствора? Ответьте на тесты: 1. Диссоциация слабых электролитов не зависит от 1. давления + 2. температуры 3. природы электролита 4. природы растворителя 5. концентрации раствора 2. Осмотическое давление растворов электролитов прямо пропорционально 1. природе электролита 2. абсолютной температуре 3. молярной концентрации раствора + 4. молярной доле растворителя 5. молярной доле растворённого вещества и растворителя 3. Водные растворы сильных электролитов содержат 1. ионы 2. молекулы 3. гидратированные ионы + 4. гидратированные молекулы 5. гидратированные ионы и молекулы 4. Водные растворы слабых электролитов содержат 1. ионы 2. молекулы 3. гидратированные ионы 4. гидратированные молекулы 5. гидратированные ионы и молекулы +
ЗАНЯТИЕ №2 Задача 1 рН буферного раствора, состоящего из 20мл раствора СН3СООН и 40мл раствора СН3СOONa в одинаковой молярной концентрации равен: (рКСН3СООН = 4,75; lg 2 = 0,3) а) 4,45 б) 5,05 + в) 3,75 г) 4,0
Задача № 2 В лаборатории для проведения биохимических экспериментов требуется приготовить 100 мл фосфатного буферного раствора с pH = 7,2. Вопросы: 1.Какой раствор называется буферным? Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов. рН буферных растворов мало изменяется при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании. 2.Из каких компонентов состоит фосфатная буферная система? В крови ёмкость фосфатной буферной системы невелика (составляет около 2 % общей буферной ёмкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче. Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет однозамещённый фосфат (NaH2PО4), а роль сопряженного основания — двузамещённый фосфат (Na2HPО4). При рН 7,4 соотношение [НРО42-/Н2РО4-] равняется {\displaystyle 10^{pH-pK_{a,orto}^{II}}=1,55} поскольку при температуре 25+273,15K pKa, ортоII=7,21[3], при этом средний заряд аниона ортофосфорной кислоты < q >=((-2)*3+(-1)*2)/5=-1,4 единиц заряда позитрона. Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4-: {\displaystyle {\mathsf {H^{+}+HPO_{4}^{2-}\rightarrow H_{2}PO_{4}^{-}}}} а при избытке ионов ОН- — за счет связывания их с ионами Н2РО4-: {\displaystyle {\mathsf {H_{2}PO_{4}^{-}+OH^{-}\rightleftarrows HPO_{4}^{2-}+H_{2}O}}} Фосфатная буферная система крови тесно взаимосвязана с бикарбонатной буферной системой.
3.К какому типу буферных систем относится фосфатный буфер? 4.По какой формуле вычисляется pH фосфатного буферного раствора?
где рКа (Н2РО4-) – отрицательный десятичный логарифм константы диссоциации фосфорной кислоты по второй ступени рКа (Н2РО4- - слабая кислота); с (НРО42-) и с (Н2РО4-) - соответственно концентрации
5.В каких объемных соотношениях надо смешать исходные растворы компонентов фосфатной буферной системы, молярная концентрация которых 0,1 моль/л, чтобы приготовить 100 мл буферного раствора с pH = 7,2, если pKa (H3PO4) = 1,9; pKa (H2PO4-) = 7,2; pKa (HPO42-) = 12,3? Ответьте на тесты: 1. Буферные системы поддерживают постоянство 1. водородного показателя + 2. концентрации ионов водорода 3. концентрации гироксиионов- 4. концентрации катионов металлов 5. концентрации анионов 2. Из двух солей состоит буферная система 1. ацетатная 2. фосфатная + 3. аммиачная 4. бикарбонатная 5. гемоглобиновая 3. Однокомпонентной может быть буферная система 1. белковая + 2. ацетатная 3. фосфатная 4. аммиачная 5. гидрокарбонатная 4. Кислотной буферной системой может быть 1. белковая 2. ацетатная 3. фосфатная 4. аммиачная 5. гидрокарбонатная+
Занятие №3 Задача 1 Определите как изменится энтропия в следующей реакции:
Решение Дельта Н= 2*240,2 – (2*210,6 + 205)= -245,8Дж/моль Задача №2 Мужчина выпил на вечеринке в пересчете на абсолютный спирт 46 г этанола С2Н5ОН. Считать, что этанол полностью окисляется в организме по уравнению: С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж) DН0обр (С2Н5ОН) = -1278 кДж/моль; DН0обр (Н2О) = -286 кДж/моль; DН0обр (СО2) = -394 кДж/моль. Решение Термохимические расчеты основаны на законе Гесса. Стандартная энтальпия окисления этанола может быть рассчитана по уравнению: DН0окисл.(С2Н5ОН) = 2DН0обр(СО2) + 3DН0обр(Н2О)DН0обр(С2Н5ОН) = 2×(394) + 3×(286) – (278) = 788 – 858 + 278 = 1368кДж. Так как DН0окисл.(С2Н5ОН) < 0, то процесс окисления спирта является экзотермическим. Чтобы компенсировать излишества, мужчина должен бегать трусцой: 1368 кДж / 920 кДж/ч = 1,49 ч. Вопросы: 1.На основании какого закона проводятся термохимические расчеты? 2.По какому уравнению можно рассчитать стандартную энтальпию окисления глюкозы? Рассчитать стандартную энергию Гиббса для реакции окисления глюкозы: С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.). по известным данным:
Решение. Значения стандартных энтальпии и энтропии реакции рассчитаем при помощи первого следствия из закона Гесса: = 6 CO2 + 6 H2O - С6H12O6 - 6 O2 = = 6×(-393,5) + 6×(-286) - (-1274,5) - 6×0 = -2803 кДж; = 6 СО2 + 6 H2O - С6H12O6 - 6 O2 = = 6×214 + 6×70 - 212 - 6×205 = 262 Дж/К = 0,262 кДж/К. Стандартную энергию Гиббса реакции найдем из соотношения: = - T× = -2803 кДж - 298,15 K×0,262 кДж/К = = -2881 кДж.
3.Каким является процесс окисления спирта: экзотермическим или эндотермическим? 4.Какое количество энергии получит организм пациента? 5.Какое время мужчина должен бегать трусцой (расход энергии 920кДж/ч), чтобы компенсировать излишества? 1368 кДж / 920 кДж/ч = 1,49 ч.
Ответьте на тесты: 1. Открытой термодинамической системой является 1. химическая реакция, идущая в термостате 2. клетка (животная или растительная)+ 3. популяция 4. биогеоценоз 5. биосфера 2. Для живых организмов характерно состояние 1. равновесное 2. стационарное 3. неравновесное 4. абсолютное равновесное 5. относительное равновесное + 3. Процессы, протекающие в организме человека, являются 1. изобарными 2. изохорными 3. изотермическими 4. изобарно-изотермическими 5. изохорно-изотермическими + 4. Энергия, зависящая только от термодинамического состояния системы 1. энтальпией + 2. энергией Гиббса 3. связанной энергией 4. свободной энергией 5. внутренней энергией Занятие №4 Задача 1 Определить как изменится скорость реакции Решение V= 5*5*5=125 скорость уменьшится в 125 раз Задача №2 В лаборатории создали новый лекарственный препарат. Срок годности этого препарата при t0 = 200С составляет три года. Для установления срока его годности и был использован метод ускоренного старения. Известно, что для данной реакции температурный коэффициент скорости реакции g равен 2. Вопросы: 1. В чем заключается метод ускоренного старения? 2. Как скорость реакции зависит от температуры? 3.Какое математическое выражение имеет правило Вант-Гоффа? 4. Какое время можно хранить препарат при 300С, 400С, 500С? 5. Можно ли проводить исследования при температурах 100-2000С? Ответьте на тесты: 1. Константа скорости химической реакции зависит 1. от давления 2. от температуры + 3. от концентрации 4. от давления и концентрации 5. плотности 2. К реакциям нулевого порядка относится 1. реакции гидролиза 2. реакции изомерного превращения 3. конечные стадии ферментативных процессов 4. начальные стадии ферментативных процессов + 5. реакции взаимодействия антигенов с антителами 3. Кинетическим уравнением второго порядка описываются 1. реакции гидролиза 2. процессы агглютинации эритроцитов 3. начальные стадии ферментативных процессов 4. конечные стадии ферментативных процессов 5. реакции взаимодействия антигенов с антителами + 4. Кинетическим уравнением первого порядка описываются 1. реакции гидролиза + 2. процессы агглютинации эритроцитов 3. начальные стадии ферментативных процессов 4. реакции изомерного превращения 5. реакции взаимодействия антигенов с антителами
Занятие №5 Занятие № 6 Занятие № 7 Кислотные свойства Кислотные свойства карбоновых кислот проявляются в их способности отщеплять протон. Повышенная подвижность водорода обусловлена полярностью связи О-Н за счет р,п -сопряжения (см. схему 6.1). Сила карбоновых кислот зависит от стабильности карбоксилат-иона RCOO, образующегося в результате отрыва протона. В свою очередь, стабильность аниона определяется прежде всего степенью делокализации в нем отрицательного заряда: чем лучше делокализован заряд в анионе, тем он стабильнее (см. 4.2.1). В карбоксилат-ионе заряд делокализуется по р,π-сопряженной системе с участием двух атомов кислорода и распределен поровну между ними (см. 2.3.1).
Для карбоновых кислот значения рла лежат в интервале 4,2-4,9. Эти кислоты обладают существенно более высокой кислотностью, чем спирты (рКа 16-18), фенолы (рКа ~10) и тиолы (рКа 11-12) (см. табл. 4.5).
2. Неомыляемые липиды. Строение холестерола. Схема образования эфира холестирола. Биологическая роль холестирола. Группа неомыляемых липидов включает предельные углеводороды и каротиноиды, а также спирты. В первую очередь это спирты с длинной алифатической цепью, циклические стерины (например, холестерин) и стероиды (эстрадиол, тестостерон и др.). Важнейшую группу липидов образуют жирные кислоты. Холестери́н (др.-греч. χολή — желчь и στερεός — твёрдый) — органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов, за исключением грибов и безъядерных (прокариоты). В растительных жирах содержание холестерина невелико. Содержание холестерина в подсолнечном масле составляет 14 мг/кг, что приблизительно в 1000 раз меньше, чем, например, в яичном желтке — 15 г/кг. Холестерин нерастворим в воде, растворим в жирах и органических растворителях. Около 80 % холестерина вырабатывается самим организмом человека: (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20 % поступают с пищей[1]. Холестерин обеспечивает устойчивость клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов (включая кортизол, альдостерон, половые гормоны: эстрогены, прогестерон, тестостерон),жёлчных кислот[2]. Биосинтез холестерина[] Основная статья: Биосинтез холестерина Холестерин может образовываться в животном организме и поступать в него с пищей. · Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат. Происходит в ГЭПР. · Превращение мевалоната в активный изопреноид — изопентенилпирофосфат. · Образование тридцатиуглеродного изопреноида сквалена из шести молекул изопентенилдифосфата. · Циклизация сквалена в ланостерин. · Последующее превращение ланостерина в холестерин. У некоторых организмов при синтезе стероидов могут встречаться другие варианты реакций (например, немевалонатный путь образования пятиуглеродных молекул). Биологическая роль[] Холестерин в составе клеточной плазматической мембраны играет роль модификатора бислоя, придавая ему определённую жёсткость за счёт увеличения плотности «упаковки» молекул фосфолипидов. Таким образом, холестерин — стабилизатор текучести плазматической мембраны[5]. Холестерин открывает цепь биосинтеза стероидных половых гормонов и кортикостероидов[6], служит основой для образования желчных кислот и витаминов группы D[7][8], участвует в регулировании проницаемости клеток и предохраняет эритроциты крови от действия гемолитических ядов[7][8]. Холестерин нерастворим в воде и в чистом виде не может доставляться к тканям организма при помощи основанной на воде крови. Вместо этого холестерин в крови находится в виде хорошо растворимых комплексных соединений с особыми белками-транспортерами, так называемыми аполипопротеинами. Такие комплексные соединения называются липопротеинами. Существует несколько видов аполипопротеинов, различающихся молекулярной массой, степенью сродства к холестерину и степенью растворимости комплексного соединения с холестерином (склонностью к выпадению кристаллов холестерина в осадок и к формированию атеросклеротических бляшек). Различают следующие группы: высокомолекулярные (HDL, ЛПВП,липопротеины высокой плотности) и низкомолекулярные (LDL, ЛПНП, липопротеины низкой плотности), а также очень низкомолекулярные (VLDL, ЛПОНП, липопротеины очень низкой плотности) и хиломикрон. К периферийным тканям холестерин транспортируется хиломикроном, ЛПОНП и ЛПНП. К печени, откуда затем холестерин удаляется из организма, его транспортируют аполипротеины группы ЛПВП. Уровень холестерина [] Исследования установили зависимость между содержанием различных групп липопротеинов и здоровьем человека. Большое количество ЛП Н П сильно коррелирует с атеросклеротическими нарушениями в организме. По этой причине такие липопротеины часто называют «плохими». Низкомолекулярные липопротеины малорастворимы и склонны к выделению в осадок кристаллов холестерина и к формированию атеросклеротических бляшек в сосудах, тем самым повышая риск инфаркта или ишемического инсульта, а также других сердечно-сосудистых осложнений. С другой стороны, большое содержание ЛП В П в крови характерно для здорового организма, поэтому часто эти липопротеины называют «хорошими». Высокомолекулярные липопротеины хорошо растворимы и не склонны к выделению холестерина в осадок, и тем самым защищают сосуды от атеросклеротических изменений (то есть не являются атерогенными). Уровень холестерина в крови измеряется либо в ммоль/л (миллимоль на литр — единица, действующая в РФ) либо в мг/дл (миллиграмм на децилитр, 1 ммоль/л равен 38,665 мг/дл). Идеально, когда уровень «плохих» низкомолекулярных липопротеинов ниже 2,586 ммоль/л (для лиц с высоким риском сердечно-сосудистых заболеваний — ниже 1,81 ммоль/л). Такой уровень, однако, у взрослых достигается редко. Если уровень низкомолекулярных липопротеинов выше 4,138 ммоль/л, рекомендуется использовать диету для снижения его ниже 3,362 ммоль/л. Если этот уровень выше 4,914 ммоль/л или упорно держится выше 4,138 мг/дл, рекомендуется рассмотреть возможность лекарственной терапии. Для лиц с высоким риском сердечно-сосудистых заболеваний эти цифры могут снижаться. Доля «хороших» высокомолекулярных липопротеинов в общем уровне холестерин-связывающих липопротеинов чем выше, тем лучше. Хорошим показателем считается, если он гораздо выше 1/5 от общего уровня холестерин-связывающих липопротеинов. К факторам, повышающим уровень «плохого» холестерина, относятся: · курение; · избыточный вес или ожирение, переедание; · гиподинамия или недостаточная физическая активность; · неправильное питание с высоким содержанием транс-жиров (содержащихся в частично гидрогенизированных жирах), высоким содержанием в пище углеводов (особенно легкоусваиваемых, вроде сладостей и кондитерских изделий), недостаточным содержанием клетчатки и пектинов, липотропных факторов, полиненасыщенных жирных кислот, микроэлементов и витаминов; · застой жёлчи в печени при различных нарушениях работы этого органа[ источник не указан 1679 дней ] (также ведёт к желчнокаменному холециститу). Возникает при злоупотреблении алкоголем, некоторых вирусных заболеваниях, приёме некоторых лекарств; · также некоторые эндокринные нарушения — сахарный диабет, гиперсекреция инсулина, гиперсекреция гормонов коры надпочечников, недостаточность гормонов щитовидной железы, половых гормонов. Повышенный уровень «плохого» холестерина также может наблюдаться при некоторых заболеваниях печени и почек, сопровождающихся нарушением биосинтеза «правильных» липопротеидов в этих органах. Он может также быть наследственным, наследственно обусловленным при некоторых формах так называемых «семейных дислипопротеинемий». В этих случаях больным, как правило, нужна особая лекарственная терапия. К факторам, снижающим уровень «плохого» холестерина, относятся физкультура, спорт и вообще регулярная физическая активность, отказ от курения и употребления алкоголя, еда, содержащая мало насыщенных животных жиров и легкоусваиваемых углеводов, но богатая клетчаткой, полиненасыщенными жирными кислотами, липотропными факторами (метионином,холином, лецитином), витаминами и микроэлементами. Холестерин также является основным компонентом большинства камней в желчном пузыре (см. историю открытия). Холестерин. Как отмечалось, среди стероидов выделяется группа соединений, получивших название стеринов(стеролов). Для стеринов характерно наличие гидроксильной группы в положении 3, а также боковой цепи в положении 17. У важнейшего представителя стеринов – холестерина – все кольца находятся в транс-положении; кроме того, он имеет двойную связь между 5-м и 6-м углеродными атомами. Следовательно, холестерин является ненасыщенным спиртом:
Решите задачи: Задача №1 Задача 2 Произрастающие в засушливых районах растения – сункуленты обычно покрыты восковым налетом. Как это способствует выживанию растения. Способствует сохранению влаги Ответьте на тесты: 1. Масла являются триацилглицератами 1. насыщенных жирных кислот 2. ненасыщенных жирных кислот+ 3. ненасыщенных и насыщенных жирных кислот одновременно 4. простых органических кислот 5. ненасыщенных жирных и простых органических кислот 2. Мылами называются 1. только натриевые соли высших жирных кислот 2. только калиевые соли высших жирных кислот 3. натриевые и калиевые соли высших жирных кислот+ 4. любые соли высших жирных кислот 5. натриевые соли простых органических кислот 3. При окислении липидов перманганатом калия в нейтральной среде образуются 1. кетоны 2. альдегиды 3. гликоли и кислоты 4. гликоли 5. кислоты 4. Твердые жиры получают из масел путем 1. окисления 2. термической обработки 3. гидрогенизации+ 4. гидролиза 5. вакумирования Занятие № 8 Задача №1 Известно, что соединения, содержащие тиольную группу, склонную к легкому окислению, выполняют защитную функцию при воздействии на организм веществ с высокой окислительной способностью. Кроме того, они проявляют противолучевое действие. В научной лаборатории сотрудник получил дозу ионизирующего излучения. Среди лекарств в лаборатории имелся только набор α-аминокислот. Вопросы: 1. Что называется α-аминокислотами? 2. Какие аминокислоты называются незаменимыми? 3. На какие группы делятся аминокислоты по химической природе радикала? 4. Какую α-аминокислоту следует ввести сотруднику, получившему дозу излучения? 5. Что образуется при окислении этой аминокислоты? Занятие № 9 Гомополисахариды Крахмал – гомополимер α-D-глюкозы. Находится в злаках, бобовых, картофеле и некоторых других овощах. Синтезировать крахмал способны почти все растения. Двумя основными компонентами крахмала являются амилоза (15-20%) и амилопектин (80-85%). Амилоза представляет собой неразветвленную цепь с молекулярной массой от 5 до 500 кДа, в которой остатки глюкозы соединены исключительно α-1,4-гликозидными связями. Амилопектин содержит α-1,4- и α-1,6-гликозидные связи, имеет массу не менее 1 млн Да и является разветвленной молекулой, причем ветвление происходит за счет присоединения небольших глюкозных цепочек к основной цепи посредством α-1,6-гликозидных связей. Каждая ветвь имеет длину 24-30 остатков глюкозы, веточки возникают примерно через 14-16 остатков глюкозы в цепочке.
Строение крахмала и гликогена Гликоген – резервный полисахарид животных тканей, в наибольшей мере содержится в печени и мышцах. Структурно он схож с амилопектином, но, во-первых, длина веточек меньше – 11-18 остатков глюкозы, во-вторых, более разветвлен – через каждые 8-10 остатков. За счет этих особенностей гликоген более компактно уложен, что немаловажно для животной клетки. Целлюлоза является наиболее распространенным органическим соединением биосферы. Около половины всего углерода Земли находится в ее составе. В отличие от предыдущих полисахаридов она является внеклеточной молекулой, имеет волокнистую структуру и абсолютно нерастворима в воде. Единственной связью в ней является β-1,4-гликозидная связь.
Строение целлюлозы
Решите задачи: 1. Напишите уравнений реакций: получения D-галактоновой кислоты жесткого окисления D-глюкозы получения D-галактуроновой кислоты Задача №2 В двух пробирках находятся растворы глюкозы и этиленгликоля. В лаборатории имеются 36,5% раствор HCl, 10% раствор NaOH, 2% раствор CuSO4, дистиллированная вода и горелка. Требуется распознать содержимое пробирок. Вопросы: 1. К какому классу органических соединений относится глюкоза? Моносахаридам 2. Какие функциональные группы содержит глюкоза? спиртовые и карбонильную группы 3. Как можно доказать наличие у глюкозы функциональных групп? качественные реакции 4. Имеются ли общие типы реакций у глюкозы и этиленгликоля? Да, по спиртовым группам 5. Каким образом можно распознать содержимое пробирок, используя имеющиеся реактивы? Ответьте на тесты: 1. В молекуле мальтозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью; 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями. 2. В молекуле лактозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью; 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями. 3. В молекуле сахарозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью;+ 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями. 4. В молекуле целлобиозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью; 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями.
Занятие № 10 Задача №2 В контрольно-аналитическую лабораторию на анализ поступили три препарата: никотинамид, никодин (N-оксиметиламид никотиновой кислоты) и кордиамин (N,N-диэтиламид никотиновой кислоты). В лаборатории имеются водные растворы NaOH и HCl, аммиачный раствор гидроксида серебра и магнитная мешалка с подогревом. Требуется идентифицировать эти препараты. Вопросы: 1. Какое название по международной номенклатуре имеет соединение, производными которого являются указанные препараты? 2. Как выглядят структурные формулы указанных соединений? 3. Обладает ли атом азота в пиридиновом кольце кислотно-основными свойствами? Основные свойства гетероциклических соединений обусловлены неподеленной парой электронов гетероатома, способной присоединять протон. Такими свойствами обладает пиридиновый атом азота, у которого n-электроны находятся на sp2-гибридной орбитали и не вступают в сопряжение. Пиридин является основанием и с сильными кислотами образует пиридиниевые соли, подобные аммониевым солям.
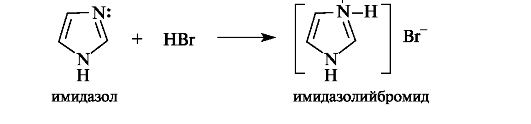
Аналогично основные свойства проявляют и другие гетероциклы, содержащие пиридиновый атом азота. Так, имидазол и пиразол образуют соли с минеральными кислотами за счет пиридинового атома азота.
Пиррольный атом азота в молекулах имидазола, пиразола и, естественно, самого пиррола не склонен связывать протон, так как его неподеленная пара электронов является частью ароматического секстета. В результате пиррол практически лишен основных свойств. В то же время пиррольный атом азота может служить центром кислотности. Пиррол ведет себя, как слабая NH-кислота, поэтому протон будет отщепляться только при действии очень сильных оснований, например амида натрия NaNH2 или гидрида натрия NaH. За счет пиррольного атома азота в реакциях со щелочными металлами также образуются соли, которые легко гидролизуются.
Таким образом, имидазол и пиразол могут проявлять как основные, так и кислотные свойства, т. е. являются амфотерными соединениями.
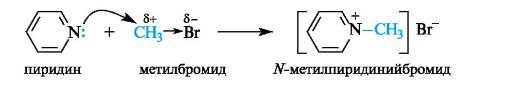
Гетероциклы, содержащие пиридиновый атом азота, проявляют и нуклеофильные свойства, т. е. способность атаковать атом углерода, несущий частичный положительный заряд (электрофильный центр). Так, взаимодействие пиридина с галогеноалканами приводит к образованию алкилпиридиниевых солей.
Занятие №11 Вариант 3 Занятие №1 Тема 1: Растворы и их роль в жизнедеятельности Дайте краткий ответ на теоретические вопросы: 1.Роль осмоса в биосистемах. Плазмолиз, гемолиз, тургор. Гипо-, изо- и гипертонические растворы. Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос. Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гипертоническим по отношению ко второму, а второй – гипотоническим по отношению к первому. При помещении клеток в изотонический раствор они сохраняют свой размер и нормально функционируют. При помещении клеток в гипотонический раствор вода из менее концентрированного внешнего раствора переходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Такое разрушение клеток называется лизисом, в случае эритроцитов этот процесс называется гемолизом. Кровь с клеточным содержимым, выходящим наружу при гемолизе, за свой цвет называется лаковой кровью.При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор, и наблюдается сморщивание (высушивание) клеток. Это явление называется плазмолизом. Биологические жидкости человека (кровь, лимфа, тканевые жидкости) представляют собой водные растворы низкомолекулярных соединений – NaCI, KCl, СаС1, высокомолекулярных соединений – белков, поли–сахаридов, нуклеиновых кислот и форменных элементов – эритроцитов, лейкоцитов, тромбоцитов. Их суммарным действием определяется осмотическое давление биологических жидкостей. Осмотическое давление крови человека при 310°К (37°С) составляет 780 кПа (7,7 атм). Такое же давление создает и 0,9%-ный водный раствор NaCI (0,15 моль/л), который, следовательно, изотоничен с кровью (физиологический раствор). Однако в крови кроме ионов Na и С1 имеются и другие ионы, а также ВМС и форменные элементы. Поэтому в медицинских целях более правильно использовать растворы, содержащие те же компоненты и в том же количестве, что и входящие в состав крови. Эти растворы применяют в качестве кровезаменителей в хирургии. Человеческий организм, помимо осмотического давления, характеризуется постоянством (гомеостазом) и других физико-химических показателей крови например кислотности. Допустимые колебания осмотического давления крови весьма незначительны и даже при тяжелой патологии не превышают нескольких десятков кПа. При различных процедурах в кровь человека и животных в больших количествах можно вводить только изотонические растворы.При больших потерях крови (например, после тяжелых операций, травм) больным вводят по несколько литров изотонического раствора для возмещения потери жидкости с кровью. Явление осмоса широко используют в медицинской практике. Так, в хирургии применяют гипертонические повязки (марлю, смоченную в гипертоническом 10%-ном растворе NaCl), которые вводят в гнойные раны.По закону осмоса ток жидкости раны через марлю направляется наружу, в результате чего рана постоянно очищается от гноя, микроорганизмов и продуктов распада. Плазмолиз - отделение протопласта от клеточной стенки в гипертоническом растворе. Гемолиз - разрушение эритроцитов с выходом гемоглобина в окружающую эритроциты среду. Тургор - внутреннее гидростатическое давление в живой клетке, вызывающее напряжение клеточной оболочки. Гипотонический раствор - раствор, имеющий более низкое осмотическое давление, чем клеточный сок. Всасывание воды клеткой возможно только из гипотонических растворов. При погружении клетки в гипотонический раствор, происходит осмотическое проникновение воды внутрь клетки с развитием её гипергидратации — набухания с последующим цитолизом. Растительные клетки в данной ситуации повреждаются не всегда; при погружении в гипотонический раствор, клетка будет повышать тургорное давление, возобновляя своё нормальное функционирование. Гипертонический раствор - раствор, имеющий бо́льшую концентрацию вещества по отношению к внутриклеточной. При погружении клетки в гипертонический раствор, происходит её дегидратация — внутриклеточная вода выходит наружу, что приводит к высыханию и сморщиванию клетки. Гипертонические растворы применяются при осмотерапии[1] для лечения внутримозгового кровоизлияния. Изотонический раствор - равенство осмотического давления в жидких средах и тканях организма, которое обеспечивается поддержанием осмотически эквивалентных концентраций содержащихся в них веществ. Изотония — одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции. Изотонический раствор — раствор, имеющий осмотическое давление, равное внутриклеточному. Клетка, погружённая в изотонический раствор, находится в равновесном состоянии — молекулы воды диффундируют через клеточную мембрану в равном количестве внутрь и наружу, не накапливаясь и не теряясь клеткой. Отклонение осмотического давления от нормального физиологического уровня влечёт за собой нарушение обменных процессов между кровью, тканевой жидкостью и клетками организма. Сильное отклонение может нарушить структуру и целостность клеточных мембран.
2.Термодинамика процесса растворения. Согласно второму началу термодинамики при р, Т = = const вещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т. е. ?G = (?Н – T?S) < 0. Величину?Н называют энтальпийным фактором, а величину T?S – энтропийным фактором растворения. При растворении жидких и твердых веществ энтропия системы обычно возрастает (?S > 0), так как растворяе–мые вещества из более упорядоченного состояния пе–реходят в менее упорядоченное. Вклад энтропийного фактора, способствующий увеличению растворимости, особенно заметен при повышенных температурах, по–тому что в этом случае множитель Т велик и абсолютное значение произведения T?S также велико, соответст–венно возрастает убыль энергии Гиббса. При растворении газов в жидкости энтропия системы обычно уменьшается (?S < 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем). Снижение температуры
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-17; просмотров: 1682; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.96 (0.013 с.) |


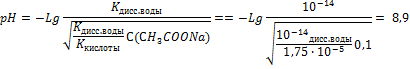
 , полученный ответ подтвердите расчетами, если:
, полученный ответ подтвердите расчетами, если:
 , если общее давление в системе уменьшить в 5 раз.
, если общее давление в системе уменьшить в 5 раз.