Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 9: Углеводы: моносахариды, ди- и полисахаридыСодержание книги
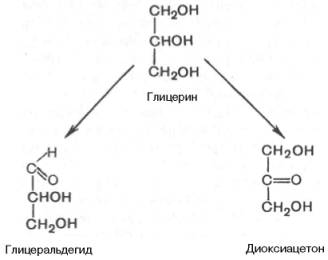
Поиск на нашем сайте Дайте краткий ответ на теоретические вопросы: 1.Стереоизомерия моносахаридов. D- и L-стереохимические ряды. Открытые и циклические формы. Формулы Фишера и формулы Хеуорса. Цикло-оксотаутомерия, конформация пиранозных форм моносахаридов. Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная группа находится в конце цепи, то моносахаридпредставляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахаридявляется кетоном и называется кетозой. Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы трехатомного спирта – глицерола – образуется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к образованию диоксиацетона (кетоза).
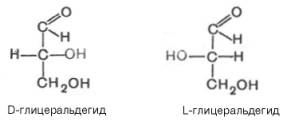
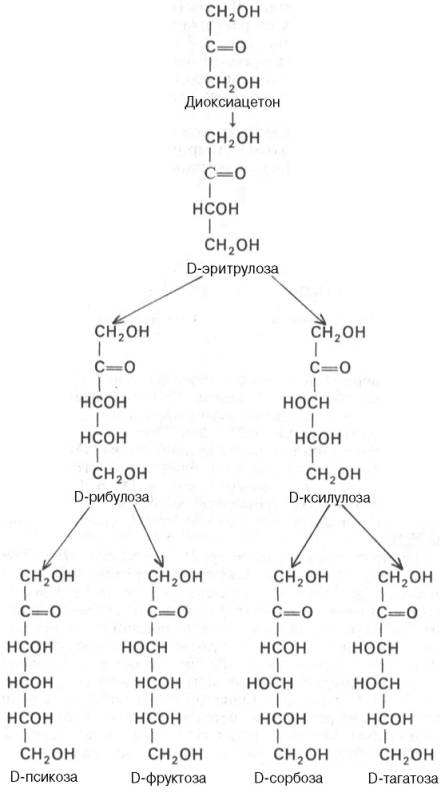
Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдо-тетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. Следовательно, кетотриоза диоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров. Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где N – числостереоизомеров, а n – число асимметричных атомов углерода. Как отмечалось, глицеральдегид содержит только один асимметричный атом углерода и поэтому может существовать в виде двух различных стереоизомеров. Изомер глицеральдегида, у которого при проекции модели на плоскость ОН-группа у асимметричного атомауглерода расположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом:
Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в виде 16 стереоизомеров(24), представителем которых является, например, глюкоза. Для альдопентоз и альдотетроз число сте-реоизомеров равно соответственно 23 = 8 и 22 = 4. Все изомеры моносахаридов подразделяются на D- и L-формы (D-и L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природныегексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда (схема 5.1). Известно, что природные моносахариды обладают оптической активностью. Способность вращать плоскость поляризованного луча света – одна из важнейших особенностей веществ (в том числе моносахаридов), молекулыкоторых имеют асимметричный атом углерода или асимметричны в целом. Свойство вращать плоскость поляризованного луча вправо обозначают знаком плюс (+), а в противоположную сторону – знаком минус (–). Так, D-глицеральдегид вращает плоскость поляризованного луча вправо, т. е. D-глицеральдегид является D(+)-альдотриозой, а L-гли-церальдегид – L(–)-альдотриозой. Однако направление угла вращения поляризованного луча, которое определяется асимметрией молекулы в целом, заранее непредсказуемо. Моносахариды, относящиеся постереохимической конфигурации к D-ряду, могут быть левовращающими. Так, обычная форма глюкозы, встречающаяся в природе, является правовращающей, а обычная форма фруктозы – левовращающей. Циклические (полуацетальные) формы моносахаридов. Любой моносахарид с конкретными физическими свойствами (температура плавления, растворимость и т.д.) характеризуется специфической величиной удельного вращения [α]D20. Схема 5.1 СЕМЕЙСТВО D-KETОЗ, СОДЕРЖАЩИХ 3-6 АТОМОВ УГЛЕРОДА
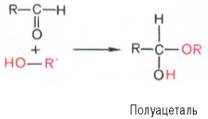
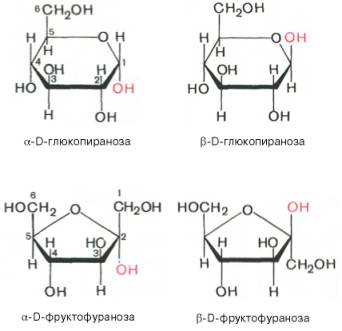
Явление мутаротации имеет объяснение. Известно, что альдегиды и кетоны легко и обратимо реагируют с эквимолярным количеством спирта с образованием полуацеталей:
Реакция образования полуацеталя возможна и в пределах одной молекулы, если это не связано с пространственными ограничениями. По теории А. Байера, внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. При образовании полуацеталей возникает новый асимметрический центр (для D-глюкозы это С-1). Шестичленные кольцасахаров называют пиранозами, а пятичленные – фуранозами. α-Форма – это форма, у которой расположение полуацетального гидроксила такое же, как у асимметричного углеродного атома, определяющего принадлежность к D- или L-ряду. Иными словами, в формулах с α-моди-фикацией моносахаридов D-ряда полуацетальный гидроксилпишут справа, а в формулах представителей L-ряда – слева. При написании β-формы поступают наоборот. Таким образом, явление мутаротации связано с тем, что каждый твердый препарат углеводов представляет собой какую-либо одну циклическую (полуацетальную) форму, но при растворении и стоянии растворов эта форма через альдегидную превращается в другие таутомерные циклические формы до достижения состояния равновесия. При этом значение удельного вращения, характерное для исходной циклической формы, постепенно меняется. Наконец, устанавливается постоянное удельное вращение, которое характерно для равновесной смеси таутомеров. Например, известно, что в водных растворах глюкоза находится главным образом в виде α- и β-глюкопираноз, в меньшей степени – в виде α- и β-глюкофураноз и совсем небольшое количество глюкозы – в виде альдегидной формы. Следует подчеркнуть, что из различных таутомерных форм глюкозы в свободном состоянии известны лишь α- и β-пиранозы. Существование малых количеств фураноз и альдегидной формы в растворах доказано, но в свободном состоянии они не могут быть выделены вследствие своей неустойчивости. Установлено, что величина удельного вращения при растворении любого моносахарида постепенно меняется и лишь при дли тельном стоянии раствора достигает вполне определенного значения. Например, для свежеприготовленного раствора глюкозы [α]D20= +112,2°, после длительного стояния раствора эта величина достигает равновесного значения [α]D20= +52,5°. Изменение величины удельного вращения при стоянии (во времени) растворов моносахаридов называется мутаротацией. Очевидно, мутаротация должна вызываться изменением асимметрии молекулы, а следовательно, трансформацией ее структуры в растворе. В 20-х годах У. Хеуорс предложил более совершенный способ написания структурных формул углеводов. Формулы Хеуорса – шести- или пятиугольники, причем они изображены в перспективе: кольцо лежит в горизонтальной плоскости. Находящиеся ближе к читателю связи изображают более жирными линиями (углеродные атомы цикла не пишут). Заместители, расположенные справа от остова молекулы при ее вертикальном изображении, помещают ниже плоскости кольца, а заместители, находящиеся слева,– выше плоскости кольца. Обратное правило применяют только для того единственного углеродного атома, гидроксильная группа которого участвует в образовании циклического полуацеталя. Так, у D-сахаров группу СН2ОН пишут над этим атомом углерода, а водородный атомпри нем – внизу. Наконец, следует помнить, что при написании структурных формул по Хеуорсу гидроксильная группа при С-1 должна быть расположена ниже плоскости кольца в α-форме и выше – в β-форме:
Проекционные формулы Хеуорса не отражают подлинной конформации моносахаридов. Подобно циклогексану, пиранозное кольцо может принимать две конфигурации – форму кресла и форму лодки (конформацион-ные формулы). Форма кресла обычно более устойчива, и, по-видимому, именно она преобладает в большей части природных сахаров 2.Понятие о гомополисахаридах. Представители гомополисахаридов крахмал (амилоза, амилопектин), декстрины, гликоген, целлюлоза, пектины (полигалактуроновая кислота) Выделяют гомополисахариды, состоящие из одинаковых остатков моносахаров (крахмал, гликоген, целлюлоза) и гетерополисахариды (гиалуроновая кислота, хондроитинсульфаты), включающие разные моносахара. Гомополисахариды Крахмал – гомополимер α-D-глюкозы. Находится в злаках, бобовых, картофеле и некоторых других овощах. Синтезировать крахмал способны почти все растения. Двумя основными компонентами крахмала являются амилоза (15-20%) и амилопектин (80-85%). Амилоза представляет собой неразветвленную цепь с молекулярной массой от 5 до 500 кДа, в которой остатки глюкозы соединены исключительно α-1,4-гликозидными связями. Амилопектин содержит α-1,4- и α-1,6-гликозидные связи, имеет массу не менее 1 млн Да и является разветвленной молекулой, причем ветвление происходит за счет присоединения небольших глюкозных цепочек к основной цепи посредством α-1,6-гликозидных связей. Каждая ветвь имеет длину 24-30 остатков глюкозы, веточки возникают примерно через 14-16 остатков глюкозы в цепочке.
Строение крахмала и гликогена Гликоген – резервный полисахарид животных тканей, в наибольшей мере содержится в печени и мышцах. Структурно он схож с амилопектином, но, во-первых, длина веточек меньше – 11-18 остатков глюкозы, во-вторых, более разветвлен – через каждые 8-10 остатков. За счет этих особенностей гликоген более компактно уложен, что немаловажно для животной клетки. Целлюлоза является наиболее распространенным органическим соединением биосферы. Около половины всего углерода Земли находится в ее составе. В отличие от предыдущих полисахаридов она является внеклеточной молекулой, имеет волокнистую структуру и абсолютно нерастворима в воде. Единственной связью в ней является β-1,4-гликозидная связь.
Строение целлюлозы
Решите задачи: 1. Напишите уравнений реакций: получения D-галактоновой кислоты жесткого окисления D-глюкозы получения D-галактуроновой кислоты Задача №2 В двух пробирках находятся растворы глюкозы и этиленгликоля. В лаборатории имеются 36,5% раствор HCl, 10% раствор NaOH, 2% раствор CuSO4, дистиллированная вода и горелка. Требуется распознать содержимое пробирок. Вопросы: 1. К какому классу органических соединений относится глюкоза? Моносахаридам 2. Какие функциональные группы содержит глюкоза? спиртовые и карбонильную группы 3. Как можно доказать наличие у глюкозы функциональных групп? качественные реакции 4. Имеются ли общие типы реакций у глюкозы и этиленгликоля? Да, по спиртовым группам 5. Каким образом можно распознать содержимое пробирок, используя имеющиеся реактивы? Ответьте на тесты: 1. В молекуле мальтозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью; 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями. 2. В молекуле лактозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью; 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями. 3. В молекуле сахарозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью;+ 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями. 4. В молекуле целлобиозы остатки молекул моносахаридов связаны 1. α,β-1,2-гликозидной связью; 2. α-1,4-гликозидной связью; 3. β-1,4-гликозидной связью; 4. α-1,4-, α-1,6-, α-1,3-, α-1,2-гликозидными связями; 5. α-1,4-и α-1,6-гликозидными связями.
Занятие № 10
|
||
|
Последнее изменение этой страницы: 2016-12-17; просмотров: 1170; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.011 с.) |