
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 8: аминокислоты, пептиды, белкиСодержание книги
Поиск на нашем сайте
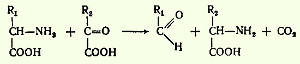
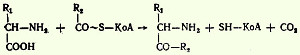
Дайте краткий ответ на теоретические вопросы: 1. Превращение по α-СООН группе - декарбоксилирование α -аминокислот, образование биогенных аминов (коламина, гистамина, серотонина, кадаверина, дофамина, ГАМК). Биологическая роль биогенных аминов. Процесс отщепления карбоксильной группы аминокислот в виде СO2 получил название декарбоксилирования. Несмотря на ограниченный круг субстратов (аминокислот и их производных), подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции (названные биогенными аминами) обладают сильным фармакологическим действием на множество физиологических функций человека и животных. В животных тканях показано декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ-оксиглутаминовой кислот, 3, 4-диоксифенилаланина, цистеина и цистеин-сульфиновой кислоты, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование этих и ряда других аминокислот. Сведения о декарбоксилировании аминокислот в живых организмах суммированы в табл. 39 [показать]. Общая схема процесса декарбоксилирования аминокислот может быть представлена в следующем виде: R-CH(NH2)-COOH --> R-CH2-NH2 + CO2 В живых организмах открыто четыре типа декарбоксилирования аминокислот. 1. α-Декарбоксилирование, характерное для большинства природных аминокислот и их производных, при котором отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины: R-CH(NH2)-COOH --> R-CH2-NH2 + CO2 2. ω-Декарбоксилированне, характерное для микроорганизмов. Например, из аспарагиновой кислоты этим путем образуется α-аланин: НООС-СН2-CH(NH2)-СООН --> СН3-CH(NH2)-СООН + СО2 3. Декарбоксилирование, связанное с реакцией трансаминирования:
В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте. 4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:
Эта реакция в тканях животных осуществляется при синтезе δ-аминолевулиновой кислоты из глицина и сукцинил-КоА (см. Синтез гемоглобина) и при синтезе 3-кетосфинганина (сфинголипидов), а также у растений при синтезе биотина.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами - декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как по белковому компоненту, так и по природе кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом, как и у трансаминаз. Таким образом, в двух совершенно различных процессах аминокислот участвует один и тот же кофермент- пиридоксальфосфат. Исключение составляют две декарбоксилазы - гистидиндекарбоксилаза Micrococcus и Lactobacillus и S-аденозилметиониндекарбоксилаза Е. coli, содержащие вместо пиридоксальфосфата остаток пировиноградной кислоты (С. Р. Мардашев, Снелл). Соответствующие декарбоксилазы животных тканей содержат пиридоксальфосфат.
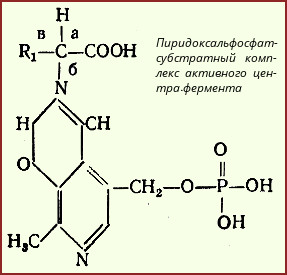
Механизм реакции декарбоксилирования аминокислот в соответствии с общей теорией пиридоксалевого катализа сводится к образованию пиридоксальфосфат-субстратного комплекса в активном центре фермента (представленного, как и в реакциях трансаминирования, шиффовым основанием пиридоксальфосфата и аминокислоты, см. формулу). Образование подобного комплекса в сочетании с некоторым оттягиванием электронов белковой частью молекулы декарбоксилазы сопровождается лабилизацией связей "а", "б" и "в", благодаря которой аминокислота приобретает способность к различного рода превращениям (декарбоксилирование, трансаминирование, дегидратация и т. д.). Ниже будут представлены отдельные примеры декарбоксилирования аминокислот (и соответствующих декарбоксилаз), в частности тех аминокислот, продукты реакции которых обладают мощным фармакологическим действием. Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот, не обладающая строгой субстратной специфичностью и катализирующая декарбоксилирование L-изомеров триптофана, 5-гидрокситриптофана и 3,4-диоксифенилаланина (ДОФА); продуктами реакций, помимо СO2, являются соответственно триптамин, серотонин и диоксифенилэтиламин (дофамин):
Декарбоксилаза ароматических аминокислот получена в чистом виде (мол. м. 112 000); кофермент-пиридоксальфосфат. В больших количествах она содержится в надпочечниках и ЦНС. Она играет важную роль в регуляции синтеза биогенных аминов. Образующийся из триптофана под действием этого фермента продукт - триптамин - наделен сосудосуживающим действием. Другим, более изученным, биогенным амином, образующимся из 5-гидрокситриптофана, является 5-гидрокситриптамин, или серотонин. Помимо сосудосуживающего действия, серотонин участвует в центральной регуляции артериального давления, температуры тела, дыхания и почечной фильтрации. Он является медиатором нервных процессов в ЦНС. Некоторые авторы считают серотонин причастным к развитию аллергии, демпинг-синдрома, токсикоза беременности, карциноидного синдрома и геморрагических диатезов.
Относительно третьего продукта декарбоксилазной реакции - дофамина - следует прежде всего указать на ферментные системы и промежуточные продукты, ведущие к его образованию. Это важно, так как дофамин является предшественником катехоламинов (норадреналина и адреналина). Источником ДОФА в организме является тирозин, который под действием специфической гидроксилазы превращается в 3,4-диоксифенилаланин. Тирозингидроксилаза открыта в надпочечниках, в ткани мозга и периферической нервной системы. Простетической группой тирозингидроксилазы, как и дофамингидроксилазы (последняя катализирует превращение дофамина в норадреналин) является тетрагидробиоптерин (рис.) Физиологическая роль тирозингидроксилазы чрезвычайно высока, поскольку катализируемая этим ферментом реакция определяет скорость биосинтеза дофамина и катехоламинов, регулирующих в известной степени деятельность сердечно-сосудистой системы. В медицинской практике широко используются, кроме того, ингибиторы декарбоксилазы ароматических аминокислот, в частности α-метилдофа (альдомет), введение которого способствует снижению кровяного давления.
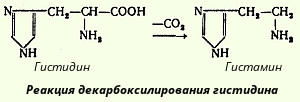
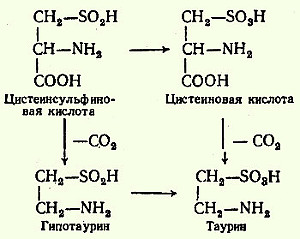
В животных тканях с высокой скоростью протекает реакция декарбоксилирования гистидина, катализируемая специфической гистидиндекарбоксилазой (рис.). Продукт реакции - гистамин - обладает широким спектром биологического действия. По сосудорасширяющему эффекту на кровеносные сосуды он резко отличается от других биогенных аминов, оказывающих сосудосуживающее действие. Много гистамина образуется в области воспаления, что имеет определенный биологический смысл. Вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя борьбе защитных сил организма с инфекцией. Гистамин, кроме того, участвует в секреции НС1 в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации. При повышенной чувствительности к гистамину в клинике используются антигистаминные препараты (санорин, димедрол и др.), оказывающие влияние на рецепторы сосудов. Гистамину приписывают, кроме того, роль медиатора боли. Болевой синдром, несомненно, является весьма сложным процессом, детали которого пока не выяснены, но участие в нем гистамина не подлежит сомнению. В клинике широко используются, кроме того, продукт α-декарбоксилирования глутаминовой кислоты - γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбоксилаза), является высокоспецифичным: НООС-CH(NH2)-СН2-СН2-СООН --> CH2(NH2)-СН2-СН2-COOH + СО2 Интерес к γ-аминомасляной кислоте связан с ее тормозящим действием на деятельность ЦНС. Больше всего γ-аминомасляной кислоты и глутаматдекарбоксилазы обнаружено в сером веществе коры головного мозга, в тo время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение γ-аминомасляной кислоты вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов. γ-Аминомасляная кислота используется в клинике при лечении некоторых заболеваний ЦНС, связанных с резким возбуждением коры головного мозга. Так, в практике лечения эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) давало введение глутаминовой кислоты. Как оказалось, лечебный эффект был обусловлен не глутаминовой кислотой, а продуктом ее декарбоксилирования γ-аминомаслянной кислотой. В животных тканях с высокой скоростью декарбоксилируются также два производных цистеина - цистеиновая и цистеинсульфиновая кислоты; в процессе этих специфических ферментативных реакций образуется таурин, который используется в организме для синтеза парных желчных кислот (см. Обмен липидов).
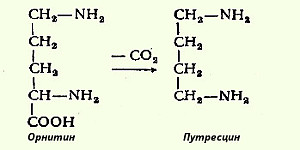
Следует указать еще на два недавно открытых в тканях животных фермента, катализирующих декарбоксилирование орнитина и S-аденозилметионина с образованием путресцина и S-метиладенозилгомоцистеамина:
Значение этих реакций, катализирующихся специфическими орнитиндекарбоксилазой и S-аденозилметиониндекарбоксилазой тканей животных, огромно, если учесть, что путресцин и аминопропильная часть S-метиладенозилгомоцистеамина используются для синтеза полиаминов - спермидина и спермина: H2N-СН2-СН2-СН2-СН2-NH-СН2-СН2-СН2-NH2 Полиамины, к которым относят также путресцин, оказались необходимыми для регуляции биосинтеза внутриклеточных полимерных молекул (нуклеиновых кислот и белков), хотя конкретная их роль в этом процессе не всегда ясна. Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разносторонее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных средств.
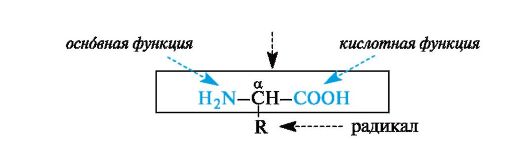
2.Понятие о пептидах и белках. Электронное и пространственное строение пептидной (амидной) связи. Пептиды и белки построены из остатков α-аминокислот. Общее число встречающихся в природе аминокислот превышает 100, но некоторые из них обнаружены лишь в определенном сообществе орга- низмов, 20 наиболее важных α-аминокислот постоянно встречаются во всех белках (схема 12.1). α-Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
2. Химические свойства α-аминокислот: а). Образование внутрикомплексных солей. б). Реакции этерификации. в). Образование пептидной связи. г). Образование амидов. Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы — COOH, так и основныесвойства, обусловленные аминогруппой — NH 2. Аминокислоты взаимодействуют с кислотами и щелочами: NH 2 — CH 2 — COOH + HCl → HCl • NH 2 — CH 2 — COOH (хлороводородная соль глицина) NH 2 — CH 2 — COOH + NaOH → H 2 O + NH 2 — CH 2 — COONa (натриевая соль глицина) Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей. NH 2 — CH 2 COOH Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов. Этерификация: NH 2 — CH 2 — COOH + CH 3 OH → H 2 O + NH 2 — CH 2 — COOCH 3 (метиловый эфир глицина) Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона. Реакция образования пептидов: HOOC — CH 2 — NH — H + HOOC — CH 2 — NH 2 → HOOC — CH 2 — NH — CO — CH 2 — NH 2 + H 2 O
Решите задачи: Задача №1 Известно, что соединения, содержащие тиольную группу, склонную к легкому окислению, выполняют защитную функцию при воздействии на организм веществ с высокой окислительной способностью. Кроме того, они проявляют противолучевое действие. В научной лаборатории сотрудник получил дозу ионизирующего излучения. Среди лекарств в лаборатории имелся только набор α-аминокислот. Вопросы: 1. Что называется α-аминокислотами? 2. Какие аминокислоты называются незаменимыми? 3. На какие группы делятся аминокислоты по химической природе радикала? 4. Какую α-аминокислоту следует ввести сотруднику, получившему дозу излучения? 5. Что образуется при окислении этой аминокислоты?
|
|||||
|
Последнее изменение этой страницы: 2016-12-17; просмотров: 1001; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.178.122 (0.011 с.) |




 N + H 3 — CH 2 COO -
N + H 3 — CH 2 COO -


