
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.Содержание книги
Поиск на нашем сайте
В отличие от уплотненной глины в неуплотненной глине поры имеют значительные размеры, в которые способны вместе с водой проникать как гидратированные ионы, так и макромолекулы полимеров. В зависимости от вида электролитов результаты взаимодействия проникших в поры глины ионов могут быть различными. Как отмечено выше, все электролиты можно разделить на три группы: щелочные, кислотные и нейтральные. При взаимодействии щелочных электролитов (невысокой концентрации) с глинистыми частицами происходит активация последних (смотри часть 1, п 4.3) SiOH+NaOH в результате чего объемная энергия глины возрастает, увеличивается «всасывание» воды, повышается влажность, понижается пластическая прочность глины. С увеличением концентрации щелочи количество катионов в растворе возрастает, увеличивается плотность эффузивного слоя и при некоторой критической концентрации электролита происходит постепенная дезактивация глинистых частиц, в результате чего толщина гидратного слоя воды вокруг частиц понижается, понижается влажность глины, повышается ее пластическая прочность глины. Степень гидратации и дегидратации для различных щелочных электролитов при повышении их концентрации различна. Она зависит от гидрофильности катионов, силы взаимодействия их с анионами раствора и растворимости электролитов. На рис. 10.1. показан график зависимости гидратации и дегидратации образцов неуплотненной глины, помещенных в растворы различных щелочных электролитов (этот и последующие графики построены по экспериментальным материалам В.Д. Городнова)
Наиболее активно гидратация протекает при введении в раствор щелочей NaOH, КОН, Ва(ОН)2, менее активно (вследствие меньшей концентрации гидроксильных групп в растворе) для щелочных солей и совсем неактивно для слаборастворимых оснований Са(ОН)2. Активность дегидратации зависит от плотности и активности катионов в диффузном слое вокруг глинистых частиц, концентрации и активности анионов электролитов. В растворах щелочных солей при гидролизе образуется значительное количество достаточно активных анионов НРО42-, Н2РО4-, НСО3- и т.д., снижающих активность катионов. В растворах хорошо растворимых щелочей (например, растворах NaOH с растворимостью 108 г. на 100мл. воды) после гидратации частиц концентрация катионов быстро возрастает, дегидратация глинистых частиц протекает интенсивно. В растворах менее растворимых щелочей Ba(OH)2 (с растворимостью 39 грамм на 100 мл. воды), количество катионов в растворе значительно меньше. Да и катионы более гидрофильны и менее подвижны. Поэтому, несмотря на большую валентность катионов, нейтрализация глинистых частиц происходит слабее, область дегидратации значительно растягивается. При взаимодействии нещелочных электролитов с глинистыми частицами гидратация частиц не возможна, даже при малой концентрации электролита в результате нейтрализации потенциала глинистых частиц наблюдается их дегидратация. Активность взаимодействия катионов с глинистыми частицами в соответствии с исследованиями К.К. Гедройца (см. часть 1, п. 4.4.) зависит от их валентности и ионного радиуса. Для почв, грунтов (в том числе и глинистых) вследствие малого ионного радиуса наибольшую активность проявляет ион водорода Н+, а наиболее сильным нещелочным электролитом являются кислоты, активно нейтрализующие потенциал частиц, интенсивно понижающие влажность глины. Как показывают экспериментальные исследования с помощью кислот можно понизить влажность глины до К2=0,3, чего вследствие гидрофильности других катионов достичь невозможно. На рис.10.2. показана зависимость влажности глинистых образцов в растворе соляной кислоты от ее концентрации. В противоположность действию на глинистые частицы щелочных электролитов вместо гидратации мы наблюдаем дегидратацию частиц. За счет нейтрализации заряда глинистых частиц при концентрации кислоты до 0,3% влажность глины понижается (до К2=0,3), а при дальнейшем повышении концентрации в растворе появляется избыток анионов Cl+ (так как часть катионов адсорбируется глинистыми частицами), который образует второй слой ДЭС глинистых частиц. Происходит их постепенная активация и гидратация до нормальной влажности глины.
Рис.10.2. Зависимость влажности глинистых образцов в растворе соляной кислоты от ее концентрации
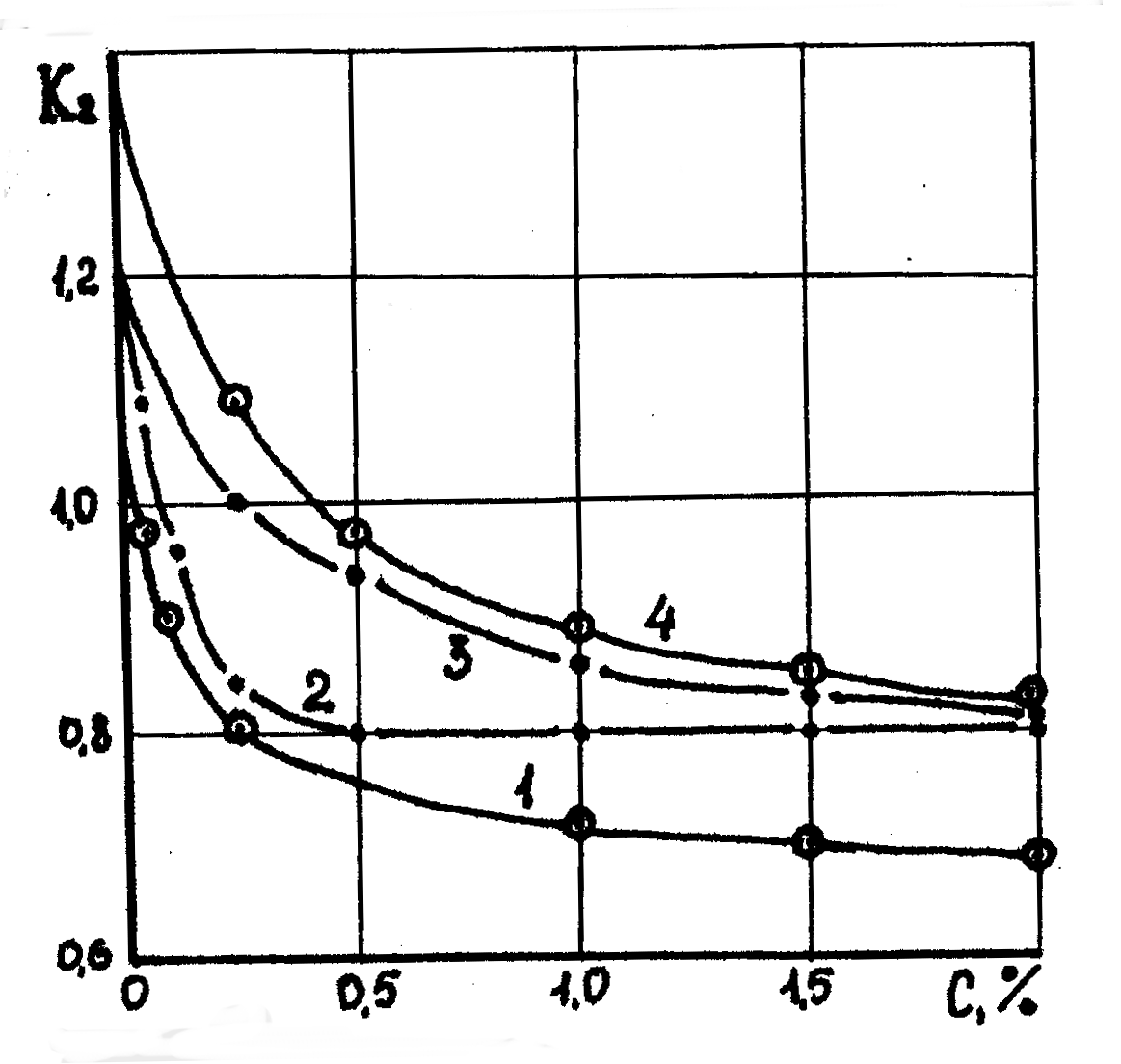
Растворы нейтральных электролитов при малых концентрациях не вызывают экстремальных значений повышения или понижения влажности глины. Начиная с нулевой концентрации, они с увеличением концентрации, плавно понижают влажность глины до некоторого предела характерного для данного раствора. Вследствие гидрофильности катионов понизить влажность глины до нуля невозможно. Интенсивность понижения влажности глины зависит от заряда, гидрофильности или глинофильности катионов, активности анионов электролита. Темп снижения влажности глины с увеличением концентрации электролитов зависит и от степени их диссоциации. При малой концентрации в соответствии с законом Оствальда степень диссоциации электролита более высокая, поэтому темп снижения влажности глины выше, чем при более высокой концентрации электролита. Из рисунка 10.3. видно, что интенсивность снижения влажности в растворе более гидрофильного электролита NaCl (1) значительно меньше, чем в растворе менее гидрофильного электролита КС1 (2), и совсем низкая интенсивность снижения влажности для электролитов с весьма активными анионами Na2SO4 (3)
Рис. 10.3. Зависимость влажности глинистых образцов в растворе электролитов солей одновалентных металлов от концентрации последних: 1 – NaCl; 2 – KCl; 3 – Na2SO4
Рис. 10.4. Зависимость влажности глинистых образцов в растворе нещелочных электролитов поливалентных металлов от концентрации последних: 1-CaCl2; 2-СаSО4; 3-ВаСl2; 4-КАlSO4.
То же самое можно наблюдать и для электролитов с поливалентными катионами (рис.10.4). Прочность глинистых пород находится в прямой зависимости от их влажности. Глинистые частицы, как отмечено, связаны между собой пленками воды. Прочность же пленок зависит от энергии межмолекулярного взаимодействия (U) каждой молекулы воды с глинистыми частицами. Глинистые частицы породы находятся на относительно небольшом расстоянии друг от друга, и каждая молекула воды взаимодействует одновременно не с одной (как в буровом растворе), а с целым рядом близлежащих глинистых частиц. Энергию взаимодействия молекул воды с этими частицами можно определить суммированием энергий взаимодействий молекулы воды с каждой частицей в отдельности, например, с помощью интегрирования. Приближенный расчет в предположении аддитивности (суммирования) энергии межмолекулярных взаимодействий как отмечено выше был проведен Буром и Гамакером [6, 9]. Для вывода уравнения энергии межмолекулярного притяжения использовалось уравнение энергии притяжения одной молекулы к поверхности адсорбента (в данном случае глинистых частиц):
где С - константа, зависящая от природы взаимодействующих молекул, n - число частиц; h - расстояние от молекулы воды до глинистых частиц (толщина пленки воды). В результате после интегрирования Бур и Гамакер получили формулу
где А-константа Гамакера, равная примерно 10-19 Дж. Удельная сила взаимодействия молекул воды с поверхностью глинистых частиц (прочность пленки) соответственно будет равной
где Со - постоянная величина. С увеличением влажности глины толщина пленки увеличивается, а ее прочность и прочность глины в целом понижаются Влажность глины можно выразить формулой
где Vв - количество воды, поглощенной глиной; S - суммарная поверхность глинистых частиц, m – количество частиц, h – толщина пленки воды. Отсюда
Подставляя значения h в формулу (10,3), получим
т.е. прочность глины обратно пропорциональна ее влажности в кубе. Отношение прочностей образца глины различной влажности можно записать в виде
а прочность образца любой влажности f i
где f - начальная прочность образца глины; К - начальная влажность образца, Кi влажность насыщенного водой образца. Экспериментальные данные подтверждают полученные расчеты (табл.10.1). Прочность «сухих» уплотненных пород с весьма тонкими водными пленками (h) во многих случаях не уступает прочности других осадочных пород: известняков, песчаников. С увеличением толщины гидратной пленки межмолекулярное взаимодействие между частицами резко понижается, понижается и пластическая прочность глины (рис.10.5). Прочность гидратной пленки с уменьшением толщины быстро возрастает. У самой поверхности частицы сила взаимодействия молекул воды достигает тысяч кг/см2 (см. часть 1, 3.3). С удалением от частицы эти силы снижаются обратно пропорционально расстоянию в седьмой степени.
Таблица 10.1 Зависимость пластической прочности образца глины от влажности К2
Рис. 10.5. Зависимость пластическойКПа дашгильской глины от количества жидкости набухания К2
Таким образом, для повышения прочности глины следует снижать ее влажность. Понизить влажность глины можно путем снижения гидрофильности частиц за счет нейтрализации их поверхности катионоактивными электролитами. Однако судя по рис.10.5. существенно повысить прочность глины за счет дегидратации можно лишь при влажности К2=0,2 см3/г и меньше, чего как мы видели достичь не возможно даже при большом горном давлении (см.9.2). Значительное повышение прочности глины достигается за счет «сшивания» глинистых частиц катионами электролитов. В результате действия электростатических (кулоновских) сил, которые действуют на значительно большем расстоянии, чем межмолекулярные. Прочность связей катионов с глинистыми частицами зависит от их заряда (валентности), гидрофильности и активности анионов (рис.10.6).
Рис. 10.6. Зависимость пластической прочности натриевых бентонитов в растворах нещелоччых электролитов от их концентрации: 1 - в растворе NaCI; 2 - в растворе KCI; 3 - в растворе СаС12 (кальциевых бентонитов); 4 - в растворе СаSО4; 5 - в растворе ВаСl2; 6 - в растворе KАl(SO4)2
Повышать прочность глины могут не только катионы, но и родственные глине (по химическому составу) анионы SiO-, AlOН-. Прочность глины в таких растворах даже при высокой влажности глины с увеличением концентрации электролита быстро возрастает. Все рассмотренные выше процессы увлажнения и упрочнения глин не учитывают влияния растворов электролитов на их диспергирование, которое существенно влияет на все процессы. В необсаженной скважине глинистые породы непосредственно контактируют с циркулирующим буровым раствором и подвергаются его механическому воздействию. При высокой объемной энергии буровых растворов (в частности, растворов электролитов) возможно не только проникновение раствора в поры горной породы, но и диффундирование глинистых частиц в раствор, что приводит к диспергированию и разупрочнению глины.
Рис.10.7. Зависимость влажности образцов бентонита, выдержанных в растворах полимеров, от их концентрации: 1-в растворе крахмала. 2-в растворе КМЦ-600, 3-в растворе гипана.
Для определения влияния концентрации раствора различных электролитов на интенсивность диспергирования и разупрочнения глины были проведены экспериментальные исследования. В качестве исследуемых пород использовалась глина, приготовленная из черногорского глинопорошка. Образцы глины выдерживались в течение двух суток в растворах соляной, серной кислот и электролитов-солей: NaCI, KCl, MgCl2, CaCl2, CuS04, AlNH4(SO4)2, Al2(SO4)3 различной концентрации. Результаты исследований показали, что все образцы в растворах электролитов различной концентрации (за исключением растворов HCl, NaCl, KCl) диспергировали и размокали уже в первые же сутки. В концентрированных растворах NaCl образцы в первые сутки несколько повышали свою прочность, но затем с увеличением времени выдержки наблюдалось понижение прочности до и ниже первоначальной. Образцы глины, помещенные в одно- и двухпроцентные растворы жидкого стекла, потрескались в первый же час, а в 5%-м растворе, несмотря на достаточно прочную корочку образцы потрескались и развалились через четверо суток. Такое явление можно объяснить следующими причинами. Силикат - ионы вследствие их активного взаимодействия с глиной проникают в образец на небольшую глубину, предотвращают поступление очередных порций SiO3-, и упрочнение глины происходит только на поверхности образца. Но жидкое стекло весьма гидрофильно и пропускает через себя воду, образец набухает и упрочненный поверхностный слой растрескивается. Этим можно объяснить и осыпание глинистых стенок скважин при промывке силикатными растворами. Подобным образом вели образцы глины в растворе бишофита (MgCl2 и MgO) в связи с высокой гидрофильностью катионов Mg2+. Образцы глины в растворах NaCl и KCl несколько повышали свою прочность видимо, в основном за счет частичной дегидратации глинистых частиц по всему объему образцов. Гидрофильность К+ и Na+ весьма низка, катионы подвижны и под воздействием отрицательно заряженных глинистых частиц они легко проникают в горную породу на значительную глубину (о чем свидетельствуют экспериментальные данные, см. раздел 10.1). Однако, под воздействием электролитов раствора происходило диспергирование образцов глины все увеличивающееся с течением времени, которое в конечном счете и привело к разрушению образцов.
Для предотвращения разрушения образцов глины, следовательно, одновременно с введением электролитов, ингибиторов набухания и сшивающих агентов в раствор следует вводить и ингибиторы диспергирования, функцию которых могут хорошо выполнять полимеры.
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 902; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.103.119 (0.009 с.) |

 ® SiO- +H2O+Na+,
® SiO- +H2O+Na+,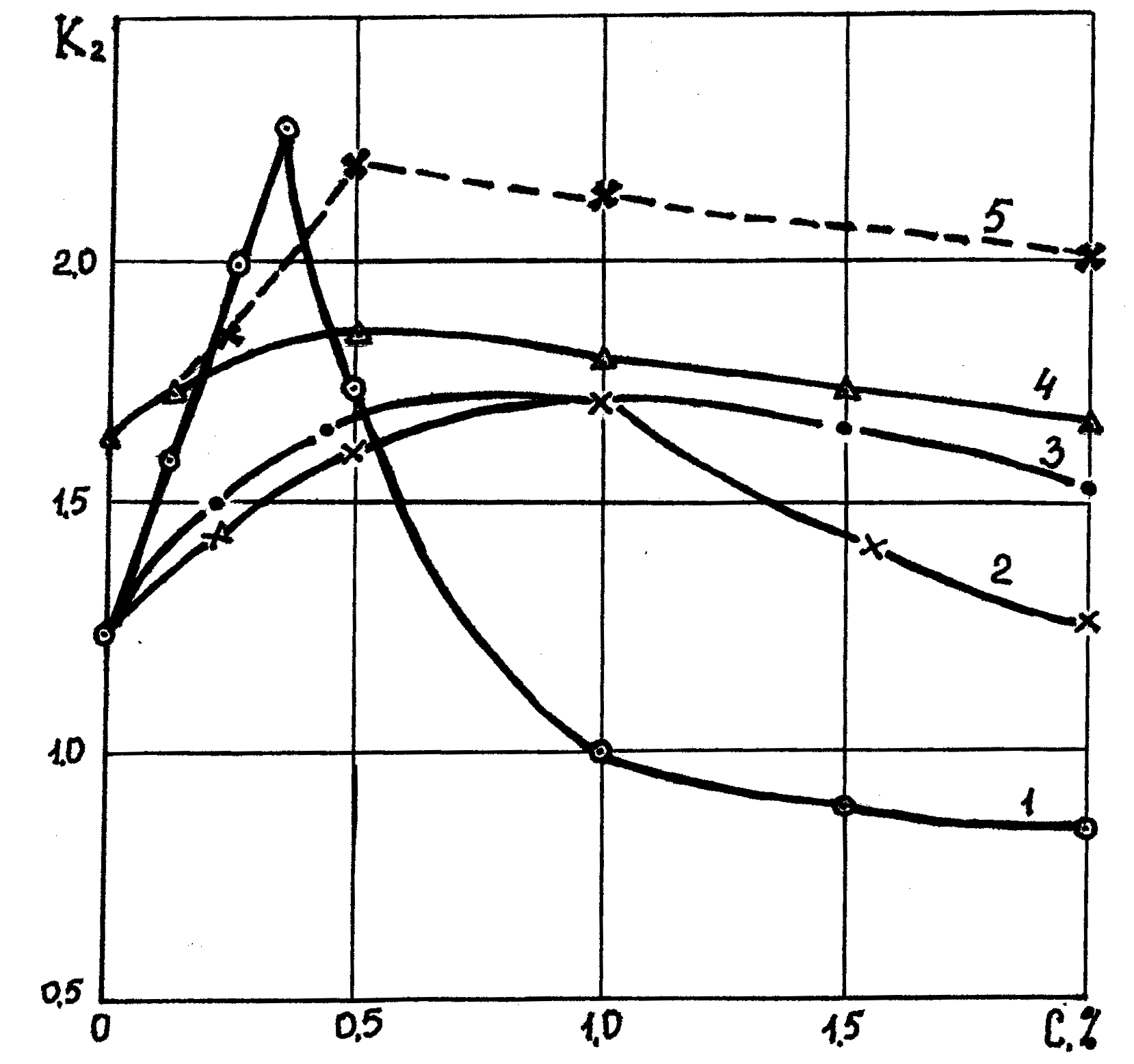 Рис.10.1. Зависимость влажности глинистых образцов К2 помещенных в раствор щелочных электролитов от концентрации последних: 1- в раствNaOH, 2 - в раствор Na2SiО3, 3- раствор Na2СО3, 4 - в раствор Na3РO4.5 - раствор Ва(ОН)
Рис.10.1. Зависимость влажности глинистых образцов К2 помещенных в раствор щелочных электролитов от концентрации последних: 1- в раствNaOH, 2 - в раствор Na2SiО3, 3- раствор Na2СО3, 4 - в раствор Na3РO4.5 - раствор Ва(ОН)

 (10.1)
(10.1) , (10.2)
, (10.2) , (10.3)
, (10.3) , (10.4)
, (10.4) , (10.5)
, (10.5) , (10.6)
, (10.6) , 10.7
, 10.7 , (10.8)
, (10.8)





