
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворение горных пород в промывочной жидкости характерно для галлоидов и сульфатов, в меньшей степени карбонатов.Содержание книги
Поиск на нашем сайте
Эти горные породы представляют собой соли с ионной постройкой кристаллической решетки, образованные в результате кристаллизации солей из насыщенных растворов водоемов, чаще всего в прибрежных районах морей и океанов. Связь между атомами - полярная, весьма слабая, осуществляется в основном за счет разноименных зарядов ионов. Растворение солей обусловлено гидрофильностью ионов, слагающих кристаллическую решетку, а также химическим сродством ионов растворяющейся соли с молекулами воды. Процесс растворения соли происходит по следующей схеме. Под воздействием электрического поля поверхности растворяющейся горной породы молекулы воды в контакте с породой ориентируются и образуют слой заряженной воды. Под воздействием поверхностной энергии образованного слоя (кулоновского взаимодействия) слабосвязанные между собой ионы отделяются от кристаллической решетки, гидратируются слоем молекул воды и диффундируют в объем раствора за счет разности концентраций ионов в контакте с солью и в объеме. На смену гидратированным молекулам воды вступают во взаимодействие с ионами кристаллов новые свободные молекулы воды. Процесс растворения происходит до тех пор, пока все молекулы воды не будут связаны ионами. В объеме до насыщения раствора солью ионы распределяются равномерно. Как известно, вода - хороший диэлектрик. Ее диэлектрическая проницаемость, при Т = 20°С, равна 81. Противоположно заряженные ионы с раствора, благодаря наличию между ними слоя воды - диэлектрика, взаимодействуют слабо. И только при незначительной толщине слоя воды между ионами (при полном насыщении раствора солью) ионы-гидраты начинают взаимодействовать между собой с образованием кристаллов. Соль выпадает в осадок. При наличии гидрофильных ионов с большим зарядом из гидрата удаляются не все молекулы воды, кристаллическая решетка образуется не из отдельных ионов, а из гидратов. Так образуются кристаллогидраты (например, бишофит MgCl26H2O из раствора соли MgCl2 и др.) Минимальное количество молекул воды в гидрате (в насыщенном растворе), меньше которого происходит кристаллизация соли, назовем координационным числом гидрата. Координационное число гидрата зависит от величины заряда иона. Чем сильнее заряд, тем больше координационное число. Для многих электролитов с относительно небольшими зарядами координационное число гидрата близко по величине числу молекул кристаллизационной воды в кристаллогидрате. При растворении горной породы (соли) на отрыв ионов от кристалла затрачивается энергия. Эта энергия постоянно пополняется за счет тепловой энергии, выделяющейся в результате гидратирования ионов. Если при гидратировании выделяется тепловой энергии больше, чем расходуется на отрыв ионов, наблюдается нагревание раствора (например, при растворении солей гидрофильных полиосновных кислот-сульфатов). Если выделяемая при гидратации тепловая энергия (при малом координационном числе гидратов) окажется меньше энергии, расходуемой на отрыв ионов, наблюдается охлаж дение раствора. В этом случае повышение температуры при подогревании раствора повысит растворимость солей. Причем чем меньше координационное число образующихся при растворении гидратов, тем при увеличении роста температуры раствора выше растворимость соли. На рис.13.1. показан характер зависимости растворимости от повышения температуры раствора солей с различными координационными числами гидратов. Критерием растворения горных пород могут служить два параметра: ее растворимость и скорость растворения. Растворимость горной породы - это ее способность растворяться в воде. Количественно она характеризуется максимальным количеством породы, способным растворяться в единице емкости воды, т.е. концентрацией насыщенного раствора данной соли. Но так как плотность и объем ионов различных солей различны, их растворимость, лучше определять по координационному числу гидрата. Оно зависит в первую очередь от величины заряда ионов, слагающих кристаллическую решетку соли. Наибольшей растворимостью обладают соли со слабыми ионными связями (малым зарядом). Это соли одновалентных металлов и одновалентных кислот (например, нитраты и галогены).
Рис. 13.1. Зависимость растворимости С от температуры Т, °С: 1 - NH4NO3, 2 - АgNО3, 3- KСl, 4 –СаСl2, 5 - NH4Cl, 6 - NaCl, 7 – CuSO4 x 5H2O
Из горных пород - соединений поливалентных металлов с остатками полиосновных кислот, обладающими большим зарядом и, следовательно, имеющими более сильные ионные связи, растворяются лишь соли гидрофильной серной кислоты: сульфаты. Причем растворимость их значительно ниже, чем растворимость солей одновалентных кислот. Максимальное количество растворяющейся соли в 100мл воды можно рассчитать по формуле
где m - максимальное количество соли в насыщенном растворе; mв - масса воды; mв = 100 г, Mв - молекулярный вес воды, Мв = 18; М - молекулярный вес соли; К - координационное число гидрата. Подставляя значения mв и Мв в формулу и решая относительно К, получим
Из данной формулы при известных значениях m и М можно определить координационное число гидрата (растворимость соли). Однако определить точное количество соли практически довольно трудно, так как она, как правило, содержит некоторое количеством влаги и механических примесей. Наличие примесей в горной породе увеличивает ее растворимость. Растворимость соли (координационное число), как известно, зависит от интегральной теплоты растворения, которая в свою очередь; зависит от прочности связей ионов с молекулами воды. Для примера можно взять соли КСl, NaCl, LiCl, в которых ионный радиус К равен 1,33 А°, Na - 0,98 А°, Li - 0,68 А°, а интегральная теплота растворения ΔН при температуре 25° и 0,01 н концентрации соли КС1 равна (+17,57) кДж/моль, NaCl - (+4,27) кДж/моль, LiCl - (-36.4) кДж/моль. Координационное число, (рассчитанное по формуле (13.2), составляет для КСl
для NaCI
для LiCI
Занесем полученные данные на сетку с координатами ΔН (интегральная теплота растворения), К (координационное число) и полученные для LiCI, NaCl и КС1 точки соединим между собой (рис.13.2). Из рис. 13.2 видно, что интегральная теплота с увеличением координационного числа возрастает; с увеличением ионного радиуса гидрофильность галогена понижается (понижается ΔН, увеличивается К);при К=8 интегральная теплота равна нулю.
Рис. 13.2. Зависимость координационного числа от интегральной теплоты растворения (при T=25оC)
Процесс растворения соли наблюдается и при насыщении раствора, так как одновременно с растворением наблюдается кристаллизация соли на стенках скважин и в объеме на частицах твердой фазы. За критерий растворяемости горных пород можно принять ее скорость растворения в воде. Скорость растворения зависит от типа горной породы, ее пористости, трещиноватости, механических примесей и температуры раствора. Растворение чистых солей в воде можно описать уравнением Фика:
где С/t - градиент концентрации раствора во времени; СH • концентрация насыщения раствора растворяющейся солью (растворимость соли); D-коэффициент диффузии; Сx – концентрация соли в растворе. При растворении солей с примесями следует делать поправку, учитывающую долю примеси (α). Тогда формулу (5.3) можно переписать в виде (при Сx=0)
где концентрация раствора
здесь mc, m - масса соли и масса раствора; ρ - плотность соли; V объем растворяющейся соли; S - поверхность контакта соли с раствором; ΔR - увеличение радиуса скважины за счет размывания соли.
Подставив полученное выражение (13.5) в формулу (13.4), получим
здесь ΔR /t = up или Период устойчивости хемогенных пород может быть определен формулой
где [ΔR] - допустимое значение увеличения диаметра скважины за счет растворения соли. В формуле (13.6) неизвестен коэффициент D. Для его определения были приведены экспериментальные исследования по растворению образцов галита (керна диаметром 42,35 мм) в чистой воде. Растворение галита оценивалось по потере веса и уменьшению линейных размеров образца. Измерение массы образцов через определенные промежутки времени проводилось на лабораторных весах, а измерение длины - штангенциркулем. Для возможности определения линейного растворения образца он с одного торца и боковой поверхности изолировался изоляционной лентой. При растворении соли NaCI в чистой воде массой m = 1 кг, плотностью ρ=2200 кг/м3, α=1, Сн=0,265 кг/л, получим D =
Результаты экспериментов сведены в таблицу 13.1. Если константу скорости растворения поваренной соли К0=Д*3600=5,5*10-6*3600=1,98*10-2 принять за стандарт, то константу скорости растворения других солей можно определить из соотношения
здесь СН концентрация насыщения рассматриваемой соли. Таблица 13.1
|
||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 525; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.221.252 (0.009 с.) |


 , (13.1)
, (13.1)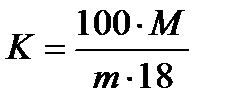 , (13.2)
, (13.2)



 , (13.3)
, (13.3) , (13.4)
, (13.4)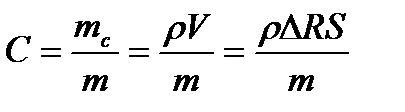 , (13.5)
, (13.5) , (13.6)
, (13.6) - скорость растворения соли.
- скорость растворения соли. , (13.7)
, (13.7)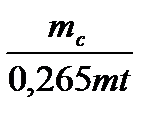
 , (13.8)
, (13.8)


