
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие в растворах электролитовСодержание книги Поиск на нашем сайте
Электролиты – химические вещества и системы, в которых прохождение электрического тока осуществляется за счет движения ионов. Такие проводники относятся к проводникам второго рода. Наличие свободных ионов объясняется явлением диссоциации (ионизации) – распадом молекул на ионы: а) при образовании растворов - под действием полярных молекул растворителя (электролитическая диссоциация); б) при образовании расплавов - в результате термического распада (термическая диссоциация). В зависимости от степени электролитической диссоциации a = n/N, (где n – число распавшихся молекул, N-исходное число растворенных молекул) электролиты подразделяются на сильные (a»1), слабые (a < 0,03) и средней силы (0,03 < a < 0,3). Степень диссоциации зависит от концентрации электролита (чем больше концентрация – тем меньше степень диссоциации). Обратимый процесс диссоциации слабых электролитов характеризуется константой диссоциации Кд. Например, для слабой уксусной кислоты, процесс диссоциации которой идет в соответствии с уравнением CH3COOH «H+ + CH3COO -, Кд = В зависимости от величины Кд электролиты подразделяются на сильные (Кд > 10-3) и слабые (Кд < 10 -3). Кд зависит только от природы электролита и температуры и является табличной величиной. Для слабых электролитов бинарного типа (распадаются на один катион и один анион) взаимосвязь между исходной концентрацией растворенного вещества (молярностью раствора - См), степенью и константой диссоциации выражается законом разведения Оствальда: Кд = a 2 См Реакции ионного обмена Для растворов электролитов наиболее характерны реакции ионного обмена. Обязательным условием протекания таких реакций практически до конца является удаление из раствора тех или иных ионов в следствие: 1) образования осадка FeSO4 + 2 NaOH ® Fe(OH)2¯ + Na2SO4 - молекулярное уравнение (МУ) Fe2++SO42-+2Na++2OH-®Fe(OH)2¯+2Na++SO42— ионно-молекулярное уравнение (ИМУ). Fe2+ +2OH- ® Fe(OH)2¯ ПР (Fе(OH)2) = 4,8×10-16 – краткое ионно-молекулярное уравнение образования осадка; Выделение газа Na2CO3 + 2H2SO4 ® H2CO3 + 2NaHSO4 (МУ) 2Na+ +CO32- + 2H+ + 2HSO4- ® H2CО3 + 2Na+ + 2HSO4- (ИМУ) 2H+ + CO32- ® H2C03 Угольная кислота является нестойкой, поэтому она разлагается: H2CO3 ® H2О +CО2 2H+ + CO32- ® H2O + CО2 - ионно-молекулярное уравнение образования летучего соединения и слабого электролита Н2О. 3) образование мало диссоциирующих веществ а) 2KCN + H2SO4 ®2HCN + K2SO4 (МУ); 2K+ + 2CN- + 2H+ +SO42- ® 2HCN + 2K+ +SO42- (ИМУ); CN- + H+ ® HCN –ионно-молекулярное уравнение образования слабого электролита HCN (Кд HCN)= 7,8´10-10). б) NaOH + HCl ® NaCl + H2O (МУ) Na+ + OH- + H+ + Cl- ® Na+ + Cl- + H2O (ИМУ) OH- + H+ ® H2O ионно-молекулярное уравнение образования слабого электролита H2O (КдH2O = 1,8´10-16) 4) образование комплексных соединений ZnCl2 + 4NH3 ® [Zn (NH3)4]Cl2 (МУ); Zn2+ + 2Cl- +4NH3 ® [ Zn (NH3)4]2+ + 2Cl- -(ИМУ); Zn2++4NH3 ® [Zn(NH3)4]2+-ионно-молекулярное уравнение образования комплексного катиона. Встречаются процессы, при которых слабые электролиты или малорастворимые соединения входят в число исходных веществ и продуктов реакции. Равновесие в этом случае смещается в сторону образования веществ, имеющих наименьшую константу диссоциации или в сторону образования менее растворимого вещества: NH4OH + HCl ® NH4Cl + H2O (МУ); NH4OH + H+ + Cl- ® NH4+ + Cl- + H2O (ИМУ); NH4OH + H+ ® NH4+ + + H2O (ИМУ); Кд (NH4OH) =1,8× 10-5 Кд (H2O) =1,8×10-16 Равновесие сдвинуто в сторону образования молекул воды, т.е реакция протекает в прямом направлении. HCN + CH3COONa ® NaCN + CH3COOH (МУ); HCN + CH3COO- + Na+ ® Na+ + CN- + CH3COOH (ИМУ); HCN + CH3COO- ® CN- + CH3COOH Kд (HCN)=7,9× 10-10 Кд (CH3COOH) =1,8 ×10-5 Равновесие сдвинуто в сторону образования HCN, т.е. реакция практически не протекает AgCl + NaI ®AgI + NaCl (МУ); AgCl + Na+ +I- ®AgI + Na+ +Cl- (ИМУ); AgCl + I- ®AgI + Cl- ПР(AgCl)=1,78×10-10, ПР(AgI) =8,3×10-17 Равновесие сдвинуто в сторону образования труднорастворимого соединения AgI. Могут встречаться процессы, в уравнениях которых есть и малорастворимое соединение и слабый электролит MnS + 2HCl ® MnCl2 + H2S MnS + 2H+ +2Cl- ® Mn 2+ + 2Cl- + H2S MnS¯ + 2 H+ ®Mn2+ + H2S ПР(MnS)=2,5×10-10; [S-2]= Kд (H2S)= K1×K2= 6´10-8´1´10-14 =6×10-22; [S2-]= Связывание ионов S2- в молекулы H2S происходит полнее, чем в MnS, поэтому реакция протекает в прямом направлении. Задачи 77. Будут ли протекать реакции между растворами следующих электролитов: 1) K2CO3 и HCl; 2) KNO3 и Na2S; 3) CdSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций. 78. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: при смешении растворов каких солей можно получить в осадке карбонат кальция? 79. Будут ли протекать реакции между растворами следующих электролитов: Ba(OH)2 и HNO3; 2) (NH4)2SO4 и KOH; 3) CuSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций. 80. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: растворы каких солей надо смешать для получения в осадке сульфата бария? 81. Написать молекулярные и ионно-молекулярные уравнения реакций между растворами следующих электролитов: 1) сульфита натрия и серной кислоты; 2) хлорида цинка и гидроксида натрия; 3) карбоната калия и соляной кислоты. 82. Написать молекулярные и ионно-молекулярные уравнения реакций: 1) растворения сульфида железа (II) в соляной кислоте; 2) взаимодействия сульфата кадмия и гидроксида натрия; 3) растворения гидроксида алюминия в избытке раствора щелочи. 83. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: 1) CuSO4 и NaNO3; 2) Na2CO3 и HCl; 3) AgNO3 и NaCl? Ответ обосновать с помощью молекулярных и ионно-молекулярных уравнений. 84. Смешивают попарно растворы: 1) NaOH и HNO3; 2) K2CO3 и HCl; 3) CuSO4 и KOH. В каких случаях протекают реакции? Составить их молекулярные и ионно-молекулярные уравнения. 85. Написать уравнения реакций между растворами следующих электролитов: 1) К2CO3 и НСl; 2) AgNO3 и K2CrO4; 3) Zn(OH)2 и KOH(избыток). 86. Будут ли протекать реакции между растворами следующих электролитов: Na2SO4 и BaCl2; 2) NaHCO3 и NaOH; 3) Pb(NO3)2 и KOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций. 87. Смешивают попарно растворы следующих электролитов: 1) NaOH и HCl; 2) K2SО3 и HCl; 3) H2SO4 и CH3COONa. Какие из реакций протекают практически до конца? Составить молекулярные и ионно-молекулярные уравнения соответствующих реакций. 88. Составить молекулярные и ионно-молекулярные уравнения реакций, происходящих в растворах между: 1) сероводородом и сульфатом никеля (II); 2) гидрокарбонатом и гидроксидом калия; 3) хлоридом аммония и гидроксидом калия. 89. Написать молекулярные и ионно-молекулярные уравнения реакций нейтрализации: 1) HCl + Ba(OH)2; 2) Fe(OH)2 + HNO3; 3) H2S + NaOH. Указать какие из этих реакций протекают обратимо. 90. Написать молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между: 1) Na2SO3 и HCl; 2) Cr2(SO4)3 и KOH; 3) Na2CrO4 и AgNO3. Указать в каждом случае соединение, образование которого вызывает смещение равновесия. 91. Составить молекулярные уравнения к следующим ионно-молекулярным уравнениям:
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 355; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.209.231 (0.006 с.) |


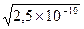 =1,58.10-5 моль/л
=1,58.10-5 моль/л =0,54.10-7.
=0,54.10-7.


