
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионное произведение воды. Водородный показатель.Содержание книги Поиск на нашем сайте Вода хотя и весьма незначительно, но все же диссоциирует на ионы: Н2ОÛ Н+ + ОН-. Следовательно, вода является типичным амфотерным электролитом, т.е. она может действовать в равной степени и как кислота и как основание. Установлено, что константа диссоциации воды равна Судя по значению этой величины, вода является очень слабым электролитом. Произведение концентраций водородных и гидроксид-ионов, которое при данной температуре является постоянной величиной, называется ионным произведением воды, его обозначают Кw. При 250С Кw =[Н+][ОН-]=10-14. Для процессаН+(р) + ОН- (р) Û Н2О(р) , D Н 0298 = -56кДж/моль; обратный процесс - диссоциация воды является эндотермическим процессом. Отсюда, в соответствии с принципом Ле-Шателье, температура будет оказывать влияние на Кw. Для характеристики кислотности раствора используют водородный показатель (рН). рН = - lg [H+], где [H+] - концентрация ионов водорода в моль/л. Т.к. Кw ¹ 0, то и не может быть водного раствора, в котором концентрация Н+ или ОН- равнялась бы нулю. Следовательно, в любом водном растворе присутствуют совместно ионы Н+ и ОН-. Для нейтральной среды [Н+] = [ОН-] =
Шкала рН для ст.у. кислая среда щелочная среда
0 7 14 рН Нейтральная среда Пример 1. Рассчитать рН 0,01 М раствора NaOH. Решение: NaOH является сильным электролитом (α=1), тогда с учетом полной диссоциации NaOH → Na+ + OH-, концентрация гидроксид-ионов составит [OH-] = 0,01моль/л. Исходя из ионного произведения воды Кw =[H+][OH-] = 1´ 10-14 определяем концентрацию ионов водорода [H+]= Пример 2. Определить молярность раствора HNO3, если концентрация гидроксид-ионов в нем составляет [OH-] = 10-11 моль/л. Решение: HNO3 – сильный электролит (α =1), тогда с учетом полной диссоциации азотной кислоты, протекающей по уравнению HNO3 → H+ + NO3-, молярность раствора (СМ, моль/л) численно равна концентрации ионов водорода, которую определяем исходя из ионного произведения воды Кw =[H+][OH-] = 1´ 10-14: [H+]= Kw/[OH-] = 10-14/10-11 = 0,001 моль/л. Молярность раствора равна 0,001 моль/л. Пример 3. Вычислить концентрацию ионов водорода и степень диссоциации 0,002М раствора HNO2. Константа диссоциации Кд = 5´10-4. Решение: Азотистая кислота – слабый электролит, процесс диссоциации можно выразить следующим уравнением: HNO2 Û H+ + NO2-. Напишем математическое выражение константы диссоциации Подставляя данные значения в выражение константы диссоциации и пренебрегая величиной X в знаменателе из-за ее малого значения, находим [H+] =X = Пример 4. Определить рН 0,2 М раствора NH4OH (Kд = 1,8´10-5). Решение: Диссоциация слабого электролита NH4OH протекает по уравнению NH4OHÛ NH4+ + OH-. Напишем математическое выражение константы диссоциации Кд = Подставляя эти величины в выражение константы диссоциации NH4OH и, пренебрегая Х в знаменателе из-за его малого значения, находим [OH-] = X= = Из ионного произведения воды определяем [H+] = Затем находим водородный показатель рН = - lg [H+] = - lg (5,3´10-12) = 11,28. Пример 5. Определить молярность и концентрацию гидроксид-ионов ([ОН-]) (моль/л) раствора HCN, для которого рН=5,1. Кд = 7,9´10-10. Решение: Исходя из значения рН=5,1, по формуле для водородного показателя рН=- lg [H+] находим концентрацию ионов водорода: [H+]=8×10-6моль/л. Затем из ионного произведения воды Кw =[H+][OH-] = 1×10-14 определяем концентрацию гидроксид-ионов водорода [ОH-]= Kw /[H+] = 10-14/8×10-6 = 1,25×10-9 (моль/л). Диссоциация цианистоводородной кислоты протекает по уравнению HCN ↔ H+ + CN -; т.к. n Н+ : n СN-=1:1, концентрации ионов [H+]=[CN - ] = 8,10-6моль/л. Исходя из математического выражения константы диссоциации Задачи 92. Рассчитать рН 0,001 М раствора NaOH. 93. Рассчитать рН 0,18 М раствора NH4OH, если Кд = 1,8´10-5. 94. Как изменится рН чистой воды, если к 1 л ее прибавить 0,01 моль H2SO4? 95. Определить рН и концентрацию гидроксид-ионов (моль/л) в 0,1 М растворе HCl. 96. Определить степень диссоциации уксусной кислоты CH3COOH, рН которого равен 3. Кд = 1,8´10-5. 97. Как изменится рН чистой воды, если к 1 л ее добавить 0,001 моль NaOH? 98. Вычислить молярность раствора щелочи, рН которого равен 12. 99. Определить рН 0,01 М раствора HCN, Кд = 7,9´10-10 100. Определить молярную концентрацию и рН раствора HCl, если концентрация гидроксид-ионов равна 10-14 моль/л. 101. Какова концентрация гидроксид-ионов в растворах, рН которых 9, 7, 4? Какую реакцию среды имеют эти растворы? 102. Концентрация гидроксид-ионов в растворе КОН равна 10-2 моль/л. Определить рН и молярность данного раствора. 103. Определить рН и концентрацию гидроксид-ионов (моль/л) 0,1М H2S раствора, учитывая только первую ступень диссоциации, для которой Кд = 6.10-8. 104. Определить молярность и рН раствора HCN, если концентрация гидроксид-ионов в нем составляет 10-9 моль/ л. Кд = 7,9´10-10. 105. Вычислить степень диссоциации и рН 0,1М раствора HNO2. Кд = 5´10-4. 106. Рассчитать молярность раствора NH4OH, рН которого равен 11. Кд = 1,8´10-5. 107. Чему равен рН растворов сильных электролитов (α =1) KCl, HCl, KOH, концентрация которых равна 0,01М? 108. Определить молярность и концентрацию гидроксид-ионов (моль/л) раствора HNO2, рН которого равен 4. Кд = 5´10-4. 109. рН раствора H2SO4 равен 6. Рассчитать молярность раствора и концентрацию гидроксид-ионов в данном растворе. 110. В каком из растворов, 0,01 М NaOH или 0,01 М NH4OH (Кд = 1.8´10-5), щелочность среды больше? Ответ подтвердите расчетом рН.
|
||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 798; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |


 .
.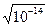 =10-7 моль/л, следовательно, рН=7. В кислой среде [Н+]> 10-7 моль/л, т.е. 0< рН <7, в щелочной среде [ОН-] > 10-7моль/л, т.е. 7 < рН £ 14.
=10-7 моль/л, следовательно, рН=7. В кислой среде [Н+]> 10-7 моль/л, т.е. 0< рН <7, в щелочной среде [ОН-] > 10-7моль/л, т.е. 7 < рН £ 14.


 =
= 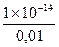
 . Обозначим [H+] = X моль/л. Из уравнения диссоциации (согласно стехиометрическим коэффициентам) следует, что [H+] = [NO2-] = X. Концентрация недиссоциированной кислоты составит [HNO2] = (0,002 – X) моль/л.
. Обозначим [H+] = X моль/л. Из уравнения диссоциации (согласно стехиометрическим коэффициентам) следует, что [H+] = [NO2-] = X. Концентрация недиссоциированной кислоты составит [HNO2] = (0,002 – X) моль/л. = 1´10-4 моль/л. Зная концентрацию ионов водорода, можно определить степень диссоциации a = [H+]/Cм = (1´10-4/0,002) ´100% = 0,05 или в процентах a = 0,05´100% = 5%.
= 1´10-4 моль/л. Зная концентрацию ионов водорода, можно определить степень диссоциации a = [H+]/Cм = (1´10-4/0,002) ´100% = 0,05 или в процентах a = 0,05´100% = 5%. . Обозначим [OH-] = X. Из уравнения диссоциации NH4OH следует, что [OH-] = [NH4+]= X моль/л. Концентрация недиссоциированного гидроксида аммония [NH4OH] = (0,2 – X) моль/л.
. Обозначим [OH-] = X. Из уравнения диссоциации NH4OH следует, что [OH-] = [NH4+]= X моль/л. Концентрация недиссоциированного гидроксида аммония [NH4OH] = (0,2 – X) моль/л. =1,9´10-3 моль/л.
=1,9´10-3 моль/л. = 5,3´10-12.
= 5,3´10-12. или
или  , определяем молярность раствора HCN: [HCN]=0,01 моль/л.
, определяем молярность раствора HCN: [HCN]=0,01 моль/л.


