
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сильных и слабых электролитовСодержание книги
Поиск на нашем сайте
Учебное пособие
Волгоград, 2009
УДК 541. 1
Р е ц е н з е н т ы: Волжский филиал Московского энергетического института, зав. кафедрой "Технология воды и топлива ", к.х.н., с.н.с. Гончарова Л. К. Волжский институт строительства и технологии, кафедра " Технология, обработка и производства материалов", к.х.н., доц. Наумова Л. Н. Печатается по решению редакционно-издательского совета Волгоградского государственного технического университета
ISBN-978-5-9948-0075-2 Электропроводность растворов сильных и слабых электролитов: Учебное пособие по физической химии. / Г. И. Зорина; ВПИ (филиал) ВолгГТУ. - Волгоград, 2009. - 76 с.
В учебном пособии изложены основные разделы электрохимии применительно к водным растворам электролитов. Рассмотрены свойства растворов электролитов, их электропроводность, теория сильных электролитов. Уделено внимание основным законам электрохимии, законам Фарадея и явлениям переноса электричества. В работе представлены тесты по электрохимии сильных и слабых электролитов, приведены контрольные вопросы для оценки качества усвоения материала, дан перечень рекомендуемой литературы. Предназначено для студентов, обучающихся по направлениям: 550800(240100) “Химическая технология и биотехнология”, 551800 (150400) “Технологические машины и оборудование” и специальностям: 250500 (240501) “Химическая технология высокомолекулярных соединений”, 250600 (240502) “Технология переработки пластических масс и эластомеров”, 170500 (240801) «Машины и аппараты химических производств», 210200 (220301) «Автоматизация технологических процессов и производств (по отраслям)».
Табл. 2., рис. 18. Библиогр. 9 назв. ISBN-978-5-9948-0075-2
Ó Волгоградский государственный технический университет, 2009 Ó Волжский политехнический институт,
Теоретическая часть Основные понятия электрохимии Электрохимия – это раздел физической химии, изучающий закономерности превращения электрической энергии в химическую (при электролизе) и обратный процесс (при работе гальванических элементов). Так как эти процессы совершаются за счет изменения состояния ионов и связаны с нарушением ионных равновесий, то электрохимия изучает также вопросы электропроводности электролитов, ионных равновесий и кинетики электродных процессов. Взаимный переход химической и электрической энергии происходит в электрохимических системах, состоящих из электродов и электролитов. История электрохимии насчитывает более 300 лет. Возникновение электрохимии относится к рубежу XVIII-XIX вв. В области электрохимии работали лучшие умы человечества. М.В. Ломоносов ( 1752 г.) указал на то, что «Без химии путь к познанию электричества закрыт», Л. Гальвани (1791 г. ) исследовал электрические явления при мышечном сокращении, обнаружил возникновение разности потенциалов при контакте металла с электролитом. А. Вольт (1800 г.)создал первую гальваническую батарею - вольтов столб. М. Фарадей (1833 - 34 г.) сформулировал количественные законы электролиза, а также ввел термины: электролит, электролиз, электроды, катод, анод, ионы. Ф. Кольрауш (1879г.) вывел закон независимого движения ионов, получил зависимость удельной электропроводности от концентрации c= f(c) для сильных электролитов, предложил схему измерения удельной электропроводности (c) (1885г), вывел ионное произведение воды (1894). С. Аррениус (1884 - 1889г.) сформулировал основные положения теории электролитической диссоциации. Я. Гейровский (1922г.) создал полярографический метод,а в соавторстве с М. Шикатой (1925г.) сконструировал полярограф. П.Д. Дебай и Э. Гюккель (1923-1926г.)сформулировали теорию сильных электролитов. Электрохимия находит широкое применение на практике: 1. Химические источники электрической энергии в быту, на транспорте, в промышленности (аккумуляторы, батарейки). 2. Получение различных веществ методом электролиза, рафинирование металлов, гальванопластика, гальваностегия. 3. Использование электрохимических методов в аналитической химии и ФХМА (потенциометрия, кондуктометрия, полярография, амперометрия, кулонометрия, электроанализ и т. д.) 4. Новая отрасль техники - хемотроника - занимается созданием электрохимических преобразователей информации. 5. Изучение процессов коррозии и разработка эффективных методов защиты от нее. Электролитами называются вещества, которые в растворе или расплаве распадаются на ионы - электрически заряженные частицы. Количество ионов каждого знака определяется формулой вещества:
Молекулы в целом являются электронейтральными частицами: сумма положительных зарядов должна быть равна сумме отрицательных зарядов. Электролиты, молекулы которых распадаются на 2 иона, называются бинарными или симметричными, например: КСl, НВr - 1,1 валентный электролит; CuSO4, FeS - 2,2 валентный электролит. В качестве примеров несимметричных электролитов можно привести следующие: K2SO4 - 1,2 валентный электролит; MgCl2 - 2,1- валентный электролит. Все вещества делятся на две группы. Растворы одних веществ не проводят электрический ток, они называются изоляторами. Растворы других веществ проводят электрический ток, они называются проводниками. Проводники в свою очередь делятся на проводники первого (металлы, уголь, графит) и второго рода (растворы электролитов). В проводниках первого рода имеет место электронная проводимость, осуществляемая без переноса вещества, а в проводниках второго рода имеет место ионная проводимость, осуществляемая с переносом вещества. С ростом температуры электропроводность проводников первого рода уменьшается за счет роста сопротивления, а в проводниках второго рода с ростом температуры электропроводность увеличивается за счет уменьшения вязкости раствора, что способствует увеличению абсолютной скорости движения ионов. Однако, при определенной температуре начинает сказываться увеличение хаотического движения ионов и электропроводность начинает уменьшаться. В целом электропроводность проводников первого рода значительно превышает электропроводность проводников второго рода: W2 << W1. Как уже указывалось, в электрохимических процессах осуществляется перенос вещества. Основными видами переноса являются: Диффузия - перенос вещества, обусловленный неравенством химических потенциалов внутри системы или между системой и окружающей средой. Конвекция - перенос вещества под действием внешних механических сил. Миграция - перенос заряженных частиц в электрическом поле, обеспечивающий электрическую проводимость раствора. Электролиты подразделяются на сильные (HCl, NaCl, H2SO4 и т.д.) и слабые (NH4OH, CH3COOH и т.д.). Иногда группу электролитов, занимающих среднее положение, называют электролитами средней силы. Сильные электролиты полностью распадаются на ионы при растворении, в твердом виде эти вещества имеют либо ионную, либо сильнополярную связь. Слабые электролиты при растворении в воде диссоциируют на ионы частично. Для количественной оценки полноты диссоциации была принята величина a, названная степенью диссоциации, которая определяется отношением числа продиссоциировавших молекул N д к общему числу молекул N:
Для электролитов теоретические данные по понижению давления пара растворителя над раствором, по осмотическому давлению (П), понижению температуры замерзания (ΔТзам) и повышению температуры кипения растворов (ΔТкип) всегда получались меньше практических величин. Изучая разбавленные растворы, Вант-Гофф отметил постоянное несоответствие теоретических и практических данных. Для устранения этого несоответствия Вант-Гофф предложил ввести поправку - i – изотонический коэффициент, который учитывает увеличение числа частиц в процессе диссоциации и определяется по формуле:
где Nc - число частиц (ионы + молекулы). В табл.1 представлены основные законы разбавленных растворов для неэлектролитов и электролитов. Законы разбавленных растворов электролитов и неэлектролитов Таблица 1
Изотонический коэффициент связан со степенью диссоциации вещества. Для вывода этой зависимости введем следующие обозначения: a ∙N - число распавшихся молекул; k – число ионов, на которые распадается электролит; a∙ N∙k - число ионов, образовавшихся при диссоциации; (1- a) - доля непродиссоциировавших молекул; N(1 - a) - число непродиссоциировавших молекул. Тогда число частиц можно рассчитать по формуле NС = a∙ N∙k + N∙(1 - a). (3) Подставляем уравнение (3) в уравнение (2):
Выносим N за скобки: Раскрываем скобки, сокращаем N и получаем: i = a ∙k + (1 - a), i = 1 + a(k -1). (4) Из полученного уравнения находим степень диссоциации:
В зависимости от числа ионов, на которые распадаются молекулы, изотонический коэффициент стремится к целым числам: i => 2 для KCl, CuSO4 (k = 2); i => 3 для CuCl2, H2S, Na2SO4 (k = 3); i => 4 для AlCl3 Fe (NO3)3 (k = 4).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 248; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |




 KtxAny xKtY+ + yAnХ-.
KtxAny xKtY+ + yAnХ-.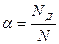 . (1)
. (1)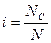 , (2)
, (2)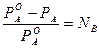
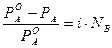
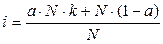 .
.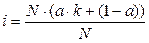 .
.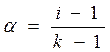 . (5)
. (5)


