
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Абсолютная и относительная скорость движения ионовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
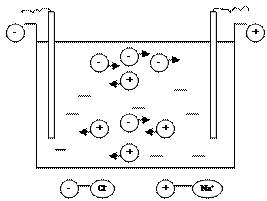
Электрический ток в растворах переносится ионами. От скорости перемещения ионов зависит электропроводность раствора. Скорость движения ионов зависит от: 1) природы растворенного вещества (строение молекулы, радиус, заряд); 2) природы растворителя; 3) температуры; 4) концентрации раствора. Скорость движения ионов, по сравнению со скоростью движения молекул в газовой фазе, чрезвычайно мала, так, например, при 18ºС скорость движения ионов водорода составляет 0,0082 см/сек, тогда как скорость движения молекул водорода в газовой фазе колеблется в пределах от 10 до 100 м/сек. Малые скорости ионов объясняются следующим: 1) ионы движутся в вязкой среде растворителя, молекулы которых движутся хаотично; 2) на движение иона оказывает тормозящее действие противоионные облака; 3) гидратация или сольватация ионов делает передвигающиеся частицы еще более громоздкими, т. к. в растворе передвигаются целые комплексы. Кроме того, скорость движения зависит от величины приложенного напряжения. Если ионы имеют окраску, например, MnO42-, Cu2+, Fe3+, Cr2O72-, то о скорости движения окрашенных ионов можно судить по смещению цветной границы. Абсолютной скоростью ионов называют скорость, выраженную в м/с при приложенной разности потенциалов 1 В на 1 м длины. Скорость обозначается буквой U и имеет размерность [ м2/с×В]. Наибольшей скоростью передвижения обладает ион водорода Н+, второе место занимает ион гидроксила ОH-. Это объясняется тем, что кроме переноса электричества путем непосредственного движения этих ионов значительно большую роль играет механизм электрической проводимости, называемый эстафетным. Ион водорода в воде гидратируется и в растворе существует в виде иона гидроксония: Н+ + Н2О = Н3О+. При передвижении иона в электрическом поле происходит перескок протона от иона гидроксония Н3О+ к определенным образом ориентированной соседней молекуле Н2О, в результате чего она превращается в (Н3O+)* по схеме: Н3O+ + Н2О => Н2О* + (Н3O+)*. Такие перескоки совершаются очень быстро, чем и обеспечивается высокая подвижность при переносе электричества ионами гидроксония и гидроксила. Аналогичным образом объясняется перенос электричества ионом гидроксила ОН-. В этом случае гидроксил совершает проскок к молекуле воды, в результате чего она превращается в ион гидроксила (ОН-)*: Н2О + ОH- => (ОH-)* + Н2О*. Растворы солей, кислот и оснований обладают способностью проводить электрический ток. Это свойство служит наглядным подтверждением электролитической диссоциации, в результате которой нейтральные молекулы распадаются на положительно и отрицательно заряженные ионы. В электрическом поле между двумя электродами, погруженными в раствор электролита, положительные ионы (катионы) перемещаются в направлении катода - электрода, имеющего отрицательный заряд, а отрицательно заряженные ионы (анионы) движутся в противоположном направлении – к аноду, положительно заряженному электроду. На рис. 9 показано движение ионов в межэлектродном пространстве.
Рис. 9 Движение ионов в межэлектродном пространстве В первом приближении такое перемещение ионов можно уподобить движению твердого шарика в вязкой среде под действием силы тяжести. Скорость этого движения становится постоянной, когда действующая сила уравновешивается силой трения. Сила электрического поля равна: F= z где Е - напряженность электрического поля, в/см; z - валентность иона;
Сила трения выражается формулой Стокса: где h - вязкость жидкости, пуаз; r - радиус иона, см; U - скорость движения иона, см/сек. Когда обе силы уравновешиваются, то: Откуда находим скорость движения ионов, которая при постоянной температуре является постоянной величиной:
Полученное уравнение показывает, что скорость движения иона обратно- пропорциональна его радиусу и возрастает вместе с увеличением напряженности электрического поля. Эта скорость при напряженности электрического поля, равной 1 В/см называется абсолютной скоростью движения иона. Она имеет порядок 10-4 см2/с·В или 10-8 м2/с·В, поэтому в электрическом поле с относительно малой напряженностью ионы движутся очень медленно. Обозначим через υ к скорость движения катионов, а υ a - скорость движения анионов и вычислим относительные скорости:
Относительные скорости движения ионов называют числами переноса. Числа переноса характеризуют долю электричества, переносимого ионами данного вида. Сумма чисел переноса равна единице: nк + na = 1. (62) Отношение чисел переноса аниона и катиона пропорционально отношению их абсолютных скоростей:
Более удобной для расчетов является величина, называемая подвижностью иона или эквивалентной электропроводностью иона при бесконечно большом разбавлении. Она обозначается la и lк и связана со скоростью движения ионов уравнениями:
где F - число Фарадея. Подвижностью ионов называется электропроводность 1кг-экв. иона при бесконечном разбавлении при приложенной разности потенциалов 1В на 1м длины. Скорость и подвижность ионов связаны с размерами ионов и массой ионов. Например, скорость и подвижность ионов водорода гораздо больше скорости и подвижности ионов свинца. Скорость и подвижность имеют различные значения в растворах и расплавах. Так, например, в растворе подвижность иона лития меньше, чем подвижность иона натрия ( Скорость и подвижность ионов связаны и с природой растворителя: так, при 25оС подвижность иона водорода в воде составляет 35, в метиловом спирте - 14, а в этиловом спирте - 6 См · м2 / кг-экв. Это связано с диэлектрической проницаемостью молекул растворителя. Закон Кольрауша: Эквивалентная электрическая проводимость электролитов при бесконечно большом разбавлении определяется только суммой эквивалентных электрических проводимостей. l¥ = l+ + l-, (65) l¥ = l+ + l-, (66) l¥ = F۰(υ+ + υ-). (67) Закон Кольрауша применяется в ограниченных диапазонах концентраций. При концентрации выше 0,01-0,05н сказывается тормозящее воздействие ионов, закон перестает быть точным. Для концентрированных растворов он неприменим вообще. Расчет чисел переноса по электропроводности в настоящее время является наиболее употребительным и надежным методом. В соответствии с этим законом при бесконечном разбавлении раствора ионы электролита движутся независимо друг от друга, а электрическая проводимость такого раствора складывается из электропроводности отдельных видов ионов. 1.11. Способы определения чисел переноса Определение чисел переноса можно производить двумя способами: 1) по изменению концентрации раствора в приэлектродном слое; 2) по смещению движущейся границы.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 2355; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.5 (0.01 с.) |

 Е, (58)
Е, (58)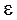 - элементарный электрический заряд.
- элементарный электрический заряд. , (59)
, (59) .
. . (60)
. (60) ,
,  . (61)
. (61)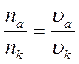 . (63)
. (63) ;
;  , (64)
, (64) ), а в расплаве наблюдается обратная картина (
), а в расплаве наблюдается обратная картина ( ). Это объясняется тем, что в растворе ионы подвергаются гидратации, и в электрическом поле движутся гидратированные ионы, а в расплаве перемещаются одиночные ионы, и здесь оказывает влияние размер иона
). Это объясняется тем, что в растворе ионы подвергаются гидратации, и в электрическом поле движутся гидратированные ионы, а в расплаве перемещаются одиночные ионы, и здесь оказывает влияние размер иона  .
.


