
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз расплавов и растворовСодержание книги
Поиск на нашем сайте
Электролизом называется совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита. Электрохимические реакции протекают на обоих электродах электролитической ячейки (электролизера), когда к ним приложена электродвижущая сила от внешнего источника. Прохождение электрического тока через раствор электролита зависит не только от направленного движения положительных ионов к катоду и отрицательных к аноду. Носителями электрического тока во внешней цепи являются электроны. Они освобождаются на аноде в результате электрохимического окисления и, поступая далее во внешнюю цепь, перетекают к катоду, где связываются, благодаря процессу электрохимического восстановления. Совокупность этих двух процессов носит название электролиза- разложения электролита при протекании электрического тока. Процессы окисления на аноде и восстановления на катоде всегда строго сбалансированы. Это означает, что количество образовавшихся на аноде электронов в точности равно количеству электронов, участвующих в реакции восстановления на катоде. При всяком ином соотношении между анодным и катодным процессами электролиз мог бы приводить к нарушению электронейтральности системы, что никогда не наблюдается на практике. Анодный процесс заключается в переходе восстановленной формы в окисленную с потерей одного или нескольких электронов:
Катодный процесс заключается в превращении окисленной формы в восстановленную благодаря присоединению одного или нескольких электронов; его уравнение имеет вид: Ох + zе - ® Red.
Возможными анодными процессами являются: 1. Образование катионов металлов в результате растворения электрохимически активного металла: Me - zе – ® Me z+.
2. Разряд анионов из раствора на инертном электроде (платине, золоте, пассивном металле). Примером такого процесса может служить анодное выделение кислорода при электролизе воды: 2H2O - 4 е – ® О2 + 4H+.
3. Анодное окисление металлов с образованием труднорастворимых соединений, например: Ag + Cl` - е – ® AgCl.
4. Перемена валентности ионов в растворе в сторону увеличения положительного заряда (или уменьшения отрицательного заряда):
Fe2+ - е - ® Fe3+, или Fe (CN)64- - е - ® Fe (CN)63-.
К катодным процессам относятся: 1. Восстановление катионов металлов из раствора: Mez+ + ze - ® Me.
Такого рода процессы называются электроосаждением металлов. 2. Образование анионов в результате присоединения одного или нескольких электронов нейтральными молекулами, в частности, молекулами кислорода, всегда присутствующего в растворах, соприкасающихся с воздухом: 2Н2О + 2е - ® Н2 + 2ОН-. 3. Катодное восстановление твердых нерастворимых соединений, например: Fe2O3 + 6H+ + 6e - ® 2Fe + 3H2O. 4. Изменение валентности ионов, присутствующих в растворе, в сторону уменьшения их положительного заряда или увеличения отрицательного заряда: Sn4+ + 2e - ® Sn2+, или Fe (CN)63- + e - ® Fe (CN)64-.
Явление электролиза на примере разложения воды под действием электрического тока впервые было обнаружено еще в конце XVIII столетия. Существование строгой пропорциональной зависимости между количеством прошедшего электричества и количеством выделенного на электродах вещества было установлено значительно позже М. Фарадеем. Открытые им в 1833 г. законы электролиза приводятся к одному фундаментальному положению, вытекающему из самой природы электрохимических реакций. 1.Масса вещества, образовавшегося в результате электрохимической реакции, прямопропорциональна количеству пропущенного электричества.
где k – электрохимический коэффициент, Q – количество электричества. Количество электричества определяется по формуле:
где I – сила тока, τ - время (в секундах). Физический смысл: электрохимический коэффициент равен массе выделившегося вещества при прохождении через раствор единицы количества электричества (1 Кл). [Кл] = [А × с] Этот закон вытекает из сущности процесса электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс - взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, образующегося на электроде, всегда будет пропорционально числу прошедших по цепи электронов, т. е. количеству прошедшего электричества.
|
||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 178; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.217.13 (0.009 с.) |

 Red - z е – Ox.
Red - z е – Ox.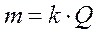 , (6)
, (6) , (7)
, (7)


