
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Если через два раствора пропускать одинаковое количество электричества, то массы веществ, образовавшихся при электролизе раствора, пропорциональны их эквивалентным массам.Содержание книги
Поиск на нашем сайте
При прохождении через раствор 96500 Кл электричества на электродах выделится 1 г-экв вещества, тогда: 3. Объединенный закон описывается уравнением:
где Мэкв - эквивалентная масса вещества. В процессе электролиза важно понятие «выход по току». Величина выхода по току является количественной характеристикой эффективности процесса электролиза. Законы Фарадея работают в любых условиях и во всех случаях. Однако возможен случай, когда масса выделившегося вещества не будет равна теоретически рассчитанной. Отклонение определяется выходом по току:
Электролиз раствора серной кислоты можно описать следующей схемой: Н2SO4 = 2H+ + SO42- Катод: H+ 2Н2О - 4е = О2 + 4Н+, Анод: SO42- , ОН- 2Н2О + 2е = Н2 + 2ОН-. Уравнение электролиза: Н2SO4 + 2Н2О = 2Н2 + О2 + Н2SO4 или 2Н2О = 2Н2 + О2. Таким образом, при электролизе раствора серной кислоты идет электролиз воды, образуются водород и кислород, в прикатодном пространстве происходит накопление ионов гидроксила, а в прианодном - ионов водорода.
1.3. Теория электролитической диссоциации В 1887г. Аррениус выдвинул теорию электролитической диссоциации. Основные положения теории: 1. Некоторые вещества при растворении в полярном растворителе способны распадаться на «+» и «–» заряженные частицы - ионы. Ионы и атомы не тождественны друг другу, так как обладают различными свойствами. 2. В растворе между ионами и молекулами существует равновесие. 3. Силы взаимодействия между ионами отсутствуют и растворы электролитов ведут себя подобно идеальным газовым системам. 4. Разложение электролитов на ионы определяется степенью диссоциации: если a = 0, то вещества называются изоляторами (неэлектролитами); если a =>1, то вещества проявляют свойства сильных электролитов; если 0 < a << 1, то вещества являются слабыми электролитами. Теория Аррениуса дала возможность объяснить: 1) несоответствие теоретических и практических данных; 2) механизм реакции гидролиза растворов солей; 3) кислотность и щелочность среды (рН); 4) на ее основе было создано ряд теорий: электропроводности, диффузии ионов, возникновение электродного потенциала и ЭДС гальванического элемента. Но ввиду того, что Аррениус рассматривал электролит как механическую смесь молекул и ионов растворенного вещества и молекул растворителя, между которыми нет никакого взаимодействия, он не смог объяснить механизм диссоциации растворенного вещества на ионы и причины диссоциации. Согласно Аррениусу, степень диссоциации должна стремиться к единице (a =>1) для сильных электролитов, тогда как, для растворов сильных электролитов экспериментально были найдены значения a, превышающие единицу, так для: 1н раствора HCl → a = 1,4; для 6н HCl → a =3,4; для 16н HCl → a =3,4. Кроме того, для сильных электролитов не было найдено количественной характеристики, которая являлась бы постоянной величиной. Из всего этого следует вывод: теория электролитической диссоциации Аррениуса применима только для сильно разбавленных растворов слабых электролитов. В дальнейшем теория электролитической диссоциации Аррениуса только развивалась и дополнялась: В. Оствальдом (закон разведения), П. Дебаем и Э. Гюккелем (теория сильных электролитов), Л. В. Писаржевским, Н. Бьеррумом, В. А. Кистяковским, И. А. Каблуковым и другими учеными. Механизм диссоциации в растворах электролитов зависит от строения диссоциирующих молекул. Многие вещества, как, например, неорганические соли, в твердом состоянии имеют ионное строение, и кристалл в целом можно рассматривать как одну молекулу. Согласно закону Кулона, сила электростатического взаимодействия F ионов обратно пропорциональна диэлектрической проницаемости среды и квадрату расстояния между ионами:
где q1, q2 – заряды ионов; D – диэлектрическая проницаемость; D (H2O) = 81 (20ºC); r – расстояние между ионами. Чем меньше D, тем больше F, тем прочнее молекула, тем меньше a, тем слабее электролит. И, наоборот, чем больше D, тем меньше F, тем слабее молекула, тем больше a и тем сильнее электролит. Здесь действует правило Нернста- Каблукова- Томсона: Величина диссоциирующей силы растворителя прямопропорциональна диэлектрической проницаемости растворителя:
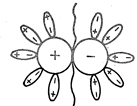
Поэтому в растворителях с большой диэлектрической постоянной (вода, жидкий фтористый водород, формамид и др.) электролиты легко распадаются на ионы. Механизм электролитической диссоциации упрощенно можно представить следующим образом. Каждый из ионов, находящихся на поверхности кристалла электролита, создает вокруг себя электростатическое поле. Полярные молекулы растворителя, попадая в сферу действия этого поля, ориентируются, образуя вокруг каждого иона сольватную оболочку (см. схему диссоциации молекулы электролита на ионы в полярном растворителе (рис.1.)). В результате межионная связь в кристалле ослабляется (в D раз по сравнению с взаимодействием зарядов в пустоте); тепловые движения молекул растворителя способствует отрыву сольватированных ионов друг от друга, т.е. происходит растворение с диссоциацией. Аналогичная картина наблюдается и при диссоциации молекул с полярными связями, например, при диссоциации кислот и оснований.
На диссоциацию влияет не только величина диэлектрической постоянной среды. Большое значение имеет химическое взаимодействие между молекулами растворенного вещества и растворителя (сольватация), сопровождающаяся выделением или поглощением теплоты сольватации. Поэтому одинаково диссоциированные в воде соли по-разному ведут себя в различных растворителях, даже если их диэлектрическая проницаемость будет одинаковой. Закон разведения Оствальда Как уже указывалось, теория электролитической диссоциации, не смотря на ее явные недостатки, со временем добавлялась, расширялась и надстраивалась многими учеными. Вначале был предложен механизм процесса диссоциации. Электролит стали рассматривать как фазу переменного состава. А это означает, что раствор обладает одинаковыми интенсивными свойствами во всех частях и состав его можно менять непрерывно. Однородность раствора является следствием равномерного статистического распределения ионов в среде растворителя. Образование ионов из нейтральных молекул электролита протекает с участием молекул растворителя. Более того, само появление ионов зависит от природы растворителя. Ниже приведенные примеры ярко свидетельствуют о том, что сила электролита зависит не только от растворенного вещества, но и от растворителя (см. табл.2):
Зависимость силы электролита от природы растворителя и растворенного вещества Таблица 2
Об ионизирующей способности растворителя можно судить по электрической проводимости раствора. Замечено, что, наряду с водой, хорошей ионизирующей способностью обладают жидкости с высокой диэлектрической проницаемостью, например, жидкие N - амиды, диметилформамид.
Рассмотрим вывод закона Оствальда на примере диссоциации слабого электролита (уксусной кислоты): CH3COOH = CH3COO- + H+. Определяем константу диссоциации по формуле:
Допустим, что в V мл раствора содержится а моль вещества уксусной кислоты (CH3COOH), тогда исходная концентрация уксусной кислоты равна:
Обозначим через X - число молей CH3COOH, распавшихся на ионы, тогда концентрация ионов будет равна:
А концентрация непродиссоциировавших молекул определится как:
отсюда константа равновесия равна:
Обозначим «Х» через степень диссоциации:
Учитывая, что
Для слабых электролитов a << 0, тогда знаменатель приблизительно равен 1 и упрощенная форма закона разведения Оствальда будет иметь вид: КД = a2 ∙C. (14) Находим отсюда степень диссоциации:
Степень диссоциации изменяется обратнопропорционально корню квадратному из концентрации. Так, при уменьшении концентрации в 100 раз, степень диссоциации возрастет в 10 раз.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.41.179 (0.009 с.) |

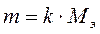 ,
, 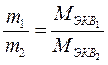 . (8)
. (8)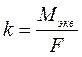 .
.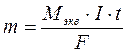 , (9)
, (9)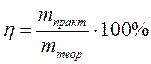 ;
; 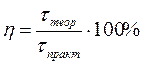 ;
; 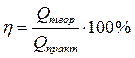 . (10)
. (10) , (11)
, (11) . (12)
. (12) Диссоциация слабых электролитов – это обратимый процесс. При любой температуре в растворе слабого электролита находятся катионы, анионы и молекулы.
Диссоциация слабых электролитов – это обратимый процесс. При любой температуре в растворе слабого электролита находятся катионы, анионы и молекулы.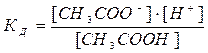 .
.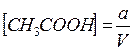 .
.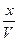 = [H+] = [CH3COO- ],
= [H+] = [CH3COO- ],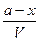 = [ CH3COOH];
= [ CH3COOH];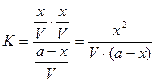 .
.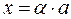 , тогда:
, тогда: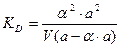 ,
, 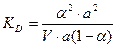 ,
, 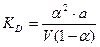 .
.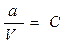 , получаем уравнение, которое называется законом разведения Оствальда:
, получаем уравнение, которое называется законом разведения Оствальда: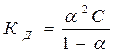 . (13)
. (13)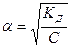 . (15)
. (15)


