
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И называется предельным законом Дебая - Гюккеля.Содержание книги
Поиск на нашем сайте Если учесть размеры центрального иона, то получается более точное выражение – второе приближение Дебая –Гюккеля:
где a - средний эффективный диаметр ионов или расстояние наибольшего сближения ионов; b - теоретический коэффициент, он равен b=0,33∙108. Это уравнение позволяет объяснить уменьшение коэффициента активности с ростом концентрации до определенных пределов. Уравнение (32) применимо для растворов с концентрацией 0,01 < С < 0,1 моль/л. И, наконец, третье приближение закона Дебая - Гюккеля учитывает поляризацию дипольных молекул растворителя вокруг центрального иона и образование сольватных оболочек. Уравнение третьего приближения Дебая -Гюккеля имеет вид:
Слагаемое C∙I вводится для учета диэлектрической проницаемости растворителя вблизи иона в результате поляризации дипольных молекул растворителя вокруг иона растворенного вещества и для учета гидратных оболочек ионов. Уравнение III приближения Дебая -Гюккеля (33) применимо для растворов с концентрацией 0,1 < С < 1 моль/л. Харнед и Оуэн дополнили формулу Дебая - Гюккеля еще одним слагаемым:
Данная формула применима для растворов с концентрацией: 1 моль/л < C < 4 моль/л. До Дебая - Гюккеля Ф. Кольрауш вывел уравнение для сильных электролитов, (для концентрации C < 0,01 моль/л), которое получило название закон квадратного корня: lV = l¥ - AÖC. (35) Для более концентрированных электролитов было предложено уравнение, получившее название закона кубического корня: lV = l¥ - A3ÖC. (36) Для растворов слабых электролитов было предложено уравнение:
Существование вокруг центрального иона ионной атмосферы при движении иона под действием внешней разности потенциалов приводит к возникновению двух тормозящих эффектов: электрофоретического и релаксационного.
а) Релаксационное торможение б) Электрофоретическое торможение
Рис.2 Эффекты торможения ионов
Электрофоретический эффект, имеющий гидродинамическую природу, обусловлен торможением под действием потока движущихся навстречу противоионов, эквивалентного увеличению вязкости раствора. Он вызывается тем, что все ионы гидратированы молекулами Н2О и движутся в противоположных направлениях, при этом возникает трение. При беспорядочном движении иона ионная атмосфера не является с ним единым целым. Электрофоретический эффект называется эффектом Дебая - Фалькенгагена. Релаксационное торможение связано с наличием ионной атмосферы.При движении иона происходит разрушение старой ионной атмосферы и создается новая, это нарушает симметричность ионной атмосферы, ее плотность позади движущегося иона становится больше, что, в свою очередь, приводит к новому торможению. Такое торможение называется релаксационным. Релаксационный эффект связан с конечным временем релаксации (разрушения старой и образования новой) атмосферы, ее несимметричностью, образованием позади движущегося иона избыточного заряда противоположного знака. Доказано, что при определенных значениях частоты взаимное смещение иона и ионной атмосферы столь мало, что релаксационное торможение вообще отсутствует. В 1928г. Дебай и Фалькенгаген рассмотрели влияние частоты переменного тока на электропроводность растворов и установили: с ростом частоты тока наблюдается увеличение электропроводности. Электропроводность раствора электролита увеличивается с ростом напряженности поля, а при 104 - 105 ионная атмосфера вообще не успевает образовываться, поэтому релаксационное и электрофоретическое торможение вообще отсутствует. Время релаксации – это время, в течение которого ионная атмосфера исчезает после удаления центрального иона. Время релаксации t, за которое исходная избыточная концентрация ионов в ионной атмосфере уменьшается в n раз, можно приближенно оценить по формуле Дебая - Фалькенгагена. Для симметричных (Z+ = Z- = Zi)электролитов при 298 К она имеет следующий вид:
где τ - время релаксации, с; С - концентрация, моль/л; λυ - эквивалентная электропроводность электролита, См×м2× кг-экв-1. Время релаксации зависит от концентрации. Так, для 1,0 н раствора NaCl время релаксации равно 10-10 с, для 0,1н NaCl t= 10-9 с, а для 0,001н NaCl t=10-7 с. Время релаксации связано с частотой тока:
Частота определяется по формуле:
Эффект Дебая - Фалькенгагена наблюдается при частоте n = 109 герц. Увеличение частоты (v) переменного тока приводит к увеличению электропроводности раствора за счет исчезновения релаксационного торможения иона, при этом наблюдается так называемый эффект Дебая - Фалькенгагена, предсказанный теоретически и рассчитанный авторами и позднее экспериментально подтвержденный М. Вином (1927г.). Например, при температуре298 К для 0,01 М раствора НС1 указанный эффект проявляется при частоте 5,8 ·108 с-1. Согласно уравнению (38), увеличение концентрации электролита и заряда ионов сопровождается уменьшением времени релаксации, поэтому требуется большая частота тока (или меньшая длина волны) для проявления указанного выше эффекта, т. е. роста электропроводности. Эффект Дебая - Фалькенгагена учитывает только релаксационный эффект, а эффект Вина - оба эффекта. Впоследствии Онзагер для зависимости электропроводности от концентрации в разбавленных (С < 10-3 моль/л) растворах 1,1- валентных электролитов с учетом электрофоретического и релаксационного эффектов вывел уравнение, связывающее электропроводность с концентрацией и позволяющее вычислить оба эффекта:
Уравнение Онзагера теоретически согласуется с уравнением Кольрауша: λυ = l∞ - АÖC; где и с уравнением Дебая - Гюккеля: где
Теория Онзагера позволила объяснить не только эффект Дебая — Фалькенгагена, когда в поле переменного тока высокой частоты наблюдается увеличение эквивалентной электропроводности сильных электролитов, но и эффект Вина - отсутствие в этих условиях асимметрии ионной атмосферы и, как следствие, сведение к нулю релаксационного эффекта торможения иона. Удельная электропроводность Основной характеристикой проводников электрического тока является их электрическое сопротивление (R) или обратная величина Электролиты – это вещества, которые при растворении в растворителе полностью или частично диссоциируют на ионы. В растворах электролитов перенос электричества осуществляется за счет перемещения ионов. Удельной электропроводностью называется электропроводность 1 м3 раствора, заключенного между электродами площадью 1 м2 и находящимися на расстоянии 1 м друг от друга. Удельная электропроводность c (каппа) равна величине, обратной удельному сопротивлению ρ, т.е. сопротивлению 1 м3 раствора электролита:
Удельную электропроводность исследуемого раствора вычисляют по уравнению:
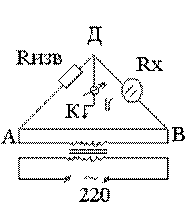
частоты. Мост сопротивлений АДВ состоит из известного сопротивления (Rизв), электролитического сосуда с исследуемым раствором (Rх) и реохордной проволоки АВ строго постоянного сечения, по которой движется подвижный контакт К. Передвигая контакт по реохордной проволоке, находят такое положение, когда гальванометр покажет (I=0). Это будет иметь место при условии:
Отсюда следует, что Таким образом определяют сопротивление раствора с неизвестной концентрацией. Аналогично определяется постоянная сосуда - Поскольку в растворах электролитов электричество переносится ионами, то удельная электропроводность зависит от концентрации и заряда ионов, скоростей их движения в электрическом поле и температуры. Зависимость удельной электропроводности сильных и слабых электролитов от концентрации представлена на рис. 4. Удельная электропроводность сильных электролитов при увеличении концентрации сначала возрастает, при определенных значениях χ проходит через максимум, а в области концентрированных растворов уменьшается. Увеличение удельной электропроводности связано с ростом концентрации, а падение - с усилением ион-ионного взаимодействия, приводящего к уменьшению скорости движения ионов.
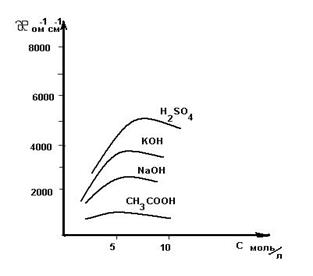
Удельная электропроводность слабых электролитов с повышением концентрации растет незначительно. Несмотря на общее повышение концентрации электролита, концентрация ионов в растворе повышается мало, вследствие уменьшения степени диссоциации. Поэтому с повышением концентрации слабого электролита удельная электропроводность раствора медленно возрастает, достигает максимума, а затем уменьшается. Измерения удельной электропроводности следует проводить при постоянной температуре.
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 411; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.007 с.) |

 , (32)
, (32) . (33)
. (33) . (34)
. (34) . (37)
. (37)


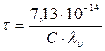 , (38)
, (38) . (39)
. (39) . (40)
. (40)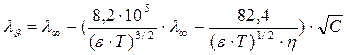 (41)
(41) – эффект релаксации, (42)
– эффект релаксации, (42) – электрофоретический эффект. (43)
– электрофоретический эффект. (43) , (44)
, (44) lυ= l∞ - [B∙l∞-A] ∙ ÖC, (45)
lυ= l∞ - [B∙l∞-A] ∙ ÖC, (45) , (46)
, (46) . (47)
. (47)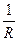 , называемая электрической проводимостью.
, называемая электрической проводимостью.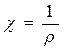 [ом-1 см-1 ] (48)
[ом-1 см-1 ] (48)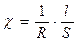 (49)
(49)
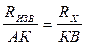 .
.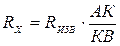 . (50)
. (50)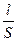 . В ячейку заливают раствор хлорида калия (KCl), удельная электропроводность которого известна. Обычно используется 1н; 0,1н; 0,01н; 0,02н растворы хлорида калия.
. В ячейку заливают раствор хлорида калия (KCl), удельная электропроводность которого известна. Обычно используется 1н; 0,1н; 0,01н; 0,02н растворы хлорида калия.


