
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электропроводность растворовСтр 1 из 7Следующая ⇒
ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ
Учебное пособие
Волгоград, 2009
УДК 541. 1
Р е ц е н з е н т ы: Волжский филиал Московского энергетического института, зав. кафедрой "Технология воды и топлива ", к.х.н., с.н.с. Гончарова Л. К. Волжский институт строительства и технологии, кафедра " Технология, обработка и производства материалов", к.х.н., доц. Наумова Л. Н. Печатается по решению редакционно-издательского совета Волгоградского государственного технического университета
ISBN-978-5-9948-0075-2 Электропроводность растворов сильных и слабых электролитов: Учебное пособие по физической химии. / Г. И. Зорина; ВПИ (филиал) ВолгГТУ. - Волгоград, 2009. - 76 с.
В учебном пособии изложены основные разделы электрохимии применительно к водным растворам электролитов. Рассмотрены свойства растворов электролитов, их электропроводность, теория сильных электролитов. Уделено внимание основным законам электрохимии, законам Фарадея и явлениям переноса электричества. В работе представлены тесты по электрохимии сильных и слабых электролитов, приведены контрольные вопросы для оценки качества усвоения материала, дан перечень рекомендуемой литературы. Предназначено для студентов, обучающихся по направлениям: 550800(240100) “Химическая технология и биотехнология”, 551800 (150400) “Технологические машины и оборудование” и специальностям: 250500 (240501) “Химическая технология высокомолекулярных соединений”, 250600 (240502) “Технология переработки пластических масс и эластомеров”, 170500 (240801) «Машины и аппараты химических производств», 210200 (220301) «Автоматизация технологических процессов и производств (по отраслям)».
Табл. 2., рис. 18. Библиогр. 9 назв. ISBN-978-5-9948-0075-2
Ó Волгоградский государственный технический университет, 2009 Ó Волжский политехнический институт,
Теоретическая часть Основные понятия электрохимии Электрохимия – это раздел физической химии, изучающий закономерности превращения электрической энергии в химическую (при электролизе) и обратный процесс (при работе гальванических элементов). Так как эти процессы совершаются за счет изменения состояния ионов и связаны с нарушением ионных равновесий, то электрохимия изучает также вопросы электропроводности электролитов, ионных равновесий и кинетики электродных процессов. Взаимный переход химической и электрической энергии происходит в электрохимических системах, состоящих из электродов и электролитов. История электрохимии насчитывает более 300 лет. Возникновение электрохимии относится к рубежу XVIII-XIX вв.
В области электрохимии работали лучшие умы человечества. М.В. Ломоносов ( 1752 г.) указал на то, что «Без химии путь к познанию электричества закрыт», Л. Гальвани (1791 г. ) исследовал электрические явления при мышечном сокращении, обнаружил возникновение разности потенциалов при контакте металла с электролитом. А. Вольт (1800 г.)создал первую гальваническую батарею - вольтов столб. М. Фарадей (1833 - 34 г.) сформулировал количественные законы электролиза, а также ввел термины: электролит, электролиз, электроды, катод, анод, ионы. Ф. Кольрауш (1879г.) вывел закон независимого движения ионов, получил зависимость удельной электропроводности от концентрации c= f(c) для сильных электролитов, предложил схему измерения удельной электропроводности (c) (1885г), вывел ионное произведение воды (1894). С. Аррениус (1884 - 1889г.) сформулировал основные положения теории электролитической диссоциации. Я. Гейровский (1922г.) создал полярографический метод,а в соавторстве с М. Шикатой (1925г.) сконструировал полярограф. П.Д. Дебай и Э. Гюккель (1923-1926г.)сформулировали теорию сильных электролитов. Электрохимия находит широкое применение на практике: 1. Химические источники электрической энергии в быту, на транспорте, в промышленности (аккумуляторы, батарейки). 2. Получение различных веществ методом электролиза, рафинирование металлов, гальванопластика, гальваностегия. 3. Использование электрохимических методов в аналитической химии и ФХМА (потенциометрия, кондуктометрия, полярография, амперометрия, кулонометрия, электроанализ и т. д.) 4. Новая отрасль техники - хемотроника - занимается созданием электрохимических преобразователей информации. 5. Изучение процессов коррозии и разработка эффективных методов защиты от нее. Электролитами называются вещества, которые в растворе или расплаве распадаются на ионы - электрически заряженные частицы. Количество ионов каждого знака определяется формулой вещества:
Молекулы в целом являются электронейтральными частицами: сумма положительных зарядов должна быть равна сумме отрицательных зарядов. Электролиты, молекулы которых распадаются на 2 иона, называются бинарными или симметричными, например: КСl, НВr - 1,1 валентный электролит; CuSO4, FeS - 2,2 валентный электролит. В качестве примеров несимметричных электролитов можно привести следующие: K2SO4 - 1,2 валентный электролит; MgCl2 - 2,1- валентный электролит. Все вещества делятся на две группы. Растворы одних веществ не проводят электрический ток, они называются изоляторами. Растворы других веществ проводят электрический ток, они называются проводниками. Проводники в свою очередь делятся на проводники первого (металлы, уголь, графит) и второго рода (растворы электролитов). В проводниках первого рода имеет место электронная проводимость, осуществляемая без переноса вещества, а в проводниках второго рода имеет место ионная проводимость, осуществляемая с переносом вещества. С ростом температуры электропроводность проводников первого рода уменьшается за счет роста сопротивления, а в проводниках второго рода с ростом температуры электропроводность увеличивается за счет уменьшения вязкости раствора, что способствует увеличению абсолютной скорости движения ионов. Однако, при определенной температуре начинает сказываться увеличение хаотического движения ионов и электропроводность начинает уменьшаться. В целом электропроводность проводников первого рода значительно превышает электропроводность проводников второго рода: W2 << W1.
Как уже указывалось, в электрохимических процессах осуществляется перенос вещества. Основными видами переноса являются: Диффузия - перенос вещества, обусловленный неравенством химических потенциалов внутри системы или между системой и окружающей средой. Конвекция - перенос вещества под действием внешних механических сил. Миграция - перенос заряженных частиц в электрическом поле, обеспечивающий электрическую проводимость раствора. Электролиты подразделяются на сильные (HCl, NaCl, H2SO4 и т.д.) и слабые (NH4OH, CH3COOH и т.д.). Иногда группу электролитов, занимающих среднее положение, называют электролитами средней силы. Сильные электролиты полностью распадаются на ионы при растворении, в твердом виде эти вещества имеют либо ионную, либо сильнополярную связь. Слабые электролиты при растворении в воде диссоциируют на ионы частично. Для количественной оценки полноты диссоциации была принята величина a, названная степенью диссоциации, которая определяется отношением числа продиссоциировавших молекул N д к общему числу молекул N:
Для электролитов теоретические данные по понижению давления пара растворителя над раствором, по осмотическому давлению (П), понижению температуры замерзания (ΔТзам) и повышению температуры кипения растворов (ΔТкип) всегда получались меньше практических величин. Изучая разбавленные растворы, Вант-Гофф отметил постоянное несоответствие теоретических и практических данных. Для устранения этого несоответствия Вант-Гофф предложил ввести поправку - i – изотонический коэффициент, который учитывает увеличение числа частиц в процессе диссоциации и определяется по формуле:
где Nc - число частиц (ионы + молекулы). В табл.1 представлены основные законы разбавленных растворов для неэлектролитов и электролитов. Законы разбавленных растворов электролитов и неэлектролитов Таблица 1
Изотонический коэффициент связан со степенью диссоциации вещества. Для вывода этой зависимости введем следующие обозначения:
a ∙N - число распавшихся молекул; k – число ионов, на которые распадается электролит; a∙ N∙k - число ионов, образовавшихся при диссоциации; (1- a) - доля непродиссоциировавших молекул; N(1 - a) - число непродиссоциировавших молекул. Тогда число частиц можно рассчитать по формуле NС = a∙ N∙k + N∙(1 - a). (3) Подставляем уравнение (3) в уравнение (2):
Выносим N за скобки: Раскрываем скобки, сокращаем N и получаем: i = a ∙k + (1 - a), i = 1 + a(k -1). (4) Из полученного уравнения находим степень диссоциации:
В зависимости от числа ионов, на которые распадаются молекулы, изотонический коэффициент стремится к целым числам: i => 2 для KCl, CuSO4 (k = 2); i => 3 для CuCl2, H2S, Na2SO4 (k = 3); i => 4 для AlCl3 Fe (NO3)3 (k = 4). Закон разведения Оствальда Как уже указывалось, теория электролитической диссоциации, не смотря на ее явные недостатки, со временем добавлялась, расширялась и надстраивалась многими учеными. Вначале был предложен механизм процесса диссоциации. Электролит стали рассматривать как фазу переменного состава. А это означает, что раствор обладает одинаковыми интенсивными свойствами во всех частях и состав его можно менять непрерывно. Однородность раствора является следствием равномерного статистического распределения ионов в среде растворителя. Образование ионов из нейтральных молекул электролита протекает с участием молекул растворителя. Более того, само появление ионов зависит от природы растворителя. Ниже приведенные примеры ярко свидетельствуют о том, что сила электролита зависит не только от растворенного вещества, но и от растворителя (см. табл.2):
Зависимость силы электролита от природы растворителя и растворенного вещества Таблица 2
Об ионизирующей способности растворителя можно судить по электрической проводимости раствора. Замечено, что, наряду с водой, хорошей ионизирующей способностью обладают жидкости с высокой диэлектрической проницаемостью, например, жидкие N - амиды, диметилформамид.
Рассмотрим вывод закона Оствальда на примере диссоциации слабого электролита (уксусной кислоты): CH3COOH = CH3COO- + H+. Определяем константу диссоциации по формуле:
Допустим, что в V мл раствора содержится а моль вещества уксусной кислоты (CH3COOH), тогда исходная концентрация уксусной кислоты равна:
Обозначим через X - число молей CH3COOH, распавшихся на ионы, тогда концентрация ионов будет равна:
А концентрация непродиссоциировавших молекул определится как:
отсюда константа равновесия равна:
Обозначим «Х» через степень диссоциации:
Учитывая, что
Для слабых электролитов a << 0, тогда знаменатель приблизительно равен 1 и упрощенная форма закона разведения Оствальда будет иметь вид: КД = a2 ∙C. (14) Находим отсюда степень диссоциации:
Степень диссоциации изменяется обратнопропорционально корню квадратному из концентрации. Так, при уменьшении концентрации в 100 раз, степень диссоциации возрастет в 10 раз.
Теория кислот и оснований Теория электролитической диссоциации позволила впервые дать строгое определение понятий кислота и основание. К сильным электролитам относятся кислоты, основания и соли, поэтому актуальным становится вопрос об их определении. Понятия «кислота» и «основание» имеют свою длинную историю и до настоящего времени нет вполне исчерпывающего определения им. Первым дал определение кислоты и основания С. Аррениус. В результате теории Аррениуса одним из ее первых достижений стало определение кислоты и основания. Возьмем ряд кислот и напишем для них уравнения диссоциации: HCl = H+ + Cl-, H2SO4 = 2H+ + SO42-, H3PO4 = H+ + Н2PO4-. Кислотой называется электролит, который в водном растворе образует только катион водорода (H+) и не дает никаких других положительно заряженных ионов: NaOH = Na+ + OH-, Ba(OH)2 = Ba2+ + 2(OH)-, Al(OH)3 = Al3+ + 3(OH)-. Основанием называется электролит, который в водном растворе образует только анионы гидроксила (ОН-) и не дает никаких других отрицательно заряженных ионов. Недостатком теории стало то, что данные понятия применимы только к водным растворам, в других растворителях они становятся непригодными. Так, например, аммиак растворяется в воде и в соляной кислоте. При растворении аммиака в воде образуется слабое основание: NH3 + H2O ® NH4OH → NH4+ + OH-. А при растворении аммиака в соляной кислоте, образуется соль – сильный электролит: NH3 + НCl ® NH4Cl ® NH4+ + Cl-. И даже всем известная азотная кислота (HNO3) в воде ведет себя, как кислота, а в растворе смеси плавиковой (HF) и серной кислот (H2SO4) она ведет себя как основание: HNO3 + HF ® [NO3H2+ ∙F-], HNO3 + H2SO4 ® [NO3H2+ ∙ H2SO4-]. Однако, кислотно-основные свойства могут проявляться веществами в условиях, когда существование ионов не предполагается. Например, кислоты взаимодействуют с металлами в органических средах, в которых диссоциация кислоты не имеет места. Также ряд других свойств неводных, а отчасти и водных растворов, не могут быть объяснены с позиции теории электролитической диссоциации. В настоящее время установлено, что в растворе невозможно существование свободного несольватированного иона водорода. Так, в воде всегда имеет место равновесие: 2Н2О ® Н3О+ + ОН-, с образованием иона гидроксония Н3О+. В общем виде в результате сольватации протона образуются ионы лиония (этоксония С2Н5ОН2+, аммония NН4+, ацетония СН3СООН2+). Существование лиония, определяющего кислотные свойства раствора, также не находит объяснения в теории Аррениуса. Со временем подобных фактов накопилось много, поэтому возникла необходимость создания новой теории. Протонная теория кислот и оснований была выдвинута в 1923 Дж. Бренстедом, Т. Лоури и Н. Бьерумом. Они предложили рассматривать кислоты и основания с позиции участия их в процессе передачи протона, аналогичного передаче электрона в окислительно-восстановительных реакциях. Кислотами называются вещества, способные отдавать протон. Основаниями называются вещества, способные принимать протон. Сущность кислотно - основного взаимодействия по Бренстеду заключается в следующем: кислотно-основное взаимодействие рассматриваются подобно окислительно-восстановительным реакциям, протекающим по схеме: ox1 + red1 =® ox2 + red2, ox1 + e ® red2, red1 - e ® ox2. Для пары «кислота – основание» эти уравнения будут иметь вид: кисл1 + осн1 ® кисл2 + осн2, кисл1 - H+ ® осн, осн1 + Н+® кисл2 . Например: HCl + H2O ® Cl- + H3O+ кисл1 осн1 осн2 кисл2 H2SO4 + H2O ® HSO4- + H3O+ кисл1 осн1 осн2 кисл2 CO2 + H2O ® HCO3- + H+ кисл1 + осн1 ® осн2 + кисл2 Многие вещества согласно этой теории могут играть роль и кислот и оснований, то есть проявлять амфотерные свойства, например: NH3 + H2O ® NH4+ + OH- кисл1 + осн1 ® осн2 + кисл2 HCl + NH3 ® NH4+ + Cl- кисл1 + осн1 ® кисл2 + осн2 В зависимости от того, какая тенденция (к присоединению или отдаче) водорода превалирует у данного растворителя, он может влиять на ионизацию кислоты. Однако, теория Дж. Бренстеда в том виде, в котором она была предложена, не учитывала влияние растворителей на кислотно-основное равновесие. На самом деле сила кислоты и основания во многом зависит от природы растворителя. Согласно электронной теории Льюиса и М. И. Усановича, кислотой называется акцептор электронов, а основанием - донор электронов. Т. е. Льюис в основу понятий «кислота» и «основание» положил электронный механизм, вплотную приблизив реакции кислотно - основного взаимодействия к реакциям окисления – восстановления. Согласно взглядам М. И. Усановича: кислота – это вещество, способное присоединять к себе катион, в том числе электрон: 2Na + Cl2 ® 2NaCl → 2Na+ + 2Cl- Cl + le ® Cl- В этом случае молекула Cl2 является кислотой. Основание - это вещество, которое способно присоединять к себе анион, в том числе электрон: Na – le ® Na+. Na является основанием. Н. А. Измайлов предложил рассматривать вещество как кислоту или как основание только в зависимости от функций, которые оно выполняет в кислотно-основном процессе в данной среде. Кислотой называется вещество, содержащее водород и участвующее в кислотно-основном взаимодействии в качестве донора протона. Основанием называется вещество, участвующее в кислотно-основном взаимодействии в качестве акцептора протонов. Собрав все сведения по понятиям «кислота» и «основание», Н. А. Измайлов выдвинул сольватную теорию диссоциации кислот и оснований, согласно которой кислоты и основания взаимодействуют с растворителем, образуя сольватные оболочки. Удельная электропроводность Основной характеристикой проводников электрического тока является их электрическое сопротивление (R) или обратная величина Электролиты – это вещества, которые при растворении в растворителе полностью или частично диссоциируют на ионы. В растворах электролитов перенос электричества осуществляется за счет перемещения ионов. Удельной электропроводностью называется электропроводность 1 м3 раствора, заключенного между электродами площадью 1 м2 и находящимися на расстоянии 1 м друг от друга. Удельная электропроводность c (каппа) равна величине, обратной удельному сопротивлению ρ, т.е. сопротивлению 1 м3 раствора электролита:
Удельную электропроводность исследуемого раствора вычисляют по уравнению:
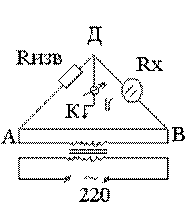
частоты. Мост сопротивлений АДВ состоит из известного сопротивления (Rизв), электролитического сосуда с исследуемым раствором (Rх) и реохордной проволоки АВ строго постоянного сечения, по которой движется подвижный контакт К. Передвигая контакт по реохордной проволоке, находят такое положение, когда гальванометр покажет (I=0). Это будет иметь место при условии:
Отсюда следует, что Таким образом определяют сопротивление раствора с неизвестной концентрацией. Аналогично определяется постоянная сосуда - Поскольку в растворах электролитов электричество переносится ионами, то удельная электропроводность зависит от концентрации и заряда ионов, скоростей их движения в электрическом поле и температуры. Зависимость удельной электропроводности сильных и слабых электролитов от концентрации представлена на рис. 4. Удельная электропроводность сильных электролитов при увеличении концентрации сначала возрастает, при определенных значениях χ проходит через максимум, а в области концентрированных растворов уменьшается. Увеличение удельной электропроводности связано с ростом концентрации, а падение - с усилением ион-ионного взаимодействия, приводящего к уменьшению скорости движения ионов.
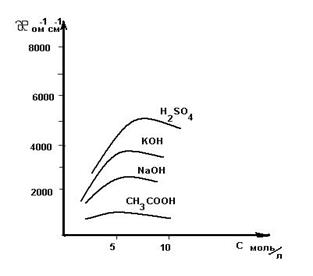
Удельная электропроводность слабых электролитов с повышением концентрации растет незначительно. Несмотря на общее повышение концентрации электролита, концентрация ионов в растворе повышается мало, вследствие уменьшения степени диссоциации. Поэтому с повышением концентрации слабого электролита удельная электропроводность раствора медленно возрастает, достигает максимума, а затем уменьшается. Измерения удельной электропроводности следует проводить при постоянной температуре. Прямая кондуктометрия
(рис.12). Несмотря на высокую точность и простоту, кондуктометрический метод анализа не нашел большого распространения в аналитической практике. Это связано с тем, что кондуктометрический метод анализа не является специфичным, т.е. c = åcί, его электропроводность определяется суммой электропроводностей всех ионов, находящихся в растворе. Поэтому даже наличие малейших примесей искажает результаты. И тем не менее, методом прямого кондуктометрического метода анализа можно измерять c, а затем вычислять: 1) константу диссоциации (Кдисс) слабого электролита; 2) произведение растворимости (ПР) малорастворимых соединений; 3) константу нестойкости (Кнест) комплексных соединений; 4) электрохимические показатели растворов (c, l, a); 5) рН растворов кислот и оснований. Несомненным достоинством метода является возможность его использования для целей автоматизации контроля в различных непрерывных химических производствах. Основанием Титрование смеси сильной и слабой кислот сильным основанием представлено на рис.16. В качестве сильной кислоты выступает соляная кислота, а слабой является уксусная. Титрование проводится сильным электролитом - раствором щелочи. Реакция протекает по уравнению: CH3COOH + HCl + NaOH => NaCl + H2O + CH3COONa
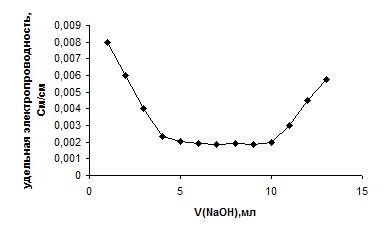
В этом случае на кривой титрования наблюдается 2 точки эквивалентности: первая точка будет соответствовать титрованию сильной кислоты (соляной), вторая – слабой (уксусной). Объем, пошедший на титрование слабой кислоты, определяется по формуле: V (CH3COOH) = V2 - V(HCl). (73) 1.12.2.5. Титрование соли солью, сопровождающееся образованием осадка Титрование соли солью, сопровождающееся образованием осадка продемонстрируем на примере реакции серной кислоты раствором хлорида бария, при этом в осадок выпадет сульфат бария. Реакция протекает по уравнению:
Подвижности ионов водорода и бария составляют: l (Н+) = 35,0 Ом-1×м2/кг-экв и l(Ba2+) = 4,2 Ом-1×м2/кг-экв.
На рис.17. представлен график титрования раствора серной кислоты раствором хлорида бария. Видно, что точка эквивалентности легко определяется. В этом виде титрования можно воспользоваться реакцией взаимодействия соли с солью. В этом случае, если эквивалентные электропроводности ионов не сильно отличаются друг от друга, то точка эквивалентности будет размыта Титрование находит широкое применение при анализе кислот, оснований их смесей, солей по методу осаждения, комплексообразования. На рис.18 представлен фрагмент установки для кондуктометрического титрования. При кондуктометрическом титровании тоже использует схему Кольрауша, только вместо ячейки используется стакан, куда наливают титруемое вещество и опускают жестко закрепленные Pt электроды, чтобы в течение опыта не изменялось сопротивление электродов, а, следовательно, не изменялась величина постоянной сосуда l/S.
При титровании раствор должен перемешиваться, поэтому используют магнитную мешалку. Кондуктометрическое титрование используют тогда, когда невозможно воспользоваться индикатором. Характеристика кондуктометрического метода: 1. точен; 2. объективен; 3. можно титровать мутные растворы; 4. можно определять одновременно несколько веществ; 5. можно титровать в автоматическом режиме.
Тесты
1. Кто является автором теории электролитической диссоциации? а) М.Фарадей; б) С. Аррениус; в) Ф. Кольрауш; г) Я. Гейровский. 2. Кто из нижеперечисленных ученых стал Нобелевским лауреатом за создание полярографического метода анализа? а) М.Фарадей; б) С. Аррениус; в) Ф. Кольрауш; г) Я. Гейровский. 3. Кто является автором установки для измерения электропроводности? а) М.Фарадей; б) С. Аррениус; в); г) Я. Гейровский. 4. Кем была создана теория сильных электролитов? а) Гюккелем; б) М. Фарадеем; в) Дебаем; г) Ф. Кольраушем. 5. Кто открыл законы электролиза? а. С. Аррениус; б. М. Фарадей; в. П. Дебай; г. Ф. Кольрауш. 6. Кто является автором закона независимого движения ионов? а) М.Фарадей; б) П. Дебай; в) Ф. Кольрауш; г) Э. Гюккель. 7. Какое из представленных уравнений является законом Рауля для электролитов? а) в) 8. В какой группе собраны проводники первого рода? а) HCl, медь, NaOH; б) графит, медь, алюминий; в) уголь, графит, раствор серной кислоты; г) растворы соляной кислоты, нитрата меди, гидроксида калия. 9. В какой группе собраны проводники второго рода? а) HCl, медь, NaOH; б) графит, медь, алюминий; в) уголь, графит, раствор серной кислоты; г) растворы соляной кислоты, нитрата меди, гидроксида калия.
10. Электролит, который в водном растворе образует анионы гидроксила и не образует других отрицательно заряженных ионов, называется: а) кислотой; б) солью; в) основанием; г) оксидом. 11. Электролит, который в водном растворе образует катионы водорода и не образует других положительно заряженных ионов, называется: а. кислотой; б. солью; в. основанием; г. оксидом. 12. Если общая электропроводность вещества равна нулю (W =0), то такие вещества называются: а) изоляторами; в) сильными электролитами; б) электролитами; г) проводниками I рода. 13. Если степень диссоциации α = 1, то вещества можно отнести к: а) изоляторам; б) электролитам; в) сильным электролитам; г) слабым электролитам. 14. Перенос вещества под действием внешних механических сил называется: а) диффузией; б) конвекцией; в) миграцией; г) перескосом. 15. Перенос вещества, обусловленный неравенством химических потенциалов внутри системы или между системой и окружающей средой, называется: а) диффузией; б) конвекцией; в) миграцией; г) перескосом. 16.Перенос заряженных частиц в электрическом поле, обеспечивающий электрическую проводимость раствора, называется: а) диффузией; в) миграцией; б) конвекцией; г) передачей заряда. 17. Отношение числа продиссоциировавших молекул к общему числу молекул называется: а) константой диссоциации; б) степенью диссоциации; в) изотоническим коэффициентом; г) коэффициентом активности; 18. Теория Аррениуса применима к: а) сильным электролитам; б) слабым электролитам; в) любым электролитам; г) слабым разбавленным электролитам. 19. «Величина диссоциирующей силы пропорционально его диэлектрической проницаемости растворителя»- это формулировка: а) правила Нернста; б) правила Нернста – Каблукова - Томсона.; в) правила Нернста - Каблукова; г) правила Каблукова. 20. Как изменяется константа диссоциации слабого электролита с ростом диэлектрической проницаемости электролита? а) увеличивается; б) уменьшается пропорционально диэлектрической проницаемости растворителя; в) не зависит от величины диэлектрической проницаемости; г) увеличивается пропорционально диэлектрической проницае-мости растворителя.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 200; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.15.15 (0.186 с.) |



 KtxAny xKtY+ + yAnХ-.
KtxAny xKtY+ + yAnХ-.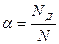 . (1)
. (1)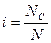 , (2)
, (2)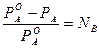
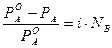
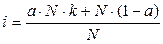 .
.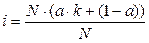 .
.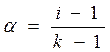 . (5)
. (5) Диссоциация слабых электролитов – это обратимый процесс. При любой температуре в растворе слабого электролита находятся катионы, анионы и молекулы.
Диссоциация слабых электролитов – это обратимый процесс. При любой температуре в растворе слабого электролита находятся катионы, анионы и молекулы.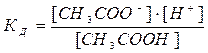 .
.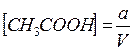 .
.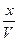 = [H+] = [CH3COO- ],
= [H+] = [CH3COO- ],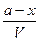 = [ CH3COOH];
= [ CH3COOH];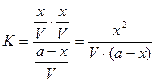 .
.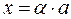 , тогда:
, тогда: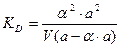 ,
, 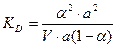 ,
, 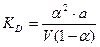 .
.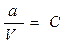 , получаем уравнение, которое называется законом разведения Оствальда:
, получаем уравнение, которое называется законом разведения Оствальда: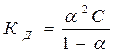 . (13)
. (13)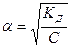 . (15)
. (15)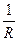 , называемая электрической проводимостью.
, называемая электрической проводимостью.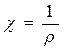 [ом-1 см-1 ] (48)
[ом-1 см-1 ] (48)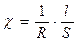 (49)
(49)
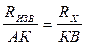 .
.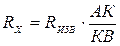 . (50)
. (50) . В ячейку заливают раствор хлорида калия (KCl), удельная электропроводность которого известна. Обычно используется 1н; 0,1н; 0,01н; 0,02н растворы хлорида калия.
. В ячейку заливают раствор хлорида калия (KCl), удельная электропроводность которого известна. Обычно используется 1н; 0,1н; 0,01н; 0,02н растворы хлорида калия.
 Прямой кондуктометрический метод анализа основан на зависимости удельной электропроводности c от концентрации С. Для измерения электропроводности используется схема Кольрауша. В прямой кондуктометрии готовят стандартные растворы электролита, строят градуированный график в координатах c = f(C). Затем определяют электропроводность анализируемого раствора по графику и находят его концентрацию
Прямой кондуктометрический метод анализа основан на зависимости удельной электропроводности c от концентрации С. Для измерения электропроводности используется схема Кольрауша. В прямой кондуктометрии готовят стандартные растворы электролита, строят градуированный график в координатах c = f(C). Затем определяют электропроводность анализируемого раствора по графику и находят его концентрацию Н2SO4 + BaСl2 => BaSO4 + 2HCl,
Н2SO4 + BaСl2 => BaSO4 + 2HCl, 2H+ + SO42- + Ba2+ + 2Cl-- => BaSO4 + 2H+ + 2Cl-,
2H+ + SO42- + Ba2+ + 2Cl-- => BaSO4 + 2H+ + 2Cl-, SO42- + Ba2+ => BaSO4.
SO42- + Ba2+ => BaSO4.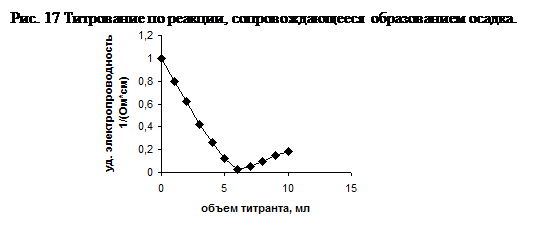

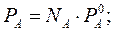 б)
б) 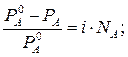
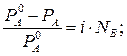 г)
г) 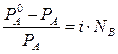 .
.


