
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Российский национальный исследовательскийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ Им. Н.И.Пирогова Министерство здравоохранения и социального развития Российской федерации НЕОРГАНИЧЕСКАЯ ХИМИЯ Часть 1 Общая химия Москва 2014
Государственное бюджетное образовательное учреждение высшего профессионального образования РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ Им. Н.И.Пирогова Министерство здравоохранения и социального развития Российской федерации
Под редакцией профессора В.В.Негребецкого НЕОРГАНИЧЕСКАЯ ХИМИЯ Учебно-методическое пособие для студентов медико-биологического факультета Часть 1 Общая химия Москва 2014
Учебно-методическое пособие "Неорганическая химия» для студентов медико-биологического Часть 1. Общая химия". РНИМУ. 2014. 115c. В основу пособия легли лекции и методические материалы по курсу неорганической химии, подготовленные на кафедре Химии Российского национального исследовательского медицинского университета им. Н. И. Пирогова для студентов, обучающихся по специальностям «медицинская биохимия», «медицинская биофизика», «медицинская кибернетика».
Пособие подготовлено сотрудниками кафедры Химии РНИМУ профессором Тепловым В.В. и ст. преподавателем Овчаренко С.В.
Список литературы Основная: Ахметов Н. С. Общая и неорганическая химия. Учебник.-М.: Высш. шк.,2009. Дополнительная: 1. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. Учебное пособие для вузов.-М.:Химия 2000. 2. Глинка Н. Л. Общая химия. М.: Юрайт. Высш. образ., 2010. 3. Гельфман М.И. Юстратов В.П. Неорганическая химия. Учебное пособие.Из-во «Лань», 2009. 4. Ленский А. С., Белавин И. Ю., Быликин С. Ю. Биофизическая и бионеорганическая химия. М.: МИА, 2008. 5. Теплов В.В. Координационные (комплексные соединения). Учебное пособие.РНИМУ.2012. 6. Мануйлов А.В., Родионов В.И. Основы химии. Интернет-учебник.НГУ. 1998. 7. Зацепина Г.Н. Физические свойства и структура воды.– М.:МГУ, 1998. 8. Аликберова Л.Ю., Савинкина Е.В.,Давыдова М.И. Основы строения вещества. Методическое пособие. МИТХТ. 2004. 9. Р.Досон, Д.Эллиот, У.Эллиот, К.Джонс. Справочник биохимика. М. Издательство «Мир» 1991.
Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства. Каждому элементу соответствует определённый вид атомов. Молекула — наименьшая частица данного вещества, обладающая его основными химическими свойствами, способная к самостоятельному существованию и состоящая из одинаковых или различных атомов, соединённых в одно целое химическими связями. Простое вещество состоит из атомов одного элемента, например О2,Н2. Сложное вещество состоит из атомов разных элементов, например Н2О, H2SO4. Моль — количество вещества, содержащее столько же структурных элементов, сколько атомов содержится в 0,012 кг изотопа углерода 12С. Структурными элементами могут быть атомы молекулы ионы электроны и другие частицы. Число атомов в 0,012кг углерода равно 6,023∙1023 . Это число называется постоянной Авогадро NA. Такое же число молекул содержится в 1 моль любого вещества с молекулярной структурой. Молярная масса — масса 1 моль вещества. Например, молярная масса воды М(H2O) = 18г/моль. Молярная масса равна частному от деления массы вещества на его количество. M(X) = m(X) / n(X). Химическая формула соединения указывает на его качественный и количественный состав. Химические уравнения — это способ описания процесса химического превращения веществ, отражающий качественные и количественные изменения, происходящие в результате реакции. Закон сохранения массы — общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции. В соответствии с теорией относительности А. Эйнштейна общая масса веществ в ходе реакции должна изменяться в результате выделения или поглощения энергии согласно уравнению ∆E = ∆mc2. но в химических реакциях изменение массы вследствие энергетических эффектов неощутимо мало. Химический эквивалент — это реальная или условная частица вещества «В», которая в данной кислотно-основной реакции эквивалентна одному иону Н+ или в данной окислительно-восстановительной реакции одному электрону. В одной формульной единице вещества «В» может содержаться z (в) химических эквивалентов этого вещества. Эквивалентное число z (в) показывает, сколько химических эквивалентов содержится в одной формульной единице; всегда z(в) ≥1. Например, 0,1н H2SO4 — это раствор, содержащий 0,1 моль/л эквивалента серной кислоты, т.е. (1/2 H2SO4). При указании нормальной концентрации обязательно следует указывать конкретную реакцию, в которой данный раствор применяется. Так как в реакциях нейтрализации ион Н+ всегда реагирует с одним ионом ОН -, то можно определять эквивалент вещества и по гидроксид-ионам. Эквивалент не является жестко зафиксированным для какого-либо вещества. В зависимости от конкретной реакции меняется и величина эквивалента. Например, для реакции нейтрализации гидроксида алюминия соляной кислотой до средней соли Al(OH)3+ 3HCl = AlCl3 + 3H2O одной частице гидроксида алюминия соответствуют 3 иона Н+ . Значит, в этой реакции эквивалент равен 1/3 Al(OH)3. В реакции же неполной нейтрализации до основной соли Al(OH)3 + HCl = Al(OH)2Cl + H20 на одну частицу гидроксида алюминия приходится один Н+. В таком случае, эквивалент и формульная единица совпадают. Для количественного описания вводятся две величины: эквивалентное число z и фактор эквивалентности f. Эквивалентное число показывает, сколько эквивалентов содержит формульная единица данного вещества. Величина z всегда целая: 1, 2, 3 и т.д. Расчет удобно проводить по уравнению реакции: z равно числу ионов Н+ (или ОН -), приходящихся на одну формульную единицу определяемого вещества. Фактор эквивалентности — величина, обратная эквивалентному числу f = 1 / z. Фактор эквивалентности показывает, какая часть молекулы (или формульной единицы) вещества соответствует его эквиваленту и принимает значения: 1, 1/2, 1/3 и т.д. Если эквивалент представляет собой часть молекулы (или формульной единицы), то целесообразно ввести следующие понятия: Молярная масса эквивалента — масса 1 моль эквивалента М(1/z X) = M/z =M∙f (г/моль). Например, M(1/2H2SO4) = 98/2 = 98 ∙ 1/2 = 49 г/моль. Эквивалентное количество n(1/X) = m(X)/M(1/z X) моль. Например, n(1/2H2SO4) = m(H2SO4) / M(1/2H2SO4) = 24,5г / 49 г/моль = 0,5 моль. Закон эквивалентов — массы реагирующих веществ относятся между собой как молярные массы их эквивалентов. Другая формулировка закона эквивалентов — эквивалентные количества реагирующих и образующихся веществ равны. Дляреакции: aA + bB = cC + dD, где a,b,c,d — коэффициенты в реакции, а A,B.C D — реагенты и продукты, существует закономерность: neq(A) = neq(B) = neq(C) = neq(D). Закон Авогадро – в равных объёмах различных газов при одинаковой температуре и давлении содержится одинаковое число молекул. Из закона Авогадро следует: - 1 моль любого газа при одинаковых условиях занимает один и тот же объём. - при нормальных условиях (давлении 101,3 кПа и температуре 273,15К = ОоС) 1 моль любого газа занимает объём 22,4л. Закон Гесса. Тепловой эффект химической реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода. Следствия из закона Гесса. 1 следствие: Тепловой эффект химической реакции при стандартных условиях равен сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ. Например: СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж) ∆ Нореакции = [∆Ноf,298(СО2) + 2 ∆Ноf,298(Н2О)] – [ ∆Ноf,298(СН4) + 2 ∆Ноf,298(О2)] = [– 393,5 + 2(– 241,8)] – [(– 74,8) + 2∙ 0] = – 802,3 кДж. 2 следствие: Тепловой эффект химической реакции при стандартных условиях равен сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции. Например: С2Н2 (г) + СО(г) + Н2О(ж) = СН2 = СНСООН(ж) ∆ Нореакции = [∆Носг ,298(С2Н2) + ∆Носг ,298(СО) + ∆Носг ,298(Н2О) – [ ∆Носг ,298(С2Н3СООН)] = [– 1299,6 – 282,5 + O] – [– 1370,0] = – 211,13 кДж Первое начало термодинамики не даёт ответа на вопрос о направлении самопроизвольно протекающих процессов при данных условиях. Самопроизвольные процессы—это процессы, происходящие вокруг нас, которые, исходя из опыта, мы считаем наиболее вероятными. Например, энтальпия реакции 12С(т) + 11Н2О(ж) = С12Н22О11(т), рассчитанная по закону Гесса ∆Н<O, хотя она реально неосуществима, а у реакции N2(г) + O2(г) = 2NO(г) ∆Н>O, но она протекает при высокой температуре. Таким образом, изменение энтальпии нельзя считать единственной причиной самопроизвольного протекания реакций. Существует ещё функция состояния системы, изменение которой оказывает влияние на направление процесса — энтропия S. Энтропия – функция состояния системы, величина которой показывает меру неупорядоченности, хаотичности системы. Одна из формулировок второго начала термодинамики — в изолированных системах самопроизвольно протекающие процессы сопровождаются увеличением энтропии. Для необратимых процессов в изолированных системах изменение энтропии ∆ S>O, для обратимых процессов ∆S = O. Все реальные процессы необратимы, лишь небольшое число из них можно приближённо рассматривать как обратимые. Следовательно, в результате реальных процессов энтропия изолированной системы всегда увеличивается. Чем ближе термодинамическое равновесие, тем больше хаотичность расположения молекул в теле или в системе. Таким образом, самопроизвольные процессы в изолированных системах протекают только в направлении возрастания энтропии S. ∆S = S2 – S1 >O идёт процесс 1→ 2 ∆S = S2 – S1 <O идёт процесс 2 ← 1 ∆S = O термодинамическое равновесие В неизолированной системе самопроизвольно протекают реакции, в результате которых химическая система достигает состояния, характеризующегося не только меньшей энтальпией, но и большей энтропией. Учесть одновременно оба фактора для систем находящихся при постоянном давлении и температуре позволяет функция состояния — свободная энергия Гиббса: G = H —TS. Абсолютные значения энергии Гиббса, так же как и абсолютные значения энтальпии, невозможно определить, поэтому используют уравнение ∆G =∆ H —T∆S Условием самопроизвольного протекания изобарно-изотермических процессов является неравенство ∆ G<O. Реакция продолжается до достижения минимального значения энергии Гиббса. В обратимых реакциях минимальная энергия системы достигается в состоянии химического равновесия. После установления химического равновесия ∆G = O. Величина энергии Гиббса складывается из энтальпийного вклада ∆H и энтропийного вклада T∆S. Рассмотрим различные варианты: 1. ∆H<O, ∆S >O ∆G <O, процесс протекает в прямом направлении независимо от величин ∆H, ∆S, T. 2. ∆H <O, ∆S <O ∆G <O, если |∆H|>|T∆S|, такие реакции возможны при низких температурах. 3. ∆ H >O, ∆S <O ∆G >O, процесс может протекать только в обратном направлении 4. ∆H > O,∆S >O∆G<O, если |T∆S|> |∆H|, процесс может протекать при высокой температуре. Пример 1. Рассчитайте стандартную энтальпию реакции 2SO2(г) + O2(г) = 2SO3(г) ΔHfo (кДж/моль) – 297 0 – 396 Решение: Δ Нор-ции = Σ ΔНопрод – Σ ΔНоисх = 2(– 396) – [2(– 297) + 1(0)] = = – 198 кДж Пример 2. Рассчитайте стандартную энтальпию образования этанола, если стандартные энтальпии сгорания углерода, водорода и этанола соответственно равны (в кДж/моль): – 393,5; – 285,8; – 1366,9. Решение: Уравнение реакции, соответствующей энтальпии образования этанола: 2С + 3Н2 + 0,5О2 = С2Н5ОН Δ Нор-ции =Σ ΔНосг.исх – Σ ΔНосг.эт. = 2(– 393,5) + 3(– 285,8) – (– 1366,9) = = – 277,6 кДж По определениюΔ Нор-ции = ΔHfo(С2Н5ОН). Пример 3. Рассчитайте стандартную энтропию ΔSo реакции: SO2(г) + 0,5O2(г) = SO3(г) Стандартные энтропии образования SO2(г),SO2(г),SO3(г) равны соответственно (в Дж/К моль): 248, 205, 257. Решение: ΔSo = Σ S fo прод. – Σ Sf oисх. = 2·257 – (2· 248 1· 205) = = – 187 Дж/К Пример 4. Пользуясь значениями ΔGof отдельных соединений, вычислите ΔGo реакции SO2(г) + NO2(г) = SO3(г) + NO(г) и определите её направление в стандартных условиях. ΔGof оксида серы()VI), оксида азота(II), оксида серы (IV), оксида азота(IV) соответственно равны (в кДж/моль): – 370,4; 86,6; – 300,4; 51,8. Решение: ΔGo р-ции = [ΔGof(SO3) + ΔGof(NO)] – [ΔGof(SO2) + ΔGof(NO2)] = (–370,4 + 86,6) – (–300,4 + 51,8) = –35,2 кДж.Величина ΔGo р-ции < О, значит реакция протекает в сторону образования SO3 и NO. Упражнения и задачи для самостоятельного решения
1. Стандартные энтальпии образования (в кДж/моль) аммиака и нитрата аммония равны соответственно: – 46,0 и – 365,4. Напишите уравнения реакций, к которым относятся эти тепловые эффекты. 2. При образовании 1,70г аммиака выделилось 4600Дж тепла. Определите стандартную теплоту образования аммиака. Ответ: ∆Нf(NH3) = – 46,0 кДж/моль 3. Рассчитайте энтальпию реакции (при стандартных условиях): SO2(г)+ 2H2S(г)= 3S(кр).+ 2Н2О(ж), если стандартные энтальпии образования SO2(г),H2S(г) и.H2О(ж) равны соответственно(в кДж/моль): –297,0; –21,0; –286,0. Ответ: ∆Нр-ции= – 233кДж 4. Окисление аммиака протекает по уравнению: 4NH3(г)+ 302(г)= 2N2(г) + 6Н2О(ж). Стандартная энтальпия реакции равна –1532 кДж. Определите стандартную энтальпию образования аммиака, если стандартная энтальпия образования воды –286,0кДж/моль. Ответ: ∆Нf(NH3) = –46,0 кДж/моль 5. Не производя вычислений, установите знак изменения энтропии реакции окисления аммиака (см.п.4). 6. Рассчитайте стандартную энергию Гиббса реакции: СО(г) + Н2О(ж) = СО2(г) + Н2(г).Установите, в каком направлении эта реакция может протекать самопроизвольно в стандартных условиях при 25оС. Стандартные энергии Гиббса образования СО2(г), Н2О(ж) и СО(г) соответственное(в кДж/моль): –394,0; –121,0; –137.0. Ответ:∆Goр-ции = –136 кДж ХИМИЧЕСКОЕ РАВНОВЕСИЕ Основные понятия и признаки химического равновесия Большинство химических реакций является обратимыми, т.е. протекают одновременно в двух противоположных направлениях, например: N2 + 3H2 = 2NH3. Реакция, протекающая слева направо (соединение азота с водородом), называется прямой. Реакция, протекающая справа налево (разложение аммиака), называется обратной. По истечении времени концентрации веществ, образующих данную систему, перестают меняться и остаются постоянными во времени, если не изменяются внешние условия ― установилось химическое равновесие. Равновесное состояние — термодинамическое состояние сиcтемы, которое при постоянных внешних условиях не изменяется во времени, причём стабильность характеристик системы (состав, давление и др.) не обусловлена протеканием какого-либо внешнего процесса. Признаки истинного равновесия системы: 1. Неизменность равновесного состояния системы при сохранении внешних условий. 2. Подвижность равновесия — самопроизвольное восстановление равновесие после прекращения внешнего воздействия. 3. Динамический характер равновесия — скорость прямого процесса равна скорости обратного процесса. 4. Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию. 5. Энергия Гиббса в состоянии истинного термодинамического равновесия минимальна Gmin, a изменение энергии Гиббса равно нулю ∆G=0. Концентрации реагентов и продуктов реакции в состоянии химического равновесия называются равновесными. Состояние равновесной химической системы характеризуется по закону действующих масс константой равновесия. Для обратимой химической реакцией, которую в общем виде можно изобразить уравнением aA + bB = dD + qQ константа равновесия имеет вид:
где Кс — концентрационная константа равновесия; [A], [B] — равновесные концентрации исходных веществ; [D], [Q] — равновесные концентрации продуктов реакции; a,b,d,q — стехиометрические коэффициенты. Выражение константы равновесия показывает: для идеальных систем в состоянии химического равновесия отношение произведений концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре давлении и в данном растворителе. Для реальных систем, в которых имеют место как электростатические, так и химические взаимодействия, значения концентрационных констант зависят от многих факторов. Значение концентрационной константы зависит от температуры, давления, природы растворителя и ионной силы раствора. Величина константы равновесия, выраженная через активности реагирующих частиц называется термодинамической константой равновесия. В общем случае формулировка закона действующих масс гласит: в состоянии химического равновесия отношении произведений активностей продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению активностей исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре, давлении и в данном растворителе.
Термодинамическая константа зависит от наименьшего числа факторов и, следовательно, являются наиболее фундаментальными характеристиками равновесия. В справочниках приводятся именно термодинамические константы равновесия. Факторы, влияющие на величину константы химического равновесия: 1. Природа реагирующих веществ 2. Температура. Факторы, не влияющие на величину константы равновесия: 1. Концентрации реагирующих веществ 2. Давление в реакционной системе 3. Наличие примесей РАСТВОРЫ
Основные понятия. Образование растворов
Растворами называются однородные системы, состоящие из двух и более компонентов, состав которых можно изменять в определённых пределах без нарушения однородности. Растворы бывают газовые, жидкие и твёрдые. В химии, биологии и медицине чаще всего приходится иметь дело с жидкими растворами. В жидких растворах принято различать растворитель и растворённое вещество. Растворителем называют (чаще всего) тот компонент раствора, которого больше, либо тот компонент, который не меняет своего агрегатного состояния при растворении. Причина образования истинного раствора ― уменьшение энергии Гиббса в результате взаимодействия компонентов раствора ΔGрастворения < 0. При внесении растворяемого вещества в растворитель процесс растворения идёт самопроизвольно (ΔGрастворения < 0) и раствор остаётся ненасыщенным. Когда энтальпийный и энтропийный факторы процесса станут одинаковыми, т.е. ΔGрастворения = 0, система окажется в состоянии истинного равновесия. Раствор становится насыщенным. Таким образом, раствор — это равновесная однородная система, которая достигла минимума энергии Гиббса в результате взаимодействия всех её частиц за счёт всех возможных типов взаимодействия между ними. Можно получить и пересыщенный раствор, т.е. такой, концентрация которого выше концентрации насыщенного раствора (при данной температуре и давлении). Такой раствор получается при осторожном и медленном охлаждении насыщенных при высокой температуре растворов. Пересыщенный раствор представляет собой систему, находящуюся в кажущемся равновесии (∆G>0). Встряхивание или внесение в раствор кристаллов того же вещества вызывает кристаллизацию и раствор становится насыщенным. Растворимость данного вещества определяется концентрацией его в насыщенном растворе. Эффекты, возникающие в результате взаимодействия молекул растворителя с частицами растворённого вещества, называются сольватационными. По своей природе они являются частично электростатическими (физическая сольватация), частично химическими (химическая сольватация). В растворителях неполярных и малополярных, не содержащих ни подвижных протонов, ни донорных атомов, способных к образованию координационных связей, возможна только физическая сольватация, обусловленная ван-дер-ваальсовыми силами (углеводороды и их галогенопроизводные).В полярных растворителях, имеющих донорные атомы, содержащих или не содержащих подвижных протонов (кетоны, простые эфиры, вода спирты, карбоновые кислоты, амины) возможна как физическая, так и химическая сольватация. Для недиссоциированных молекул и ионов, недостаточно склонных к образованию координационных связей (катионы большинства щелочных и щелочно-земельных металлов, органические ионы, многие анионы) характерна физическая сольватация. Химическая сольватация обусловлена образованием координационных связей между молекулами растворителя и частицами растворённого вещества. Она характерна для катионов d- и p- элементов. Такие катионы, например, образуют в воде аквакомплексы: [Cr(H2O)6]3+, [Zn(H2O)4]2+, [Al(H2O)6]3+ и т.д. Термодинамика процесса растворения ΔGрастворения =ΔHрастворения – TΔSрастворения Если имеет место сильное взаимодействие частиц растворяемого вещества и растворителя, то процесс растворения — экзотермический: ΔHрастворения < 0. В этом случае изменение энтропии может быть как положительной (ΔSрастворения >0), так и отрицательной величиной (ΔSрастворения<0). Часто процесс растворения сопровождается изменением агрегатного состояния. Тогда: ΔHрастворения =ΔНфазового перехода + ΔHсольватации ΔSрастворения =ΔSфазового перехода + ΔS сольватации Для кристаллов энтальпия фазового перехода ΔНф.п. равна энергии разрушения кристаллической решётки и, следовательно, ΔНф.п. > 0 и ΔSф.п.> 0. Сольватация — процесс экзотермический ΔНсольв.<0. Поэтому энтальпия процесса растворения может быть ΔНраств > 0 и < 0.Поскольку процесс растворения связан с взаимодействием растворяемого вещества и растворителя, растворение сопровождается изменением структуры и растворяемого вещества и растворителя. Сольватация означает упорядочение системы (происходит уменьшение числа частиц, образование новых структур). Следовательно: ΔSсольв.<0. Однако по абсолютной величине изменение энтропии мало и поэтому при растворении ΔS.> 0. По мере увеличения концентрации раствора усиливается интенсивность взаимодействия между содержащими его частицами и усложняется его структура. При разбавлении, наоборот, строение раствора упрощается, и взаимодействие между частицами ослабевает. Введение растворённого вещества может привести как к уменьшению энтропии растворителя, так и к её увеличению. Структурирующие ионы для воды (уменьшающими её энтропию) — это малые по размеру и многозарядные ионы: Li+, Na+, Mg2+, Al3+,Fe3+,OH и др. Деструктурирующие ионы (увеличивающие её энтропию) — это большие однозарядные ионы: K+, Rb+, Cs+, Cl-, NO3-, ClO4- и др.. Структурирующие ионы — ионы с высокой напряжённостью электрического поля, которые могут поляризовать молекулы воды за пределами первой гидратной оболочки. Это приводит к повышению вязкости растворов. Деструктурирующие ионы не могут поляризовать воду за пределами первой гидратной оболочки, в результате вязкость этих растворов меньше, чем у чистой воды.
4.2. Способы выражения состава растворов Массовая доля ω(в) растворённого вещества «В» — отношение массы растворённого вещества m(в) к сумме масс растворённого вещества и растворителя, чаще всего, воды (т.е. к массе раствора): w(в) = Массовая доля растворённого вещества выражается в долях или в %%(процентное содержание). Например, раствор с массовой долей серной кислоты ω(H2SO4)=0,2(т.е.20%) может быть обозначен как 20% - раствор серной кислоты. В биологии и медицине также часто используют мг% и мкг%. Число мг% показывает, сколько мг растворённого вещества содержится в 100 г раствора. Число мкг% показывает, сколько мкг растворённого вещества содержится в 100 г раствора. Содержание растворённого вещества в мг% и мкг% применяют для характеристики очень разбавленных растворов. Например, массовая доля раствора глюкозы равна 0,001% или 1мг% или 1000мкг%. Молярная концентрация с(в) растворённого вещества «В» — отношение количества вещества n(в) к объёму раствора: c(в)= Раствор, в котором молярная концентрация растворённого вещества равна с(в) моль/л, характеризуется молярностью, численно равной значению с(в). Например, раствор с молярной концентрацией серной кислоты с(H2SO4)= 0,1моль/л может быть обозначен как 0,1М H2SO4 (децимолярный раствор серной кислоты в воде). Нормальность (молярная концентрация химического эквивалента сeq (в) растворённого вещества «В» —это отношение эквивалентного количества вещества neq(в) к объёму раствора:
Раствор, в котором молярная концентрация эквивалента равна ceq(в) моль/л, характеризуется нормальностью, численно равной значению ceq(в). Например, раствор с молярной концентрацией эквивалента серной кислоты ceq(H2SO4)= 1моль/л может быть обозначен как 1н H2SO4 (однонормальный раствор серной кислоты в воде). Нормальность раствора определяется эквивалентным количеством растворённого вещества и, следовательно, как и последнее, зависят от эквивалентного числа z(в), постоянного только для конкретной реакции, причём величина ceq(в) всегда в z(в) раз больше его молярной концентрации c(в): сeq(в)=z(в)∙ с(в). Молярная доля χ растворённого вещества ― отношение количества данного компонента «В» в молях, содержащегося в растворе, к общему количеству всех веществ, включая растворитель: χ = n(в) / [n(в) + n(р-ль)] Молярная доля χ, как и массовая выражается в долях единицы, в процентах. Например, χ(H2SO4) = 0,01 = 1%. Моляльность раствора b – отношение количества данного растворённого вещества n(в) моль к массе растворителя (в кг): b = n(в) / m(р-ль). Например, b(H2SO4) = 0.1моль/кг.
Пример 1. В 450 г воды растворили 50 г CuSO4·5H2O. Вычислите массовую долю кристаллогидрата, безводной соли и ионов меди в растворе. Решение: ω (CuSO4·5H2O) = ω (CuSO4) = Пример 2. Какую массу 5%-ного раствора MgSO4 можно приготовить из 300 г MgSO4 ·7H2O? Решение: ω(MgSO4) = m(MgSO4) / m (р-р). m(р-р) = m(MgSO4) / 0,05. m(MgSO4) = m(MgSO4 ·7H2O) /M (MgSO4 ·7H2O) ·M(MgSO4) = =300 / 246 · 120 = 146,3(г) m(р-р) = 146,3 / 0,05 = 2926,8(г)
Пример3. Сколько воды следует прибавить к 200мл 20% -ного раствора серной кислоты с плотностью 1,14г/мл, чтобы получить 5% -ный раствор? Решение: m(р-ра H2SO4) = 200·1,14 = 228(г). m(H2SO4) = 228 · 0.2 = 45.6(г) Массовая доля серной кислоты в конечном растворе: 0,05 =45,6 / [228 + m(H2O)]. Отсюда: [228 + m(H2O)] = 45,6/0,05 = 912(г) m(H2O) = 912 – 228 = 684(г). Пример 4. Смешали 300г 40% раствора азотной кислоты и 700г 10% раствора той же кислоты. Определите массовую долю полученного раствора. Решение: m(р-ра HNO3) = 300 + 700 = 1000(г). m(HNO3) = 300 · 0,4 + 700 · 0,1 = 190(г). ω(нового раствора) = 190/1000 = 0,19=19% Пример 5. Определите массу 30% раствора серной кислоты, которую следует добавить к 600 г 80% раствора той же кислоты для получения 60% раствора. Решение: Пусть масса 30% раствора x. Тогда масса раствора после смешения: m(р-р) = 600 + x m(H2SO4) = 600 · 0,8 + x · 0,3. 0,6 = [600 · 0,8 + x · 0,3. 0,6] / (600 + x). x = 400(г). Пример 6. Как приготовить 500мл 1,5 М раствора серной кислоты из 96%-ного раствора с плотностью 1,84г/мл? Решение: n(H2SO4) = 1,5 · 0,5 = 0,75(моль). m(H2SO4) = 98 0,75 = 73,5(г). V(96% р-ра H2SO4) = 73,5/ 1,84 · 0,96 = 42(мл). Далее: необходимо долить воды, чтобы довести объём раствора до 500мл. Пример 7. Вычислите нормальность и молярную концентрацию раствора H3PO4 с массовой долей кислоты 49% и плотностью 1,33г/мл. Фактор эквивалентности кислоты равен 1/3. Решение: Масса 1л раствора: 1000 ·1,33 = 1330(г). m(H3PO4) = = 1330 · 0,49 = 650(г). n(H3PO4) = 650 / 98 = 6,6(моль). c(H3PO4) = 6,6 моль/л; c(1/3 H3PO4) = 6,6 / (1/3) = 19,8(моль экв), т.е.19,8н H3PO4. Пример 8. Рассчитайте нормальность и молярную концентрацию раствора гидроксида натрия, если 20мл этого раствора было нейтрализовано 10мл 0,1н H2SO4. Решение: В соответствии с законом эквивалентов: c(NaOH) ∙V(NaOH) = c(1/2H2SO4) ∙ V(H2SO4). Отсюда c(NaOH) = c(1/2H2SO4) ∙ V(H2SO4) / V(NaOH) = 0,1 ∙10 / 20 = = 0,05(моль/л). Задачи для самостоятельного решения
1. Определите массу растворённого вещества: а) в 250 г 8%-ного раствора K2CO3,. б) в 500 мл 5%-ного раствора азотной кислоты с плотностью раствора 1,03г/мл. Ответ: а)20г; б)25,75г. 2. Вычислите массовую долю растворённых веществ для растворов, содержащих: а)1 моль аммиака в 3 моль воды; б) 100г серной кислоты в 10 моль воды. Ответ: а)23,9%; б)35,7%. 3. Вычислите массовую долю безводной соли для раствора, приготовленного из 14,3г Na2CO3· 10H2O и 120г воды. Ответ: 3,95%. 4. Вычислите массовую долю безводной соли в растворе, полученном растворением 0,01 моль кристаллогидрата Al2(SO4)3 · 18 H2O в 1,0 моль воды. Ответ: 13,86%. 5. Какую массу хлорида калия следует добавить к 450 г 8%-ного раствора той же соли для получения 12%-ного раствора? Ответ: 20,45г. 6. Какую массу воды следует добавить к 1кг 40%-ного раствора серной кислоты для получения 25%-ного раствора? Ответ: 600г. 7. Из 750 кг 48%-ного раствора серной кислоты выпарили 300 кг воды. Определите массовую долю серной кислоты в полученном растворе. Ответ: 80%. 8. Какую массу 32%-ного раствора азотной кислоты следует добавить к 600 г 80%- ного раствора той же кислоты для получения 64%-ного раствора? Ответ: 300г. 9. Определите массу 8%-ного раствора гидроксида натрия, которая потребуется для нейтрализации 292 г 20%-ного раствора соляной кислоты. Ответ: 800г. 10. Какой объём 5,5%-ного раствора азотной кислоты (плотность равна 1,03г/мл) требуется для нейтрализации 60 мл 12%-ного раствора КОН (плотность равна 1,1г/мл)? Ответ: 157мл. 11. К 700 мл 84,5%-ного раствора серной кислоты (плотность 1,78г/мл) добавлено 1200 мл 42%-ного раствора гидроксида натрия (ρ = 1,45 г/мл). Какой объём 35%-ного раствора гидроксида калия (плотность 1,35 г/мл) потребуется добавить к раствору для достижения нейтральной реакции? Ответ: 380мл. 12. Определите массу растворённого вещества, содержащегося в 1л следующих растворов: а) 0,1н H2SO4(фактор эквивалентности ½); б) 0,5н Na2CO3 (фактор эквивалентности ½); в) 0,3н H3PO4 (фактор эквивалентности1/3). Ответ: а)4,9г; б)26,5г; в)9,8г. 13. Какой объём раствора 0,1н H2SO4 (фактор эквивалентности ½) можно приготовить из 70 мл 50%- ного раствора этой кислоты (ρ = 1,40 г/мл)? Ответ: 10л. 14. Вычислите нормальность и молярную концентрации следующих растворов: а) 40%-ный раствор гидроксида натрия(ρ = 1,43 г/мл); б)20%-ный раствор соляной кислоты (ρ= 1,1 г/мл); в) 18%-ный раствор аммиака (ρ=0,932 г/мл). Ответ: а) 14,3 моль/л; б) 9,87моль/л; в) 6,03моль/л. 15. Двумолярный раствор серной кислоты разбавили в 5 раз. Определите концентрацию полученного раствора. Ответ: с(H2SO4) =0,4 моль/л.. 16. Вычислите массовую долю одномолярного раствора нитрата никеля(II), плотность которого равна 1,14г/мл. Ответ: 16%. 17. Какой объём 0,5н NaOH требуется, чтобы осадить в виде Cu(OH)2 всю медь, содержащуюся в 15мл 1,2н CuCl2? Ответ: 36 мл. 18. Навеска оксалата натрия Na2C2O4 массой 1,6260г растворена в мерной колбе ёмкостью 250мл. Какой объём 0,09768 н KMnO4 будет израсходован на титрование 25,0мл раствора оксалата натрия в кислой среде? Ответ:24,84мл. 19. Рассчитайте массу дихромата калия, которая потребуется для приготовления 500мл раствора 0,05н K2Cr2O7 , необходимого для определения концентрации тиосульфата натрия Na2S2O3. Ответ: 1,23г 20. Какая масса Na2CO3 требуется для взаимодействия с 600 мл 0,5н HNO3? Ответ: 15,9г. 21. Какая масса BaCl2 · 2H2O потребуется для взаимодействия с 750 мл 0,12н H2SO4 (фактор эквивалентности ½)? Ответ: 11г. 22. Определите нормальную концентрацию 0,1 М H3PO4, используемого для получения гидрофосфатов. Ответ: c=0,2 мольэкв/л. 23. Рассчитайте нормальность соляной кислоты, если на титрование 20,0мл кислоты пошло 15,0мл 0,02н Na2B4O7. Ответ: c(HCl) = 0,015 моль/л. 24. Сколько миллилитров раствора соляной кислоты с массовой долей 30% и плотностью 1,15г/мл потребуется для приготовления 1,5л 0,2н HCl? Ответ: 32мл. 25. Навеска буры Na2B4O7 ∙10H2O массой 2,4г растворена в мерной колбе ёмкостью 200мл. На титрование 20,0мл раствора серной кислоты расходуется 33,9мл приготовленного раствора буры. Рассчитайте нормальность раствора серной кислоты. Ответ: c(1/2H2SO4) =0,1 моль/л. 26. В плазме крови содержится 152 ммоль/л ионов натрия. Считая, что ионы натрия находятся только в виде хлорида натрия, вычислите массовую долю хлорида натрия в плазме крови. Плотность плазмы крови 1,03 г/мл. Ответ: ω=0,86% 27. Для раствора сахарозы с концентрацией 0,1 моль/л рассчитайте массовую долю сахарозы(в %,мг%, мкг%), моляльность b, молярную долю χ. ρ (р-ра) = 1,03
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 516; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.83.202 (0.015 с.) |

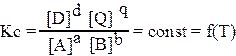

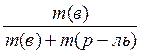
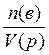 (моль/л).
(моль/л).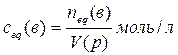
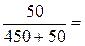 0,1 = 10%
0,1 = 10% 
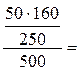 6,4% ω (Cu2+) =
6,4% ω (Cu2+) = 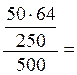 2,56%
2,56% 


