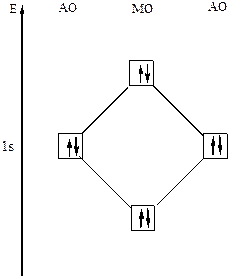Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетические диаграммы двухатомных частиц, образованных элементами первого периодаСодержание книги
Поиск на нашем сайте
а) Образование молекулярных орбиталей в молекуле водорода из атомных 1s-орбиталей. При линейной комбинации двух атомных волновых функций ΨА и ΨВ , принадлежащих атомам водорода А и В, получаются две молекулярные волновые функции: Ψ+ = ΨА + ΨВ Ψ–. = ΨА – ΨВ Молекулярная волновая функция Ψ+, образующаяся в результате сложения атомных волновых функций, описывает связывающую молекулярную орбиталь σs. Молекулярная функция Ψ–, образующаяся в результате взаимного вычитания атомных волновых функций, описывает разрыхляющую орбиталь σs*. При нахождении электронов на связывающей молекулярной орбитали полная энергия системы из двух атомов меньше, чем при нахождении электронов на исходных атомных орбиталях, а пребывание электронов на разрыхляющей орбитали увеличивает силы отталкивания между ядрами — энергия системы возрастает.
Рис. 14 Энергетическая диаграмма образования молекулы Н2 На энергетической диаграмме (рис.14) связывающая орбиталь располагается ниже, а разрыхляющая орбиталь — выше соответствующих атомных орбиталей. Молекула водорода содержит два электрона с противоположными спинами на σs-орбитали. Молекула диамагнитна. Энергия связи в Н2 равна 435 кДж/моль. Порядок связи равен 2/2 = 1. б) Образование молекулярных орбиталей в ионе Н2+ Ион Н2+ состоит из двух протонов и одного электрона. На σ-связывающую молекулярную орбиталь катиона Н2+переходит один электрон атома H с выигрышем энергии. Образуется устойчивое соединение с энергией связи 255кДж/моль. Порядок связи равен 1/2. Молекулярный ион парамагнитен (рис.15).
Рис. 15 Энергетическая диаграмма образования иона Н2+ в) Образование молекулярных орбиталей в частице Не
Рис. 16 Энергетическая диаграмма, иллюстрирующая невозможность образования химической связи между атомами He В этом случае два электрона займут связывающую молекулярную орбиталь, а два других — разрыхляющую (рис.16). Выигрыша в энергии такое заселение двух орбиталей электронами не принесет. Порядок связи равен 2–2 =0. Следовательно, молекулы He2 не существует. Таблица 1 Энергия и порядок связи в молекулах элементов 1 периода
Таблица 1 показывает что в ряду Н2+–Н2–Не2 + по мере заполнения электронами связывающей орбитали энергия и порядок связи увеличивается, а при появлении электрона на разрыхляющей орбитали, наоборот, уменьшается. Молекула гелия в невозбуждённом состоянии не существует.
Гетероядерные двухатомные молекулы образованные элементами разных периодов.
У гетероядерных молекул имеется существенное отличие от гомоядерных, связанное с различием по энергии у разных атомов. Чем выше электроотрицательность атома, тем ниже энергия однотипных орбиталей, следовательно, чем больше различие в электроотрицательности у взаимодействующих атомов, тем больше различие в энергиях комбинируемых однотипных орбиталей. Рассмотрим образование молекулярных орбиталей в молекуле HF.На образование связей атом водорода предоставляет 1s-орбиталь а атом фтора —2s-,2px-,2py-,2pz-.В линейной комбинации могут участвовать лишь энергетически близкие атомные орбитали,имеющие одинаковую симметрию относительно линии связи в молекуле и перекрывающиеся в значительной степени. Только одна орбиталь фтора 2px удовлетворяет этим требованиям,а 2s-орбиталь сильно отличается по энергии. Ориентация 2py- и 2pz- орбиталей относительно линии связи такова—перпендикулярные к линии связи должны перекрыватся в двух областях пространства по обе линии связи, а это не обеспечивает перекрывания с 1s- орбиталью водорода. При линейной комбинации 1s-орбитали атома водорода с 2px-орбиталью атома фтора образуются две молекулярные орбитали: связывающая σx и разрыхляющая σx*. Атомные орбитали фтора 2s,2py,2pz, занятые электронными парами, переходят в молекулу в неизменном виде и называются несвязывающими — σ2s,,πyo,πzo(рис.17).
Рис.17 Энергетическая диаграмма HF
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 988; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.235.59 (0.009 с.) |