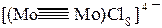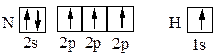Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительные реакции с участием органических веществ.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для нахождения коэффициентов в ОВР с участием органических веществ различных классов удобно использовать метод электронно-ионного баланса. В данных реакциях органические вещества почти всегда являются восстановителями. Естественно, необходимо знать, какими будут продукты окисления органических веществ. Рассмотрим реакцию Вагнера ― окисление алкенов перманганатом калия в холодных нейтральных растворах. В качестве восстановителя возьмем пропен C3H6. Запишем схему реакции: C3H6 + KMnO4 + H2O = C3H6(OH)2 +MnO2 + KOH
MnO4– + 2 Н2О + 3е- → MnO2 + 4ОН– 2 C3H6 + 2 Н2О – 2e- → C3H6(OH)2 + 2 H+ 3 2MnO4– + 10 Н2О + 3 C3H6 → MnO2 + 8 ОН– + 6 H+ + 3C3H6(OH)2 2MnO4– + 10 Н2О + 3 C3H6 → MnO2 + 2 ОН-– + 6Н2О + 3C3H6(OH)2 Сокращая воду в левой и правой частям, получаем окончательные коэффициенты: 3C3H6 +2 KMnO4 + 4H2O = 3C3H6(OH)2 + 2MnO2 + 2KOH
Рассмотрим несколько примеров определения коэффициентов в ОВР методом электронно-ионного баланса. Пример 1. Реакция растворения меди в разбавленной азотной кислоте. Записываем схему реакции, зная, что азотная кислота— разбавленная, следовательно продуктом ее восстановления будет NO, а медь — восстановитель, и она превратится в соль, в данном случае нитрат меди (2): Cu + HNO3→ Cu(NO3)2 +NO +H2O
Cu – 2e- → Cu2+ 3 NO3– + 4H+ +3e-→ NO + 2H2O 2 Записываем суммарное ионно-молекулярное уравнение после умножения на коэффициенты: 3Cu + 2NO3– + 8H+ → 3Cu2+ +2NO + 4H2O Как видно из полученного уравнения, числа ионов Н+ и ионов NO3– не совпадают. Это означает, что из необходимых для реакции восьми молекул азотной кислоты только две восстанавливаются до оксида азота, а остальные шесть — связывают (условно, так как соль — сильный электролит и молекул соли в растворе нет) катионы меди в соль. Остается расставить коэффициенты в молекулярном уравнении. 3Cu + 8HNO3→ 3Cu(NO3)2 +2NO +4H2O Пример 2. Взаимодействие перманганата калия с нитритом калия в сернокислотной среде: KMnO4 + KNO2 +H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O В данной реакции перманганат калия – окислитель, в кислотной среде он будет восстанавливаться до иона Mn2+. Нитрит натрия — вещество, могущее быть и окислителем, и восстановителем. В данном случае оно будет восстановителем, так как предполагается контакт с сильным окислителем. Продукт его окисления — ион NO3–. Так как средой реакции служит разбавленная серная кислота, то образующиеся катионы марганца и калия будут связываться в сульфаты (условно). Составляем уравнения процесса восстановления иона-окислителя MnO4– и окисления иона-восстановителя NO2–. Полуреакции: MnO4–+ 8H+ → Mn2+ + 4Н2О (1) NO2– + H2O → NO3– + 2H+ (2) Удовлетворяем закон нейтральности ― суммарное число зарядов продуктов реакции должно быть равно суммарному числу зарядов исходных веществ.В уравнении (1) сумма зарядов продуктов реакции равна 2+; такому же количеству должна быть равна сумма зарядов исходных веществ. Это будет в том случае, если в уравнение (1) слева прибавить 5 электронов. По той же причине в уравнении (2) следует вычесть 2 электрона: MnO4– + 8H+ +5e- → Mn2+ +4 Н2О (1)’ NO2– + H2O – 2e- → NO3– + 2H+ (2)’’ Далее следует учесть, что число электронов, принятых окислителем, должно быть равно числу электронов, отданных восстановителем. Для этой цели левую и правую части уравнения (1)’умножим на 2, а левую и правую часть уравнения (2)’’ на 5:
NO2– + H2O –2e-→ NO3– + 2H+ 5 После умножения уравнений на соответствующие коэффициенты получим: 2MnO4–+ 16H+ +10e-→ 2Mn2+ +8Н2О 5NO2– + 5H2O –10e-→ 5NO3– + 10H+ Суммарное ионно-молекулярное уравнение: 2MnO4– + 16H+ +5NO2– +5H2O →5NO3– + 10H+ +2Mn2+ +8 Н2О В обеих частях уравнения присутствуют и протоны, и молекулы воды. После сокращения подобных, получаем: 2MnO4– + 6H+ +5NO2– →5NO3– + 2Mn2+ +3Н2О Расставляем коэффициенты в молекулярном уравнении: 2KMnO4 + 5KNO2 +3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O Упражнения для самостоятельного решения 1. Определите степень окисления хрома в следующих соединениях: Сг2О3,К2Сг2О7,Сг2(SO4)3,Fe(CrO2)2. 2. Укажите, какие из приведенных процессов представляют собой окисление и какие — восстановление: а)S→ SO42-; б)Br2 → 2Br -; в)V2+→ V03–; г)Cl–→ ClO3–. 3. Укажите, какиеиз следующих реакций относятся к окислительно-восстановительным: а) NH4Cl= NH3 + HCl; б) 2K2CrO4+ H2SO4 = К2Сг2O7+ К2S04+ Н2О; в) Fe + S = FeS; г) H2 + Cl2 = 2 HCl. 4. Укажите, в каких из следующих реакций азот является окислителем, в каких— восстановителем: а) N2+O2= …; б) N2 + Li =…; в) N2+Mg = … г) N2 + H2= … 5. Составьте уравнения полуреакций: а) MпО4–→ Mnz+ (рН<7); б)Cr02– → СгО42– (рН>7); в)SO32–→ SO42– (рН=7). 6. Закончите уравнения.реакций: а) HClO3 →ClO2 + HClO4 + Н20; б) NH4NO3 →N2О + H20; в) KI+ K2Cr207+ H2.SO4 →.I2 +...; г) Al + HNO3 →NH4NO3 +... 7. По приведенным ниже полуреакциям составьте уравнения окислительно-восстановительных реакций в молекулярном виде: a) 10 Fe2+ → 10Fe3+ + 10e 2МпО4– + 16Н+ + 10е →2Mn2+ + 8Н2О б) 3Mg° → ЗMg2+ +6e SO4 2– + 8Н+ + 6е → S0 + 4Н2О 8. Напишите следующие окислительно-восстановительные реакции: а) Na2S + К2 Сг2 О7 + Н2S04 →…; б) Н202 + KI →…; в) РН3.+ KMnO4 + HCl → ….; г) NaClO + CrCL3 + NaOH →... 9. В 1 л раствора содержится 10г HCl04.Вычислите нормальность HClO4, исходя из реакции: SO2 + HClO4 + Н20 → HCl + Н2SO4 Ответ: c(1/8HClO4) = 0,8 моль/л. 10. Какой обьём 0,1Н К2Сг207 потребуется для окисления 20мл 0,02М Na2SО3 в кислой среде? Ответ: 8мл.
ХИМИЧЕСКАЯ СВЯЗЬ Химическая связь – это совокупность сил между атомами, образующая устойчивые системы: молекулы, ионы, радикалы. Основные типы химической связи: ковалентная, ионная, водородная и металлическая. Нет единой теории описывающей все молекулы. Отнесение химической связи к одному из этих типов – не является простой задачей. В большинстве соединений имеет место наложение разных типов связи. Учение о химической связи составляет основу теоретической химии. Квантовая механика дала решение вопроса о природе химической связи. Гейтлер и Лондон нашли приближённое решение уравнения Шредингера для молекулы Н2, подойдя к ней как к системе, состoящей из двух атомов водорода. Они исходили из предположения, что при образовании молекулы из атомов атомы сохраняют свою электронную конфигурацию, а силы связывания между атомами обусловлены обменом электронов между ними в результате спаривания спинов двух электронов, находящихся на атомных орбиталях. Гейтлер и Лондон показали: а) уравнение Шредингера справедливо не только для атома, но и для молекулы; б) химическая связь имеет электрическую природу, так как в уравнении Шредингера в качестве потенциальной энергии рассматривалась только энергия электростатического взаимодействия ядер и электронов, а результаты опытов удовлетворительно согласуются с расчётом; Результаты расчёта энергии электронов в молекуле Н2 представлены на рис.2.
Рис.2 Зависимость потенциальной энергии Е системы из двух атомов водорода от межъядерного расстояния r: 1– при образовании химической связи; 2 – без её образования.
Расчёт Гейтлера и Лондона показал, что если электроны атомов водорода обладают противоположно направленными спинами, то при сближении атомов происходит значительное уменьшение энергии (кривая1) —возникает химическая связь. Образование химической связи обусловлено тем, что при наличии у электронов антипараллельных спинов становится возможным передвижение электронов около обоих ядер, что приводит к значительному увеличению плотности электронного облака в пространстве между ядрами, которое удерживает вместе положительно заряженные ядра, поскольку пребывание двух электронов в поле двух ядер энергетически выгоднее нахождения каждого из них в поле одного ядра. Притяжение уменьшает потенциальную энергию системы — возникает химическая связь. На рис.2 показана энергетическая кривая, характерная для взаимодействующих атомов водорода. Сближение атомов сопровождается выделением энергии, которое будет тем больше, чем больше перекроются электронные облака. Однако в обычных условиях, вследствие кулоновского отталкивания, невозможно достичь слияния ядер двух атомов. Значит, на каком-то расстоянии вместо притяжения атомов, будет происходить их отталкивание. Таким образом, расстояние между атомами r0, которому отвечает минимум на энергетической кривой, будет соответствовать длине химической связи (кривая 1). Если же спины электронов у взаимодействующих атомов водорода одинаковы, то будет происходить их отталкивание (кривая 2). Энергия связи для различных атомов изменяется в пределах 170–420 кДж/моль. Причина образования химической связи – понижение полной энергии системы. При разработке теории строения молекул в начале 30-х годов возникли и развивались два метода — метод валентных связей МВС (Гейтлер и Лондон, Полинг, Слейтер и др.) и метод молекулярных орбиталей ММО(Малликен, Гунд,Хюккель и др). При расчётах с большой точностью оба метода дают практически одинаковые результаты, но в более простом приближении каждый из них имеет какие то преимущества в описании одних явлений и недостатками при описании других. В методе валентных связей МВС каждую молекулу рассматривают составленной из атомов, а для объяснения электронного строения молекулы применяются атомные орбитали составляющих её атомов. В методе молекулярных орбиталей ММО молекулу рассматривают как самостоятельное целое, а не простую совокупность атомов. Метод валентных связей МВС можно использовать и для расчёта многоатомных молекул, но такие расчёты не получили широкого распространения. В последнее время развивается новый подход, который синтезирует идеи двух методов (МВС и ММО)— обобщённый метод валентных связей.
Ковалентная связь
Метод валентных связей
Основные положения метода: 1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам (теория локализованных пар). 2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. 3. При образовании молекулы электронная структура составляющих её атомов в основном сохраняется, а все химические связи в молекуле могут быть представлены набором фиксированных (локализованных) двух центровых двухэлектронных связей (не для всех соединений). 4. Число связей, образуемых данным атомом с другими атомами (валентность). равна числу неспаренных электронов внешней электронной оболочки в основном или возбуждённом состоянии. 5. Геометрия молекулы определяется ортогональностью атомных орбиталей центрального атома, участвующего в образовании связи. 6. Аддитивность энергии связи и других свойств является следствием локализации пары электронов между двумя атомами, образующими связь: молекула рассматривается как сумма отдельных связей. В целом, электронная структура молекулы выглядит как набор различных валентных схем (метод локализованных пар). 7. Валентно-насыщенные молекулы могут образовать между собой химические соединения за счёт донорно-акцепторного взаимодействия. Ковалентная связь образуется за счет перекрывания электронных облаков связываемых атомов. Существуют разные способы перекрывания этих электронных облаков. Если д ва атома обобществляют две или три электронные пары, то образуется кратная связь. При образовании кратных связей электронные облака могут перекрываться разными способами. 1. Прямое перекрывание: В этом случае единственная область перекрывания электронных облаков лежит на прямой, соединяющей ядра атомов. Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. В зависимости от вида перекрывающихся облаков могут образоваться s-s, s-p, p-p, s-d, p-d σ-связи (рис.3). σ-связь σ-связь σ -связь Рис.3 Образование σ-связи Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи. Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы. При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи, образуются π-связи. 2. Боковое перекрывание: перекрывание атомных орбиталей происходит по обе стороны от межъядерной оси – образуется π–связь. Варианты образования π–связи: p-p, p-d, d-d (рис.4).
π –связь π –связь δ-связь Рис.4 Образование –π и –δ связей π-Связь –ковалентная связь между атомами, образованная при боковом перекрывании их электронных облаков. В этом случае две области перекрывания электронных облаков находятся по разные стороны от плоскости, в которой лежат ядра связываемых атомов. Как и в случае σ-связи, в зависимости от вида перекрывающихся облаков могут образоваться различные разновидности π-связи: p-p, p-d, d-d π-связи. π –Связь никогда не образуется, если нет σ–связи. π-Связи могут быть лишь в молекулах с кратными связями— двойными, тройными, четверными. В результате этого между атомами возникают кратные связи: Одинарная (σ) (F−F); двойная (σ +π)(O=O); тройная (σ + π + π) (N≡N). С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи. Помимо σ- и π-связей, возможно образование еще одного вида связи – δ -связи (рис.3). Обычно такая связь образуется после образования атомами σ- и π-связей при наличии у атомов d- и f-орбиталей путем перекрывания их "лепестков" сразу в четырех местах.В результате кратность связи может возрасти до 4-5. Например, в диамагнитном ионе [Mo2Cl8]4- между атомами молибдена образуются четыре связи. Если принять, что ось z проходит через атомы Мо, то возникновение связи можно объяснить следующим образом: σ -связь образуется перекрыванием dz2-орбиталей, две π - связи взаимодействием dxz и dyz - орбиталей и δ-связь— перекрыванием dxy-орбиталей:
Механизмы образования химической связи
Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. В молекулах Н2, Li2, F2 и Cl2 связи образуются за счет неспаренных s- и р-электронов этих атомов. В молекулах HF и HCl связи образуются s-электронами водорода и p-электронами галогенов. Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов. Из квантовых ячеек N и Н
можно видеть, что атом азота имеет 3 неспаренных электрона, а атом водорода – один. Принцип насыщаемости указывает на то, что устойчивым соединением должен быть NH3, а не NH2, NH или NH4. Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома (донор) и свободной орбитали другого(акцептор). Примером образования химической связи по донорно-акцепторному механизму является реакция аммиака с ионом водорода: H+ + ׃NH3 = NH4+ Роль акцептора электронной пары играет пустая орбиталь иона водорода. В ионе аммония NH4+ атом азота четырехвалентен. В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой. Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 2151; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.72.210 (0.011 с.) |

 Составим уравнения полуреакций:
Составим уравнения полуреакций: Составляем уравнения полуреакций
Составляем уравнения полуреакций MnO4– + 8H+ +5e-→ Mn2+ +4 Н2О 2
MnO4– + 8H+ +5e-→ Mn2+ +4 Н2О 2