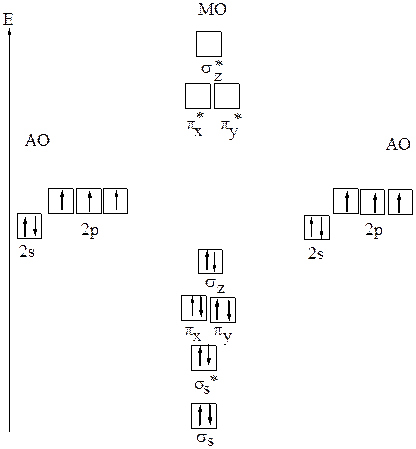Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетические диаграммы двухатомных частиц, образованных элементами второго периодаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
У атомов элементов второго периода кроме 1s-орбиталей в образовании молекулярных орбиталей принимают участие 2s-, 2рx-,2рy-,2рz-орбитали. Заполненные орбитали 1s и 2s не принимают участия в образовании химической связи, так как число электронов на связывающих и разрыхляющих МО одинаково. При комбинациях атомных 2s-орбиталей образуются две молекулярные орбитали: связывающая σs и разрыхляющая σs*. Если принять, что атомы расположены по оси z, то комбинация атомных 2pz- орбиталей даёт молекулярные орбитали σz и σz*, а комбинация двух 2px-орбиталей – молекулярные орбитали πx и πx*,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. Так как энергия 2рx- и 2рy - орбиталей одинакова, и они перекрываются одинаковым способом, то равны энергии соответствующих молекулярных орбиталей: Е(πx) = Е(πy) и Е (πx*) = Е(πy*). При равенстве энергий орбитали πx и πy различаются ориентацией в пространстве. Порядок заполнения молекулярных орбиталей для элементов начала второго периода вплоть до азота следующий: σs < σs* < πx = πy < σz < πx* = πy* < σz*, а для элементов второго периода (N–Ne): σs < σs < σz < πx = πy < πx* =πy* < σz*. Этот порядок был установлен на основании изучения молекулярных спектров. Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляются формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначаются греческими буквами s, p, d,,j. Например молекула B2: σ1s2σ2s*2σ2s2σ2s*2 πx1πy1 а) Образование молекулярных орбиталей в молекуле азота N2
Рис.18 Молекулярные орбитали N2 (без учёта атомных орбиталей 1s) При комбинация атомных 2s-орбиталей атомов азота образуются две молекулярные орбитали: связывающая σs и разрыхляющая σs*. Если принять, что атомы расположены по оси z, то комбинация атомных 2pz- орбиталей атомов азота даёт молекулярные орбитали σz и σz*, а комбинация двух 2px-орбиталей – молекулярные орбитали πx и πx*,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. Так как энергия 2рx- и 2рy - орбиталей одинакова, и они перекрываются одинаковым способом, то равны энергии соответствующих молекулярных орбиталей: Е(πx) = Е(πy) и Е (πx*) = Е(πy*). При равенстве энергий орбитали πx и πy различаются ориентацией в пространстве. Электронная конфигурация молекулы N2 — σs2σs*2πx2πy2σz2 . Порядок (кратность) связи равен 6/2 =3.В молекуле азота N2 одна σ-связь и две π-связи. Энергия диссоциации равна 941кДж/моль). Молекула диамагнитна. Структурная формула молекулы N ≡ N. б) Образование молекулярных орбиталей в ионе N2+
Рис.19 Молекулярные орбитали иона N2+ Электронная конфигурация иона N2+ — σs2σs*2πx2πy2σz1 . Порядок связи равен 5/2 =2,5. В молекулярном ионе азота N2+ одна σ-связь и две π–связи. Потеря электрона со связывающей орбитали сопровождается понижением кратности связи, молекулярный ион N2+ должны быть менее устойчивым. Энергия диссоциации иона меньше, чем у молекулы 843 кДж/моль (у N2 соответственно 941кДж/моль). Ион парамагнитен, так как имеется неспаренный электрон. в) Образование молекулярных орбиталей в молекуле кислорода На рис.20 показана энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО парамагнитные свойства молекулы O2 Заполненные орбитали 1s и 2s не принимают участия в образовании химической связи, так как число электронов на связывающих и разрыхляющих МО одинаково. Комбинация атомных 2pz- орбиталей даёт молекулярные орбитали σz и σz*, а комбинация двух 2px-орбиталей – молекулярные орбитали πx и πx*,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. 8 электронов двух атомов кислорода заселяют молекулярные орбитали по принципу наименьшей энергии, правилу Хунда, принципу Паули. В соответствии с правилом Хунда на разрыхляющих орбиталях πx* и πy* находятся два электрона по одному на каждую орбиталь. Порядок связи в молекуле кислорода равен 2.
Рис.20 Энергетическая диаграмма,иллюстрирующая с помощью метода МО ЛКАО парамагнитные свойства молекулы O2 Энергии молекулярных орбиталей могут быть определены по данным спектров поглощения веществ в ультрафиолетовой области. Так, среди молекулярных орбиталей молекулы кислорода, образовавшихся в результате перекрывания p -АО, две π-связывающие с одинаковой энергией орбитали πx и πy обладают меньшей энергией, чем σ-связывающая, впрочем, как и π*-разрыхляющие орбитали обладают меньшей энергией в сравнении с σ*-разрыхляющей орбиталью.В молекуле O2 два электрона с параллельными спинами оказались на двух с одинаковой энергией разрыхляющих молекулярных орбиталях πx* и πy* (рис.20).Наличием неспаренных электронов и обусловлены парамагнитные свойства молекулы кислорода, которые станут заметными, если охладить кислород до жидкого состояния.
г) Образование молекулярныхз орбиталей в ионе О2+
Рис.21 Молекулярные орбитали в ионе О2+ Потеря электрона с разрыхляющей орбитали сопровождается повышением кратности связи, молекулярный ион О2+ должен быть более устойчивым. Энергия диссоциации иона больше, чем у молекулы 642 кДж/моль (у О2 соответственно 494кДж/моль). Ион парамагнитен, так как имеется неспаренный электрон. д) Образование молекулярных орбиталей в молекуле СО (рис.22) При комбинация атомных 2s-орбиталей атомов углерода и кислорода образуются две молекулярные орбитали: связывающая σs и разрыхляющая σs*. Комбинация атомных 2pz- орбиталей атомов углерода и кислорода даёт молекулярные орбитали σz и σz*, а комбинация двух 2px-орбиталей – молекулярные орбитали πx и πx*,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. Электронная конфигурация молекулы СО — σs2σs*2πx2πy2σz2 . Порядок (кратность)связи как и в молекуле азота равен 6/2 =3.В молекуле СО как и в молекуле азота одна σ-связь и две π–связи. Это объясняет значительное сходство в свойствах свободного азота и оксида углерода, например, близки энергии диссоциации: 1076кДж/моль(СО) и 941кДж/моль(N2); межъядерные расстояния– 0,113нм(CO) и 0,110нм(N2);температуры плавления –68К(СО) и 63К(N2), температуры кипения–82К(CO) и 77К(N2). Молекулы диамагнитны. Структурная формула молекулы C ≡ O.
Рис.22 Молекулярные орбитали в СО Образование молекул из атомов элементов II периода может быть записано следующим образом (К – внутренний электронный слой): Li 2 [K(σs)2] Be2 [K(σs)2(σs*)2] молекула не обнаружена, как и молекула Не2 B2 [K(σs)2(σs*)2 (πx)1(πy)1] молекула парамагнитна C2 [K(σs)2(σs*)2(πx)2(πy)2] N2 [K(σs)2(σs*)2(πx)2(πy)2(σz)2 ] O2 [K(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)1(πy)1 ] молекула парамагнитна F2 [K(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)2(πy)2 ] Ne2 [KK(σs)2(σs*)2(σz)2 (πx)2(πy)2(πx)2(πy)2(σz*)2 ] молекула не обнаружена
Многоатомные молекулы
К многоатомным молекулам применимы те же принципы, что и к двухатомным, однако с увеличением числа атомов в молекуле увеличивается число комбинируемых атомных орбиталей, различающихся как по форме, так и по энергии. Не участвуют в образовании связей электроны, находящиеся на завершенных энергетических уровнях(однако на их долю приходится большой запас энергии), часть валентных электронов, находящихся на несвязывающих молекулярных орбиталях. В многоатомной молекуле наряду с нелокализованными молекулярными орбиталями, охватыващими несколько ядер могут быть и локализованные, охватывающие только два ядра. Таким образом, молекула представляет сложную систему, и поэтому необходимо учитывать большое число факторов, влияющих на полную молекулярную волновую функцию. Для некоторого упрощения принято для многоатомных молекул молекулярную орбиталь рассматривать как состоящую из орбитали центрального атома и так называемой групповой орбитали. Групповая орбиталь представляет собой результат комбинации орбиталей периферических атомов (лигандов).
Рис.23 Молекулярные орбитали в Н2О Рассмотрим трёхатомную молекулу Н2О. Она имеет угловую форму. Роль центрального играет атом кислорода, а атомы водорода—роль лигандов. Молекулярные орбитали Н2О образуются за счёт 2s- и 2p- орбиталей кислорода и 1s-орбиталей двух атомов водорода. Перекрывание 2pz- орбиталей атома кислорода и 1s-орбиталей двух атомов водорода приводит к образованию молекулярных орбиталей: связывающей σz и разрыхляющей σz*.Перекрывание 2s- и 2px- орбиталей приводит к образованию связывающей σs и разрыхляющей σs* орбиталей. Орбиталь 2py не перекрывается и в молекуле Н2О играет роль несвязывающей. Таким образом, комбинация четырёх атомных орбиталей кислорода и двух орбиталей атомов водорода приводит к образованию двух связывающих(σs и σz), двух несвязывающих(σxо и πyо) и двух разрыхляющих(σs* и σz*) молекулярных орбиталей (рис.23).
(Метод молекулярных орбиталей применительно к комплексным соединениям см главу Комплексные соединения) Свойства ковалентной связи Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Насыщаемость Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Валентность — свойство атома данного элемента присоединять или замещать определённое число атомов другого элемента. Мерой валентности является число ковалентных связей, которые образует атом. При этом учитывают связи, образованные как по обменному механизму, так и по донорно-акцепторному. При образовании химической связи по обменному механизму каждый из взаимодействующих атомов по одному неспаренному электрону для образования связывающей электронной пары. Так образуется, например, молекула водорода: Н∙ + ∙Н = Н׃Н При определении числа химических связей, которые атом элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбуждённое состояние число его неспаренных электронов может увеличится в результате разделения некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, не очень велика, то она может компенсироваться энергией образующейся химической связи, и возбуждённое состояние стабилизируется. Это возможно при переходе электронов на более высокие подуровни внутри одного и того же энергетического уровня. Валентности атомов:Li(1s22s12p0),N(1s22s22px12py12pz1),O(1s22s22px2py1pz1), F(1s22s2p5),Ne(1s22s22p6) равны числу неспаренных электронов в основном состоянии, так как разделение любой из электронных пар в этих атомах возможно только при переходе электронов на новый, более высокий энергетический уровень. Таким образом, валентность лития равна 1, азота 3, кислорода 2, фтора 1, неона 0. В атомах бериллия, бора, углерода может происходить разделение электронных пар за счёт перехода электронов с 2s- подуровня на 2p-подуровень, так как в атомах этих элементов на 2p- подуровне имеются вакантные орбитали. Поэтому валентности 2,3 и 4, присущие атомам Ве,В,С в возбуждённом состоянии, более характерны для них, чем валентности, определяемые числом неспаренных электронов в основном состоянии. Число химических связей, которые атом образует по донорно-акцепторному механизму, зависит от числа имеющихся на его валентных подуровнях несвязывающих электронных пар или вакантных орбиталей. Например, атом азота может образовывать четыре химические связи: три– за счёт трёх неспаренных электронов и ещё одну – за счёт электронной пары. Направленность связи Преимущественно ковалентные связи являются направленными. Направленность связей характеризуется углами между связями (валентными углами).Любые ковалентные соединения имеют строго определённые углы между связями. Различные экспериментальные методы нахождения валентных углов дают очень близкие значения. Углы между преимущественно ковалентными связями и длины связей определяют строение многоатомных молекул и ионов их структуру. Длина и энергия связи Энергия связи — это энергия, которая выделяется при образовании молекулы из атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это одна из важнейших характеристик химической связи. Более устойчива та система, которая содержит меньше энергии. Известно, например, что атомы водорода стремятся объединиться в молекулу. Это означает, что система, состоящая из молекул Н2 содержит меньше энергии, чем система, состоящая из такого же числа атомов Н, но не объединенных в молекулы. Для двухатомных молекул энергия связи равна энергии диссоциации. Для многоатомных молекул с одним типом связи средняя энергия связи равна 1/n части распада молекулы на атомы. Энергия распада метана на атомы равна 1649 кДж/моль. В молекуле метана имеются четыре равноценные связи С-Н поэтому средняя энергия такой связи равна Ес-н = 1649/4 = 412 кДж/моль. Длина связи Длина химической связи — среднее расстояние между ядрами атомов, образующих химическую связь. В ряду однотипных молекул длины связей изменяются закономерно. Например, в ряду HF, HCl, HBr, HI длина связи увеличивается с возрастанием размера атома и соответственно равна(в пм): 91; 127; 141; 161. Энергия связи(Е кДж/моль) в этом ряду закономерно уменьшается: 565,7; 427,8; 362,5; 294,5. На длину связи влияет её кратность. Повышение кратности связи приводит к упрочнению межатомной связи и уменьшению длины связи. Так, длина связи в молекуле фтора (F–F) равна 141 пм,а энергия связи 159,0 кДж/моль; длина связи в молекуле азота с тройной связью (N≡N) равна 110пм, а энергия связи 941,6 кДж/моль (см. табл.2 Приложения). Полярность связи Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. Между разными атомами чистая ковалентная связь может проявляться, если электроотрицательность (ЭО) атомов одинакова. Такие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому их называют неполярными (например, двухатомные молекулыH2, Cl2, N2).Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с большей ЭО. Смещение электронного облака называется поляризацией. В результате односторонней поляризации центры тяжести положительных и отрицательных зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое расстояние l. Такие молекулы называются полярными или диполями, а связь между атомами в них называется полярной. Например, в молекуле HCl связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Таким образом, атом водорода в хлороводороде поляризован положительно, а атом хлора отрицательно.На атоме водорода возникает положительный заряд δ= +0,18, а атоме хлора — отрицательный δ= – 018. Следовательно, связь в молекуле хлороводорода имеет на 18% ионный характер. Полярная связь — разновидность ковалентной связи, претерпевшей незначительную одностороннюю поляризацию. Расстояние между «центрами тяжести» положительных и отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше поляризация, тем больше длина диполя и больше полярность молекул. Для оценки полярности молекул обычно пользуются постоянным дипольным моментом µ, представляющим собой произведение величины элементарного электрического заряда q на длину диполя (l), т.е. µ = q∙l. Дипольные моменты измеряют в кулонометрах (см. табл. 3 Приложения). Суммарный дипольный момент сложной молекулы можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному. Результат сложеиия зависит от структуры молекулы. Дипольный моиент высокосимметричных молекул BeCl2, BF3, CCl4 равен нулю, хотя связи Be – Cl, B– F, C–Cl имеют сильно полярный характер. В угловой молекуле Н2О полярные связи О–Н расположены под углом 104,5о. Поэтому молекула оказывается полярной (µ = 0,61∙10-29 Кл∙м). При очень большой разности электроотрицательности у атомов имеет место явная односторонняя поляризация: электронное облако связи максимально смещается в сторону атома с наибольшей электроотрицательностью, атомы переходят в противоположно заряженные ионы, и возникает ионная молекула. Ковалентная связь становится ионной. Электроасимметрия молекул возрастает, длина диполя увеличивается, дипольный момент возрастает. Предсказать полярность связи можно с помощью относительной ЭО атомов. Чем больше разность относительных ЭО атомов, тем сильнее выражена полярность. Правильнее говорить о степени ионности связи, поскольку связи не бывают ионными на 100%. Даже в соединении CsF связь ионная только на 89%. Если рассматривать соединения элементов какого-либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи сменяется на ковалентный. Например, у фторидов 2-го периода LiF, BeF2, CF4, NF3, OF2, F2 степень ионности связи от фторида лития постепенно ослабевает и заменяется типично ковалентной связью в молекуле фтора. Электроотрицательность серы значительно меньше, чем ЭО кислорода. Поэтому полярность связи H –S в H2S меньше полярности связи Н–О в Н2О, а длина связи H–S (135 пм) больше, чем Н–О (96 пм) и угол между связями приближается к прямому. Для H2S он составляет 92о, а для H2Se – 91o. По этим же причинам молекула аммиака имеет пирамидальное строение и угол между валентными связями H–N–H больше прямого (107,3о). При переходе от NH3 к PH3, AsH3 и SbH3 углы между связями составляют соответственно 93,3о; 91,8о и 91,3о. Ионная связь Предельным случаем ковалентной полярной связи является ионная связь. При очень большом различии в электроотрицательности атомов(см. табл. 1 Приложения) при их сближении валентные электроны одного атома полностью переходят на второй атом. В результате оба атома становятся ионами. Например, при взаимодействии атомов натрия и хлора они превращаются в ионы Na+ и Cl-,между которыми возникает электростатическое притяжение. Легче всего образуют катионы элементы с малой энергией ионизации ―щелочные и щелочно-земельные металлы. Простые анионы легче всего образуют р-элементы VII группы вследствие их высокого сродства к электрону. онные молекулы существуют только в парах над нагретыми солями. Энергия разрыва ионной связи не определяется энергией притяжения ионов. Е ионизации Cs = 3,86 эВ > Е сродства к электрону Cl = 3,83 эВ. Таким образом, даже такая «предельно ионная» молекула CsCl фактически не является ионной на 100%. Отклонения от чисто ионной связи можно рассматривать как результат электростатического воздействия ионов друг на друга, считая их деформируемыми системами, при этом не учитывающих изменение кинетической энергии электронов и их волновые свойства.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 4232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.247.221 (0.008 с.) |