
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионные равновесия в растворах амфотерныхСодержание книги
Поиск на нашем сайте Электролитов Амфотерные электролиты являются слабыми электролитами. Способность амфотерных электролитов практически полностью реагировать как с кислотами, так и со щелочами, образуя и в том, и в другом случае соли, связана с двойственным характером ихдиссоциации. В растворах амфотерных электролитов устанавливается сложное гетерогенное равновесие между осадком и раствором. Например, диссоциацию амфотерного электролита – гидроксида алюминия можно выразить схемой:
Если к раствору гидроксида алюминия добавлять кислоту(увеличивать концентрацию катионов водорода Н+), равновесие будет смещаться в сторону диссоциации по основному типу. Гидроксид алюминия будет вести себя как основание. Этот процесс может быть выражен уравнением Al(OH)3 + 3HCl = AlCl3 + 3H2O. Ионно-молекулярные уравнения: Al(OH)3 + 3H++ 3Cl- = Al3++ 3Cl-+ 3H2O; Al(OH)3 + 3H+ = Al3++ 3H2O. Если к раствору Al(OH)3 добавлять щелочь, то увеличивается концентрация гидроксид-ионов (ОН-) и равновесие диссоциации гидроксида алюминия будет смещаться в сторону диссоциации по кислотному типу. Гидроксид алюминия будет вести себя как кислота: Al(OH)3 + NaOH = NaAlO2 + 2H2O; Al(OH)3 + Na++ OH- = Na++ AlO2-+ 2H2O; Al(OH)3 + OН- = AlO2- + 2H2O. В щелочных растворах алюминий находится в виде иона [Al(OH)4]-, ион AlO2- обнаружен только в растворах с рН>13, поэтому последнюю реакцию можно записать в следующем виде: Al(OH)3 + NaOH = Na[Al(OH)4]; Al(OH)3 + Na++ OH-= Na+ + [Al(OH)4]-; Al(OH)3 + OH-= [Al(OH)4]-. Таким образом, проявление амфотерными электролитами двойственных свойств кислоты и основания объясняется смещением равновесия при введении в раствор одноименных ионов. Ионное равновесие в гетерогенных системах. Произведение растворимости В насыщенных растворах малорастворимых солей (все соли являются сильными электролитами), кристаллы которых построены из ионов, устанавливается равновесие между гидратированными ионами в растворе и ионами в кристаллах (твердая фаза). Насыщенный раствор получается тогда, когда дальнейшее растворение данного вещества в растворе прекращается. В насыщенном растворе концентрация этого вещества максимальна при данных условиях. Концентрация вещества в его насыщенном растворе называется его растворимостью Ср. Растворимость выражается в моль/л или г/л. Так, в насыщенном растворе электролита AnBm, находящегося в равновесии с его твердой фазой, устанавливается следующее равновесие:
Поскольку в растворах сильных электролитов состояние ионов определяется их активностями, то константа равновесия этого процесса выразится следующим уравнением:
Прямой и обратный процессы являются гетерогенными, так как протекают на поверхности осадка. Знаменатель этой дроби, т.е. активность твердого вещества, есть величина постоянная, поэтому произведение К . а АnBm тоже величина постоянная при данной температуре. Отсюда следует, что произведение активностей ионов тоже представляет собой постоянную величину, называемую произведением растворимости (ПР):
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 1858; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |


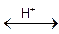
 AnBm(тв)
AnBm(тв)





