
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Смещение равновесий в ионных реакциях.Содержание книги
Поиск на нашем сайте Направление ионных реакций Реакции в растворах электролитов протекают между ионами и идут в сторону образования газообразных или малорастворимых веществ (см. прил., табл. 6), или слабых электролитов. Например, при добавлении щелочи в раствор хлорида меди образуется осадок Cu(OH)2: CuCl2 + 2NaOH = Cu(OH)2¯+ 2NaCl, Cu2+ + 2Cl-+ 2Na++ 2OH-= Cu(OH)2¯ + 2Na++ 2Cl-. (полное ионно-молекулярное уравнение) Равновесие сдвигается вправо из-за образования осадка Cu(OH)2. Сокращенное ионное уравнение отражает сущность ионной реакции: Cu 2+ + 2OH- = Cu(OH)2¯. Пример реакции, которая протекает в сторону образования одновременно газообразного продукта CO2 и мало диссоциирующего вещества Н2О: K2CO3 + 2HCl = 2KCl + H2O + CO2; 2K++ CO32-+ 2H++ 2Cl- = 2K++ 2Cl-+ H2O + CO2; CO32-+ 2H+ = H2O + CO2. Пример ионной реакции, протекающей в сторону образования мало диссоциирующего электролита, например H2O: 2NaOH + H2SO4 = Na2SO4 + 2H2O; 2Na++ 2OH-+ 2H++ SO42-= 2Na+ + SO42-+ 2H2O; H+ + OH- = H2O. В ионных или ионно-молекулярных уравнениях реакций с участием электролитов сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества, записывают в виде молекул. Суммы электрических зарядов в левой и правой частях ионно-молекулярных уравнений должны быть равны. Ионное произведение воды Вода является очень слабым электролитом, диссоциирующим по уравнению Н2О «Н++ ОН-. Константа диссоциации воды при 22°С равна: K д = Доля молекул воды, диссоциированных на ионы, настолько мала, что концентрацию недиссоциированных молекул можно считать постоянной и равной числу молей воды в литре, т.е. [H2O] = Молярная масса воды равна 18 г/моль. Подставив это значение в выражение константы диссоциации, получим [H+] × [OH-] = 1,8 × 10-16×55,56 = 10-14. Эта постоянная величина называется ионным произведением воды (К Н2О); она не зависит от присутствия в воде других ионов (но зависит от температуры). Всякий водный раствор, как и чистая вода, содержит ионы Н+и ОН-и ни в каком случае [H+] или [OH-] не могут быть равны нулю, так как при этом их произведение должно обратиться в нуль. При растворении в воде какой-либо кислоты концентрация катионов водорода [H+] увеличивается, а концентрация [OH-] уменьшается, и наоборот. Величина ионного произведения при этом постоянная [H+] × [OH-] = 10-14. При диссоциации чистой воды [H+] = [OH-] = В кислой среде [H+]>[OH-], [H+]>1∙10-7 моль/л и соответственно [OH-]<1∙10-7 моль/л. Например, при [HCl]=0,1 моль/л рН=1. В щелочной среде [H+]<[OH-], [H+]<1∙10-7 моль/л и соответственно [OH-]>1∙10-7 моль/л. Например, при [KOH]=0,1 моль/л рН=13.
|
||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 388; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.005 с.) |

 = 1,8 × 10-16.
= 1,8 × 10-16.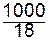 = 55,56 моль / л.
= 55,56 моль / л. =1×10-7моль/л.
=1×10-7моль/л.


