
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет значений рН и рОН в разбавленных растворах сильных и слабых кислот и основанийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Зная концентрацию разбавленных растворов кислот и оснований, можно рассчитывать величины водородного показателя (рН) и гидроксидного показателя (рОН), определяя тем самым активную реакцию среды. 1. В водных растворах сильных кислот (HNO3, HCl, H2SO4 и др.):
или
где С(
В предельно разбавленных водных растворах сильных кислот кажущаяся степень диссоциации
2. В растворах слабых кислот (H2CO3, HCN, СН3СООН и др.):
или
где a - степень диссоциации в долях от единицы;
3. В водных растворах сильных оснований (NaOH, КОН, Са(ОН)2, Sr(OH)2 и др.):
где В предельно разбавленных водных растворах сильных оснований кажущаяся степень диссоциации
4. В растворах слабых оснований (NH3∙H2O):
где Кислотно-основное равновесие биологических жидкостей Кислотно-основные процессы играют большую роль в жизни человека. Так, скорость ферментативных реакций в организме человека, а, следовательно, процессы обмена веществ и физиоло-гические функции в значительной степени зависят от активной кислотности среды. Таким образом, необходимым условием нормального течения жизненных процессов является постоянство рН биологических жидкостей (кислотно-основной гомеостаз). Нару-шение кислотно-основного равновесия (гомеостаза) в организме приводит к изменению рН биологических жидкостей, что, в свою очередь, нарушает нормальное течение процессов обмена веществ. Сдвиг соотношения концентраций ионов H+ и OH- в сторону увеличения активной кислотности (ацидоз) вызывает уменьшение рН(может возникать в результате нарушения выведения кислот, потери организмом значительных количеств оснований, при наличии высокой концентрации СО2 во вдыхаемом воздухе, при поносах, рвоте кишечным содержимым и другим причинам). Сдвиг этого соотношения в сторону уменьшения активной кислотности (алкалоз) вызывает увеличение рН (может развиваться вследствие потери организмом анионов кислот или задержки щелочных катионов; при кишечной непроходимости, при нарушении выведения почками натрия, при поступлении в организм зна-чительных количеств щелочных веществ с пищей или лекар-ственными препаратами, при отравлениях и по другим причинам). Обе формы нарушения кислотно-основного равновесия в организме человека устраняют медикаментозным путем. Таблица 4. Значения pH различных биожидкостей организма.
Эталоны решения задач 1. Концентрация ионов водорода в растворе составляет 10-3 моль/л. Рассчитать значения pH, pOH и [ОН-] в данном растворе. Определить среду раствора. Примечание. Для вычислений используются соотношения: lg10 a = a; 10lg a = а. Решение. 1) 2) 3) Среда раствора с pH = 3 является кислой, так как pH < 7. 2. Вычислить рН раствора соляной кислоты с молярной концентрацией 0,002 моль/л. Решение. Так как в разбавленном растворе НС1 1) 2) 3. К 10 мл раствора уксусной кислоты с C( Решение. 1) В исходном растворе слабой одноосновной кислоты СН3СООН:
Следовательно:
2) Добавление к 10 мл раствора кислоты 90 мл воды соответ-ствует 10-кратному разбавлению раствора. Поэтому:
Таким образом:
4. Найти значение рН раствора гидроксида кальция с молярной концентрацией эквивалента 0,002 моль/л, если Решение. В растворах сильных оснований:
5. рН раствора серной кислоты с молярной концентрацией 0,001 моль/л равен 2,72. Найти Решение. В растворе сильной кислоты:
Кислота двухосновная, следовательно, сначала необходимо определить молярную концентрацию эквивалента H2SO4 в растворе:
Зная величину pH раствора, можно рассчитать [H+]:
Отсюда:
6. Рассчитать рН раствора NaOH, если известно, что в 200 мл этого раствора содержится 0,0004 г NaOH ( Решение. В разбавленном растворе сильного основания:
Рассчитаем C(
7. Вычислить число ионов гидроксида, содержащихся в 5 мл раствора, водородный показатель которого равен 3. Решение. 1) 2) 3) Для вычисления числа ионов используется соотношение, связывающее число структурных единиц (атомов, ионов, молекул) вещества - N(x), количество этих структурных единиц - n(x) и постоянную Авогадро NА, равную 6,02·1023 моль-1:
Отсюда:
8. Рассчитать массу основания С5H5N·Н2О в 150 мл раствора, водородный показатель которого равен 10, если Решение. Массу основания в растворе можно вычислить, зная молярную концентрацию раствора. Так как С5H5N·Н2О - однокислотное основание, то из соотношения 14′: рС(осн) = 2·рОН - Величину рОН найдем из соотношения: рОН = 14 - рН = 14 - 10 = 4. Таким образом: рС(С5H5N·Н2О) = 2·4 - 5,2 = 2,8; С(С5H5N·Н2О) = 10-рС = 10-2,8 = 1,58·10-3 моль/л; m(С5H5N·Н2О) = С(С5H5N·Н2О)·М(С5H5N·Н2О)·Vр-ра = = 1,58·10-3·97·0,15 = 0,023 г. 9. Вычислить молярную концентрацию гидроксида калия в растворе, водородный показатель которого равен 12, если Решение. Гидроксид калия является однокислотным основанием, поэтому согласно соотношениям (8), (10) и (13):
10. Вычислить рН раствора азотной кислоты с C(HNO3) = 0,01 моль/л (расчет вести через активность ионов Н+). Решение.
Для определения коэффициента активности
Величину
Отсюда:
Если принять
Для точных расчетов сотые доли имеют значение. 11. Рассчитать рН раствора, в 100 мл которого находится 0,1 г гидроксида натрия и 0,174 г сульфата калия. Решение. Молярные концентрации электролитов в растворе составляют:
Ионная сила раствора, содержащего ионы Na+, K+, ОН- и SO42-, равна:
Коэффициент активности гидроксид-ионов и их активность соответственно равны:
Из соотношения (3) находим активность ионов водорода:
Таким образом:
12. Найти число недиссоциированных молекул кислоты в 500 мл раствора HF, если Решение. В растворе слабой одноосновной кислоты молярную концентрацию кислоты можно рассчитать по формуле (12):
Общее количество кислоты (n0) в заданном объеме раствора равно:
Количество недиссоциированной кислоты (n) найдем по формуле:
Число недиссоциированных молекул кислоты равно:
Вопросы для самоконтроля 1. Какие ионы образуются при диссоциации воды? Составьте выражение для константы диссоциации воды. 2. Что называется ионным произведением воды? Каково численное значение 3. Чем может быть вызвано изменение величины ионного произведения воды? 4. Изменится ли ионное произведение воды при добавлении к ней кислоты, щелочи или соли? 5. Являются ли концентрации ионов Н+ и ОН- в водных растворах сопряженными величинами? 6. Может ли в водном растворе кислоты (щелочи) концентрация ионов Н+ или ОН- быть равной нулю? 7. Что понимают под терминами кислая, нейтральная, щелочная среда? 8. Что такое активная, потенциальная и общая кислотность в растворах кислот? Что называют активной реакцией среды? 9. Как определяют водородный и гидроксидный показатели? Какова взаимосвязь рН и рОН? 10. Что представляет собой шкала значений рН? Каковы значения рН в нейтральной, кислой и щелочной средах? 11. Имеет ли значение постоянство активной реакции среды в жизнедеятельности человека? Каковы значения рН важнейших биологических жидкостей (кровь, желудочный сок, моча, пот, слюна)? 12. Что такое ацидоз? Что такое алкалоз? 13. Какой вид имеют формулы для расчета активной кислотности в растворах сильных и слабых кислот и оснований? 14. Может ли присутствие NaCl оказать влияние на величину pH раствора соляной кислоты? 15. Могут ли величины рН и рОН принимать отрицательные значения? Варианты задач для самостоятельного решения Вариант №1 1. Определить [Н+] и [ОН-], если рН раствора равен 4. 2. Вычислить гидроксидный показатель желудочного сока, если известно, что 100 мл его содержит 0,365 г соляной кислоты ( 3. Рассчитать массу основания NH3×Н2О в 500 мл раствора, водородный показатель которого равен 10,5, если Вариант №2 1. Вычислить число ионов Н+, находящихся в 25 мл раствора, если рОН = 14. 2. Рассчитать рН раствора гидроксида кальция с C(Са(ОH)2) = 0,02 моль/л, если 3. Найти массу уксусной кислоты в 100 мл раствора, гидроксидный показатель которого равен 10, если Вариант №3 1. Определить рН раствора и [Н+] в растворе, если [ОН-] = 3×10-5 моль/л. Указать характер среды. 2. Вычислить массу гидроксида бария в 250 мл раствора, водородный показатель которого равен 13, если 3. Рассчитать рН раствора бензойной кислоты с молярной концентрацией 0,01 моль/л, если Вариант №4 1. Вычислить рН раствора и [Н+] в растворе, если 40 мл раствора содержат 12,04·1020 ионов гидроксида. Указать характер среды. 2. Рассчитать рОН раствора синильной кислоты с молярной концентрацией эквивалента 0,01 моль/л, если 3. Найти рН раствора, в 200 мл которого растворено 0,63 г азотной кислоты ( Вариант №5 1. Определить [Н+] и [ОН-] в растворе, рОН которого равен 5. 2. Вычислить молярную концентрацию гидроксида натрия в растворе, водородный показатель которого равен 13,5, если 3. Рассчитать величину рН раствора, в 250 мл которого находится 0,46 г муравьиной кислоты, если Вариант №6 1. Рассчитать число ионов ОН-, находящихся в 2 мл раствора, если рН = 10. 2. К 100 мл раствора хлорной кислоты с C(НС1О4) = 0,1 моль/л ( 3. Вычислить массу основания СН3NH2×Н2О в 650 мл раствора, водородный показатель которого равен 11,5, если Вариант №7 1. Вычислить рОН раствора и [ОН-] в растворе, если [Н+] = 5×10-8 моль/л. 2. Рассчитать молярную концентрацию основания С2Н5NH2·H2O в растворе, водородный показатель которого равен 11,7, если 3. Найти рН раствора гидроксида калия, если известно, что 100 мл этого раствора содержит 0,0056 г КОН. ( Вариант №8 1. Определить [Н+] и [ОН-] в растворе, pH которого равен 6. 2. Вычислить рН раствора, в 500 мл которого находится 0,05 г LiOH. Диссоциацию щелочи считать полной. Во сколько раз изменится рН раствора при разбавлении его водой в 10 раз? 3. Найти массу азотистой кислоты, содержащейся в 800 мл раствора, гидроксидный показатель которого равен 11,4, если Вариант №9 1. Определить рОН раствора, если 1250 мл раствора содержат 3,01·1023 ионов водорода. 2. Найти рН раствора фтороводородной кислоты, если в 10 мл этого раствора растворено 0,004 г HF, а 3. Вычислить массу гидроксида стронция в 300 мл раствора, водородный показатель которого равен 12,8, если кажущаяся степень диссоциации гидроксида равна 95%. Вариант №10 1. Вычислить рН раствора и [Н+] в растворе, если [ОН-] = 4×10-4 моль/л. Определить характер среды. 2. Рассчитать массу соляной кислоты, содержащейся в 1,5 мл желудочного сока, водородный показатель которого равен 1,8, если 3. Определить водородный показатель раствора диметиламина с C((СН3)2NH×Н2О) = 0,01 моль/л, если Вариант №11 1. Определить [Н+] и [ОН-], если рН раствора равен 1. 2. Вычислить значение рН раствора гидроксида аммония, в 450 мл которого содержится 0,07 г основания, если 3. К 125 мл раствора серной кислоты с C(Н2SО4) = 0,03 моль/л ( Вариант №12 1. Вычислить число ионов Н+, находящихся в 30 мл раствора, если рОН = 1. 2. Найти рН раствора гидроксида рубидия, если в 120 мл этого раствора содержится 0,204 г RbОН ( 3. Определить массу пропионовой кислоты в 750 мл раствора, гидроксидный показатель которого равен 11,5, если Вариант №13 1. Определить [Н+] и [ОН-] в растворе, рОН которого равен 4. 2. Найти рН раствора, в 400 мл которого растворено 0,256 г иодоводородной кислоты, если 3. Рассчитать массу основания С6Н5NH2×Н2О в 1500 мл раствора, водородный показатель которого равен 9, если Вариант №14 1. Определить рОН раствора и [ОН-], если 4 мл раствора содержат 24,08·1019 ионов водорода. Указать характер среды. 2. Вычислить молярную концентрацию бензойной кислоты в растворе, гидроксидный показатель которого равен 10,6, если 3. Рассчитать рН раствора, содержащего гидроксид калия с С(КОН) = 0,005 моль/л и нитрат натрия с С(NаNO3) = 0,015 моль/л. Вариант №15 1. Вычислить [Н+] и [ОН-] в растворе, рОН которого равен 6,5. 2. Определить массу уксусной кислоты в 350 мл раствора, гидроксидный показатель которого равен 10,4, если 3. К 25 мл раствора гидроксида кальция с C(Сa(OH)2) = 0,015 моль/л ( Вариант №16 1. Определить число ионов ОН-, находящихся в 20 мл биологической жидкости, водородный показатель которой равен 7,35. 2. Рассчитать величину рОН раствора, в 50 мл которого находится 0,027 г бромоводородной кислоты, если 3. Вычислить массу основания СН3NH2×Н2О в 300 мл раствора, водородный показатель которого равен 11, если Вариант №17 1. Вычислить рН раствора и [Н+] в растворе, если [ОН-] = 2×10-4 моль/л. Определить характер среды. 2. Найти рН раствора, в 500 мл которого находится 0,005 моль гидроксида натрия и 0,01 моль хлорида кальция. 3. Рассчитать массу циановодородной кислоты, содержащейся в 400 мл раствора, гидроксидный показатель которого равен 11,4, если Вариант №18 1. Определить соотношение [ОН-] в крови (рН = 7,4) и в спинномозговой жидкости (рН = 7,5). 2. Найти водородный показатель раствора азотной кислоты с C(НNО3) = 10-9 моль/л, если 3. Рассчитать массу основания С2Н5NH2·H2O в 1800 мл раствора, водородный показатель которого равен 11,2, если
Вариант №19 1. Определить рОН раствора, если 190 мл раствора содержат 15,05·1013 ионов водорода. 2. Вычислить рН раствора гидроксида бария, если известно, что 750 мл этого раствора содержит 0,513 г Ва(ОН)2. Во сколько раз изменится рН раствора при разбавлении его водой в 20 раз? В обоих случаях диссоциацию щелочи считать полной. 3. К 10 мл раствора муравьиной кислоты с C(НСООН) = 0,15 моль/л прибавили 40 мл Н2О. Найти рОН раствора до и после разбавления, если Вариант №20 1. Определить гидроксидный показатель раствора гидроксида цезия с C(CsОН) = 10-9 моль/л, если 2. Рассчитать число недиссоциированных молекул слабой одноосновной кислоты в 800 мл раствора, если степень диссоциации кислоты составляет 2,5%, рН раствора равен 3,5, а 3. Вычислить водородный показатель раствора, в 300 мл которого содержится 0,384 г иодоводородной кислоты и 0,284 г сульфата натрия. БЛОК ИНФОРМАЦИИ
ГИДРОЛИЗ Растворение веществ в воде часто сопровождается химическим взаимодействием обменного характера. Разложение веществ, проходящее с обязательным участием воды и протекающее по схеме: AB + H-OH ⇄ AН + BОН называется гидролизом. Гидролизу могут подвергаться самые различные вещества: органические (эфиры, жиры, углеводы и др.), неорганические (соли, карбиды, нитриды и др.), а также высокомолекулярные соединения (белки). Процессы ферментативного гидролиза играют важнейшую роль в пищеварении и тканевом обмене веществ всех живых организмов. Так, высокомолекулярные соединения, гидролизуются до низкомоле-кулярных продуктов (аминокислоты, глюкоза и т. п.), которые затем всасываются из кишечника и переносятся в различные ткани, где подвергаются дальнейшим превращениям. Наибольшее практическое значение имеет гидролиз: а) органических полимеров (белков, полисахаридов и т. п.), обычно протекающий в присутствии биологического катализатора; б) сложных эфиров, в частности, жиров; в) солей. Ниже более подробно будет рассмотрен гидролиз солей, который играет большую роль в регулировании кислотности среды и в поддержании в организме кислотно-основного гомеостаза. Гидролиз солей Практика показывает, что водные растворы многих средних солей (К2СО3, MgCl2, CH3COONa, FeSO4 и др.) имеют неодинаковые значения рН. Причиной этого является гидролиз солей. Гидролизом солей называется обменное взаимодействие ионов соли с водой, приводящее к образованию малодиссоциированных соединений или ионов, что вызывает изменение рН раствора. Процесс гидролиза солей включает в себя две стадии: электро-литическую диссоциацию соли на ионы с последующим переходом протона от молекулы воды к аниону: CO32- + H-OH ⇄ НCO3- + ОН-, либо от гидратированного катиона металла к молекуле воды: Fe3+×nH2O + H-OH ⇄ FeOH2+×(n-1)H2O + Н3O+. Следует отметить, что вторая стадия процесса протекает в заметной степени, если в результате образуются малодис-социированные или малорастворимые соединения. В обоих случаях происходит смещение равновесия диссоциации воды: H2O ⇄ Н+ + ОН-. В результате в растворе увеличивается концентрация ионов Н+ или ОН-, что находит отражение в изменении значения рН раствора. Рассмотрим некоторые частные случаи гидролиза солей. Соли, образованные катионами сильных оснований и анионами сильных кислот (Na2SO4, CaCl2, KI, Sr(NO3)2 и др.), не гидролизуются, так как катионы и анионы этих солей не образуют с водой малодиссоциированных электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (рН = 7). Гидролизу подвергаются три типа солей. 1. Соли, образованные катионами сильного основания и анионами слабой кислоты (CH3COONa, KCN, Ca(OCl)2, NaF и др.). Соли этого типа за счет гидролиза в водных растворах имеют щелочную реакцию. Этот случай гидролиза называется гидролизом по аниону. Соли, образованные многоосновнымислабыми кислотами (Na2S, Na2CO3, K3PO4, Na2SO3 и др.), гидролизуются ступенчато, образуя в качестве промежуточных продуктов кислые соли. Пример 1. Гидролиз ацетата натрия CH3COONa. Эта соль образована слабой кислотой (CH3COOH) и сильным основанием (NaOH). Гидролиз данной соли протекает по аниону (CH3COO-) в одну ступень и описывается при помощи либо полного молекулярного уравнения: CH3COONa + H-OH ⇄ CH3COOH + NaОН, pH > 7; либо сокращенно-ионного уравнения: CH3COO- + H-OH ⇄ CH3COOH + ОН-. В результате образования малодиссоциированного электролита СН3СООН равновесие диссоциации воды смещается в сторону образования ионов Н+ и ОН-. В результате связывания ионов Н+ ионами СН3СОО- в CH3COOH концентрация ионов ОН- в растворе увеличивается и, таким образом, раствор приобретает щелочную реакцию. Пример 2. Гидролиз сульфида калия K2S. Гидролиз данной соли протекает по аниону (S2-) в две ступени: первая ступень: K2S + H-OH ⇄ KHS + KОН, pH > 7, S2- + H-OH ⇄ HS- + ОН-; вторая ступень: KHS + H-OH ⇄ H2S + KОН, HS- + H-OH ⇄ H2S + ОН-. По второй ступени гидролиз протекает значительно слабее, чем по первой и может осуществляться только при нагревании и разбавлении раствора. 2. Соли, образованные катионами слабого основания и анионами сильной кислоты (NH4C1, FeSO4, ZnCl2 и др.). Соли этого типа за счет гидролиза в водных растворах имеют кислую реакцию. Этот случай гидролиза называется гидролизом по катиону. Соли, образованные многозарядными катионами слабого основания, гидролизуются ступенчато, образуя в качестве промежу-точных продуктов основные соли. Пример 3. Гидролиз нитрата цинка Zn(NO3)2. Эта соль образована сильной кислотой (HNO3) и слабым основанием (Zn(OH)2). Гидролиз данной соли протекает по катиону (Zn2+) в две ступени: первая ступень: Zn(NO3)2 + H-OH ⇄ ZnOHNO3 + HNO3, pH < 7, Zn2+ + H-OH ⇄ ZnOH+ + H+; вторая ступень: ZnOHNO3 + H-OH ⇄ Zn(OH)2 + HNO3, ZnOH+ + H-OH ⇄ Zn(OH)2 + H+. Пример 4. Гидролиз сульфата хрома Cr2(SO4)3. Гидролиз данной соли протекает по катиону (Сr3+) в три ступени: первая ступень: Cr2(SO4)3 + 2H-OH ⇄ 2CrOHSO4 + H2SO4, pH < 7, Cr3+ + H-OH ⇄ CrOH2+ + H+; вторая ступень: 2CrOHSO4 + 2H-OH ⇄ [Cr(OH)2]2SO4 + H2SO4, CrOH2+ + H-OH ⇄ Cr(OH)2+ + H+; третья ступень: [Cr(OH)2]2SO4 + 2H-OH ⇄ 2Cr(OH)3 + H2SO4, Cr(OH)2+ + H-OH ⇄ Cr(OH)3 + H+. В обоих случаях по второй (и далее) ступени гидролиз протекает только при нагревании и разбавлении раствора. 3. Соли, образованные катионами слабого основания и анионами слабой кислоты (NH4CN, CH3COONH4, (NH4)2S, (NH4)2CO3 и др.). Соли этого типа за счет гидролиза в водных растворах имеют слабокислую, слабощелочную или нейтральную реакцию в зависимости от величины констант диссоциации кислот и оснований, образующих данную соль. Гидролиз идет по катиону и аниону одновременно: а) если б) если в) если Пример 5. Гидролиз ацетата аммония CH3COONH4. Эта соль образована слабой кислотой (CH3COOH) и слабым основанием (NH3∙H2O). Гидролиз данной соли протекает c образованием двух малодиссоциированных соединений: CH3COONH4 + H-OH ⇄ NH3×H2O + CH3COOH, CH3COO- + NH4+ + H-OH ⇄ NH3×H2O + CH3COOH.
pH» 7 (нейтральная среда). Пример 6. Гидролиз карбоната аммония (NH4)2СO3. Гидролиз данной соли протекает ступенчато: первая ступень: (NH4)2СO3 + H-OH ⇄ NH3×H2O + NH4HСO3, NH4+ + СO32- + H-OH ⇄ NH3×H2O + HСO3-; вторая ступень: NH4HСO3 + H-OH ⇄ NH3×H2O + H2СO3, NH4+ + HСO3- + H-OH ⇄ NH3×H2O + H2СO3.
pH > 7 (слабощелочная среда). Из приведенных примеров видно, что гидролизсолей, образованных многозарядными катионами или анионами, протекает ступенчато, но самопроизвольно не доходит до конца (т. е. до образования кислоты и основания, образующих данную соль). Гидролиз по первой ступени протекает в большей степени, чем по последующим ступеням. Это связано с тем, что при гидролизе по первой ступени в растворе увеличивается концентрация ионов Н+ или ОН-, что препятствует дальнейшему протеканию процесса. Необратимыйгидролиз (т. е. самопроизвольно протекающий до конца) встречается у некоторых солей, образованных катионами слабого основания и анионами слабой кислоты. Для таких солей в соответствующей клетке таблицы растворимости стоит прочерк. Это означает, что вследствие полного гидролиза такие соли в водном растворе не существуют. Необратимый гидролиз возможен только в том случае, когда образующееся в результате гидролиза одно малодиссоциированное соединение является малорастворимым (основание), а другое - летучим (кислота). Пример 7. Гидролиз сульфида алюминия Al2S3 (в таблице растворимости – прочерк). При растворении этой соли в воде протекает необратимый процесс гидролиза: Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S Необратимый гидролиз необходимо учитывать при написании уравнений реакций, протекающих между электролитами в водных растворах. Пример 8. Смешали водные растворы Na2CO3 и FeCl3. Написать уравнение протекающей реакции. Здесь имеет место взаимный гидролиз, т.е. гидролиз одной соли усиливает гидролиз другой соли. Таким образом, процесс гидролиза самопроизвольно идет до конца, т. е. до образования малораст-воримого гидроксида железа (III) Fe(OH)3 и углекислого газа СО2: 3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3¯ + 3CO2 + 6NaCl 3СO32- + 2Fe3+ + 3H2O = 2Fe(OH)3¯ + 3CO2
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 6167; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.101.241 (0.011 с.) |

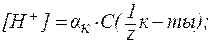
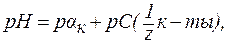
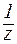 к-ты) - молярная концентрация эквивалента кислоты (для одноосновных кислот она равна молярной концентрации кислоты);
к-ты) - молярная концентрация эквивалента кислоты (для одноосновных кислот она равна молярной концентрации кислоты);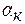 - кажущаяся степень диссоциации (в долях от единицы).
- кажущаяся степень диссоциации (в долях от единицы).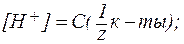
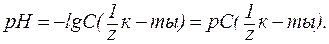
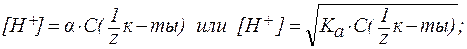
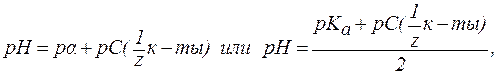
 - константа диссоциации кислоты (для многоосновных кислот, учитывают диссоциацию только по первой ступени);
- константа диссоциации кислоты (для многоосновных кислот, учитывают диссоциацию только по первой ступени);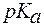 , pa и рС(
, pa и рС( 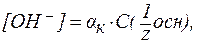
 С(
С(  » 1, поэтому [ОН-] практически равняется общей концентрации растворов этих щелочей:
» 1, поэтому [ОН-] практически равняется общей концентрации растворов этих щелочей: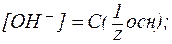
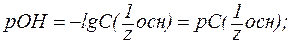
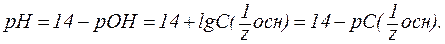
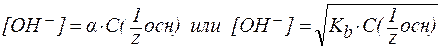 ;
;
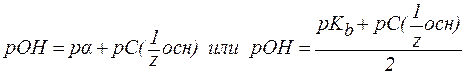
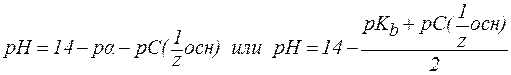
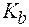 ‑ константа диссоциации основания.
‑ константа диссоциации основания. ;
;

 к-ты), то можем записать:
к-ты), то можем записать: ,
,
 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.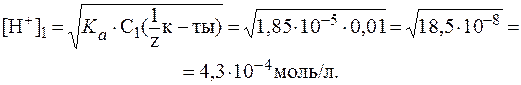






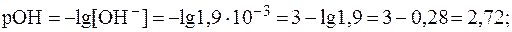

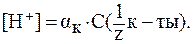


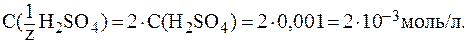

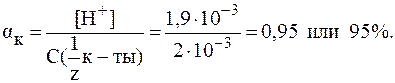
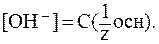
 NaOH):
NaOH):





 .
.
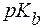 (С5H5N·Н2О) = 5,2.
(С5H5N·Н2О) = 5,2. .
. = 90 %.
= 90 %.

 сначала следует вычислить ионную силу раствора I:
сначала следует вычислить ионную силу раствора I:










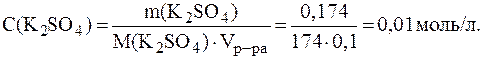






 = 10 %, pH = 2,5,
= 10 %, pH = 2,5,  .
. .
. .
.
 при 20-250С?
при 20-250С?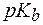 (NH3×Н2О) = 4,74.
(NH3×Н2О) = 4,74.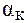 = 90%.
= 90%.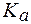 (СН3СООН) = 1,8×10-5.
(СН3СООН) = 1,8×10-5.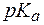 (С6Н5СООН) = 4,2. Во сколько раз изменится рН раствора при разбавлении его водой в 5 раз?
(С6Н5СООН) = 4,2. Во сколько раз изменится рН раствора при разбавлении его водой в 5 раз?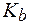 (СН3NH2×Н2О) = 4,4·10−4.
(СН3NH2×Н2О) = 4,4·10−4.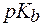 (С2Н5NH2×Н2О) = 3,25.
(С2Н5NH2×Н2О) = 3,25.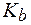 ((СН3)2NH×Н2О) = 6,1×10-4. Во сколько раз изменится рН раствора при разбавлении его водой в 15 раз?
((СН3)2NH×Н2О) = 6,1×10-4. Во сколько раз изменится рН раствора при разбавлении его водой в 15 раз?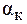 » 90%) добавлено 125 мл воды. Найти рН раствора до и после разбавления, если кажущаяся степень диссоциации увеличивается до 99%.
» 90%) добавлено 125 мл воды. Найти рН раствора до и после разбавления, если кажущаяся степень диссоциации увеличивается до 99%.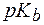 (СН3NH2×Н2О) = 3,36.
(СН3NH2×Н2О) = 3,36.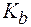 (NH3×Н2О) = 1,8×10-5,
(NH3×Н2О) = 1,8×10-5, (Н2СО3) = 3,7×10-7,
(Н2СО3) = 3,7×10-7, (Н2СО3) = 4,7×10-11,
(Н2СО3) = 4,7×10-11,


