
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет эквивалентов окислителей и восстановителейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В окислительно-восстановительной реакции химический эквивалент определяется как реальная или условная частица вещества, которая эквивалентна одному электрону. Фактор эквивалентности Для КМnО4 факторы эквивалентности Таким образом, молярные массы эквивалентов КМnО4 в различных средах составляют:
Ниже приведены полуреакции окисления некоторых восстано-вителей, используемых в оксидиметрии, и расчет их молярных масс эквивалента:
Fe2+ – 1ē
H2O2 – 2ē
Н2C2O4 – 2ē
C2O42- – 2ē
2S2O32- – 2ē здесь на один ион тиосульфата приходится один отданный электрон, поэтому:
Эталоны решения задач 1.Найти точку перехода и интервал изменения окраски индикатора HInd с Решение. 1) 2) точка перехода окраски определяется как: рН = 3) интервал перехода окраски рассчитывается как: рН = 2. Какую окраску будет иметь индикатор HInd с Решение. 1) 2) точка перехода окраски: рН = 3) интервал перехода окраски: рН = 4) таким образом, в растворах с рН < 6 преобладает молекулярная форма индикатора и растворы с рН = 0, 3, 5 будут окрашены в красный цвет; 5) в растворах с рН > 8 преобладает ионная форма индикатора, следовательно, растворы с рН = 10, 13 окрасятся в синий цвет, растворы с рН = 7 окрасится в фиолетовый цвет. Эту задачу, начиная с п. 4 удобно решать графически:
3. Какие из перечисленных растворов окрасятся при добавлении к ним индикатора HInd с
Решение. 1) точка перехода окраски: рН = 9; 2) интервал перехода окраски: рН = 8 – 10; 3) найдем рН исследуемых растворов: а) соль NaCl не гидролизуется, следовательно, рН = 7, б) pH = –lg[H+] = –lg10–12 = 12, в) рН = 3, г) рН = 13;
4) из рисунка видно, что растворы с рН = 3, 7 останутся бес-цветными, а с рН = 12, 13 окрасятся в желтый цвет. 4.К неизвестному раствору добавили индикатор HInd ( Решение. 1) 2) точка перехода окраски: рН = 4; 3) интервал перехода: рН = 3 – 5;
4) из рисунка видно, что данный индикатор будет иметь желтую окраску в любом растворе с рН > 5, т.е., в растворах со слабокислой, нейтральной и щелочной реакцией. 5. Какое вещество следует взять для стандартизации раствора КОН? Какой из индикаторов с Решение. 1) раствор КОН стандартизируют Н2С2О4∙2H2O, раствор которого готовят по точной навеске; 2) при титровании протекает реакция: Н2С2О4 + 2КОН = K2C2O4 + 2Н2О 3) из уравнения видно, что в точке эквивалентности в растворе находится соль К2С2О4, гидролиз которой приводит к появлению слабощелочной реакции среды, следовательно, в точке эквивалентности рН > 7. 4) характеристика индикаторов:
интервал перехода окраски: рН = 3 – 5.
интервал перехода окраски: рН = 8 – 10. Таким образом, интервал перехода окраски индикатора с 6. Требуется установить концентрацию раствора NH4C1. Обосновать выбор титранта и индикатора для титрования. Решение. 1) в результате гидролиза раствор NH4C1 имеет рН < 7, следова-тельно, титрантом должна быть щелочь. Основными титрантами в алкалиметрии являются КОН и NaOH; 2) при титровании произойдет реакция: NH4C1 + КОН = NH3∙Н2О + КС1 3) в точке эквивалентности продуктами реакции являются соль КС1, не подвергающаяся гидролизу, и слабое основание NH3∙Н2О, поэтому в точке эквивалентности рН > 7, следовательно, для ее фиксирования требуется индикатор с Метод нейтрализации 7. На титрование 20 мл раствора HCl с C(
8. На титрование раствора CH3COOH израсходовано 15,2 мл раствора NaOH c C(
C(
Решение. Согласно закону эквивалентов (4):
следовательно:
9. Рассчитать, какой объем раствора H2SO4 c молярной концентрацией эквивалента 0,2 моль/л потребуется для нейт-рализации раствора, содержащего 0,4 г NaOH.
10. Имеется раствор Na2CO3 объемом 200 мл. На титрование 10 мл этого раствора было израсходовано 15,3 мл раствора HCl с C(
Решение. По результатам титрования найдем C(
Рассчитаем Т(Na2CO3):
Найдем m(Na2CO3) во всем объеме раствора:
11. Вычислить массовую долю w(Na2CO3) в техническом образце, если на титрование навески технической соды массой 0,212 г было израсходовано 20 мл раствора HCl с C(
Рассчитаем w(Na2CO3):
12. Из 0,126 г технической щавелевой кислоты (Н2С2О4×2Н2О) приготовили 200 мл раствора. На титрование 10 мл полученного раст-вора израсходовали 8 мл раствора NaOHс C(
Рассчитаем Т(Н2С2О4):
Вычислим массу чистого Н2С2О4×2Н2О в образце:
Рассчитаем w(Н2С2О4×2Н2О) в техническом образце:
13. Рассчитать, какой объем раствора H2SO4 с молярной концентрацией эквивалента 0,01 моль/л необходимо затратить, чтобы оттитровать 20 мл раствора NaOH с T(NaOH) = 0,0004 г/мл.
Найдем V(H2SO4):
Метод оксидиметрии 14. Рассчитать молярную концентрацию эквивалента и титр раствора перманганата калия для использования его в качестве титранта в кислой среде, если 0,79 г соли растворено в мерной колбе на 200 мл.
2) 15. На титрование раствора соли Мора было израсходовано 10 мл раствора KMnO4 с молярной концентрацией эквивалента 0,05 моль/л. Определить массу ионов Fe2+ в растворе.
Из уравнения полуреакции видно, z(Fe2+) = 1. Запишем выражение закона эквивалентов (формула 4):
Получим:
16. Образец загрязненного примесями оксалата натрия массой 0,5 г растворили в колбе на 500 мл. Пробу раствора объемом 10 мл оттитровали в кислой среде 12 мл раствора KMnO4 с молярной концентрацией эквивалента 0,01 моль/мл. Определить содержание чистого оксалата натрия в образце.
Найдем массу чистого Na2C2O4 в титруемой пробе:
Отсюда:
В 500 мл раствора Na2C2O4 содержится:
Таким образом:
17. К 0,15 г технического образца, содержащего дихромат калия, добавлены избыток раствора иодида калия и серная кислота. На титрование выделившегося иода потребовалось 22,85 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,1 моль/л. Определить массовую долю дихромата калия в техническом образце.
В реакции восстановления дихромат-иона участвует шесть электронов: Сr2О поэтому:
Таким образом:
Отсюда:
18. Вычислить массу пероксида водорода в 400 мл раствора, если на титрование 5 мл этого раствора в кислой среде было затрачено 11 мл раствора перманганата калия, титр которого равен 0,00158 г/мл.
В соответствии с законом эквивалентов (3):
В реакции окисления H2O2 участвуют 2 электрона: H2O2 – 2ē поэтому:
Найдем массу H2O2 в титруемой пробе:
Полученная масса H2O2 содержится в 5 мл раствора, а в 400 мл содержится:
Вопросы для самоконтроля 1. Какие методы включает в себя количественный анализ? 2. Что лежит в основе титриметрического метода анализа? Что такое титрант? Что такое точка эквивалентности? 3. Какие методы, в зависимости от типа используемой реакции, включает в себя объемный анализ? 4. Какие требования предъявляются к реакциям, используемым в объемном анализе? 5. Сформулируйте закон эквивалентов. Какие уравнения, отра-жающие этот закон, вам известны? Допустимо ли комбинирование этих уравнений? 6. Какие способы выражения концентрации растворов исполь-зуются в объемном анализе? Как они связаны между собой? 7. Концентрации каких веществ определяют методом нейтра-лизации? 8. Что такое индикатор? Какие соединения могут быть исполь-зованы в качестве индикатора? 9. Что такое точка перехода и интервал перехода окраски индикатора? 10. Как выглядят кривые титрования: а) сильной кислоты сильным основанием; б) слабой кислоты сильным основанием; в) слабого основания сильной кислой? 11. Что такое скачок pH? 12. Каким правилом следует руководствоваться при выборе индикатора? 13. Какие реакции лежат в основе метода оксидиметрии? 14. Что такое окислитель? Что такое восстановитель? 15. Как определяется фактор эквивалентности в окислительно-восстановительных реакциях? 16. Что является титрантом в методе перманганатометрии? Что является индикатором? В какой среде проводят титрование? 17. Что является титрантом в методе иодометрии (прямом и косвенном)? Что является индикатором? 18. Найти точку перехода и интервал изменения окраски индикатора HInd с 19. Найти точку перехода и интервал изменения окраски индикатора HInd с 20. Найти точку перехода и интервал изменения окраски инди-катора HInd с 21. Какую окраску будет иметь индикатор HInd с 22. Какую окраску будет иметь индикатор HInd с 23. Какую окраску будет иметь индикатор HInd с 24. Что следует использовать в качестве титранта и в качестве индикатора при количественном определении содержания азотной кислоты в растворе? 25. Что следует использовать в качестве титранта и в качестве индикатора при количественном определении содержания аммиака в водном растворе? 26. Что следует использовать в качестве титранта и в качестве индикатора при количественном определении содержания ионов Fe2+ в водном растворе? 27. Можно ли использовать метод прямой перманганатометрии для определения содержания Fe2(SO4)3 в водном растворе? 28. Можно ли использовать метод нейтрализации для опреде-ления содержания Ca(NO3)2 в водном растворе? 29. К неизвестному раствору добавили индикатор HInd ( 30. По кривой титрования определить, следует ли при титровании раствора Na2CO3 соляной кислотой использовать индикатор тимоловый синий с 31. По кривой титрования определить, следует ли при титровании раствора уксусной кислоты гидроксидом калия использовать индикатор индигокармин с 32. В каком диапазоне значений рН индикатор HInd с 33. В каком диапазоне значений рН индикатор HInd с 34. В каком диапазоне значений рН индикатор HInd с 35. В каком диапазоне значений рН индикатор HInd с 36. Что называется степенью окисления? Определить степень окисления: а) серы в соединениях: SO2, H2S, Na2SO3, S8, Fe2(SO4)3; б) хрома в соединениях: H2CrO4, CrCl2, Cr2O3, Na3[Cr(OH)6], (NH4)2Cr2O7; в) азота в соединениях: Ba(NO3)2, NH3, N2, KNO2, N2O4. 37. Как называется частица, содержащая элемент, степень окис-ления которого возрастает (уменьшается) в ходе реакции? 38. В результате какого процесса изменяется степень окисления элемента? 39. Чем окислительно-восстановительные реакции отличаются от реакций обменного типа? 40. Какие из перечисленных веществ и за счет каких элементов проявляют окислительные свойства, а какие – восстановительные: AgNO2, H2S, SO2, F2, CO, Zn, HMnO4, Ca(ClO)2, H3SbO3. Есть ли среди приведенных веществ такие, которые обладают окислительно-восстановительною двойственностью? 41. Как методом полуреакций определить коэффициенты в урав-нении окислительно-восстановительной реакции? 42. Что такое оксидиметрия и для чего она используется? 43. Написать химические формулы веществ, растворы которых используются в качестве титрантов, при разных видах оксидиметрии. 44. Как вычисляется молярная масса эквивалента окислителя (восстановителя)? 45. Чему равны молярные массы эквивалентов веществ, исполь-зуемых в качестве титрантов в методах перманганатометрии и иодометрии? 46. Как фиксируется точка эквивалентности при выполнении перманганатометрии и иодометрии в кислой среде? 47. Закончить следующие окислительно-восстановительные реак-ции и уравнять методом электронно-ионного баланса: 1) KMnO4 + H2O2 + H2SO4 2) KMnO4 + KNO2 + KOH 3) KMnO4 + KNO2 + H2O 4) K2Cr2O7 + HBr 5) КСrO2 + Н2О2 + КОН 6) As2S3 + HNO3 7) Cl2 + I2 + H2O 8) Cl2 + KOH(гор.) 9) Na2SO3 + Br2 + NaOH 10) KClO3 + KCrO2 + KOH 11) K2Cr2O7 + Н2S + H2SO4 12) PbS + НNО3 13) Na2SO3 + Br2 + NaOH 14) Fe(NО3)2 + NаClО3 + НNО3 15) NaNO3 + Al + NaOH + H2O 16) Zn + НNО3(РАЗБ.) 17) Cu + НNО3(РАЗБ.) 18) HCl + PbO2 Варианты задач для самостоятельного решения Вариант №1 1. Рассчитать молярную концентрацию эквивалента НСlО4 в растворе, если на титрование 10 мл этого раствора затрачено 16,3 мл раствора гидроксида калия с С( 2. На титрование 5 мл раствора гидроксида бария израсходовано 13 мл раствора соляной кислоты с С( 3. Вычислить объем раствора оксалата аммония с С( 4. Рассчитать массовую долю иода в образце массой 0,1 г, который прореагировал при титровании с 18,7 мл раствора тиосульфата натрия, если Т(Na2S2O3) = 0,00395 г/мл. Вариант №2 1. На титрование раствора азотной кислоты израсходовано 10,6 мл раствора гидроксида натрия с С( 2. Рассчитать массовую долю примесей в образце гидроксида кальция, 0,8 г которого было растворено в мерной колбе объемом 250 мл, а для титрования 10 мл приготовленного раствора затрачено 8 мл раствора соляной кислоты с Т(НСl) = 0,00365 г/мл. 3. Определить молярную концентрацию эквивалента перманганата калия, если на титрование 10 мл этого раствора в кислой среде потребовалось 14,4 мл раствора соли Мора ((NH4)2SO4·FеSО4·6H2O), титр которой равен 0,00392 г/мл. 4. Найти объем раствора иодида калия с С( Вариант №3 1. В мерной колбе объемом 150 мл растворено 0,69 г карбоната калия. На титрование 10 мл полученного раствора израсходовано 16,7 мл раствора соляной кислоты. Определить С( 2. Рассчитать массу гидроксида натрия в растворе, если на титрование этого раствора затрачено 12,6 мл раствора серной кислоты с С( 3. Образец загрязненного неактивными примесями дигидрата щавелевой кислоты массой 0,13 г растворен в мерной колбе объемом 100 мл. На титрование 10 мл полученного раствора в кислой среде затрачено 24,7 мл раствора перманганата калия с молярной концентрацией эквивалента 0,008 моль/л. Рассчитать массовую долю Н2С2О4×2Н2О в образце. 4. К раствору, содержащему 0,049 г дихромата калия, добавили раствор серной кислоты и избыток раствора иодида калия. Выделившийся иод оттитровали раствором тиосульфата натрия с С( Вариант №4 1. На титрование раствора, содержащего 0,136 г карбоната натрия, требуется 14,5 мл раствора серной кислоты. Рассчитать Т(H2SO4) и массу Н2SO4 в растворе. 2. 9,8 г раствора азотной кислоты поместили в мерную колбу и разбавили водой до объема 500 мл. На титрование 15 мл полученного раствора израсходовано 12 мл раствора гидроксида калия с С( 3. Вычислить объем раствора оксалата калия, молярная концентрация эквивалента которого равна 0,014 моль/л, затраченного на титрование в кислой среде 10 мл раствора перманганата калия с С( 4. Определить молярную концентрацию эквивалента тиосульфата натрия в растворе, если на титрование 15 мл этого раствора затрачено 10,8 мл раствора иода с Т(I2) = 0,00254 г/мл. Вариант №5 1. В мерной колбе объемом 300 мл растворено 0,45 г образца гидроксида натрия, содержащего посторонние примеси. На титрование 10 мл приготовленного раствора затрачено 8,2 мл раствора щавелевой кислоты с С( 2. На титрование 10 мл раствора серной кислоты израсходовано 12,5 мл раствора гидроксида калия с Т(КОН) = 0,0056 г/мл. Рассчи-тать Т(H2SO4). 3. Кристаллический йод массой 0,0254 г при титровании прореагировал с 8,5 мл раствора Na2S2O3. Определить молярную концентрацию эквивалента тиосульфата натрия. 4. Вычислить объем раствора нитрата железа (II) с Т(Fe(NО3)2) = 0,0018 г/мл, который при титровании в кислой среде прореагирует с 2 мл раствора перманганата калия, если С( Вариант №6 1. На титрование раствора гидрокарбоната калия с молярной концентрацией эквивалента 0,025 моль/л израсходовано 9,6 мл раствора соляной кислоты с С( 2. Рассчитать массу азотной кислоты, если для ее нейтрализации потребовалось 16 мл раствора гидроксида бария с Т(Ва(ОН)2) = 0,00171 г/мл. 3. 0,478 г раствора пероксида водорода поместили в мерную колбу и разбавили водой до объема 150 мл. На титрование 15 мл полученного раствора затрачено 11,7 мл раствора перманганата калия с С( 4. К 10 мл раствора дихромата калия добавлен раствор серной кислоты и избыток раствора иодида калия. Выделившийся иод был оттитрован 20,9 мл раствора тиосульфата натрия с С( Вариант №7 1. Навеску хлорида аммония растворили в мерной колбе объемом 200 мл. На титрование 10 мл этого раствора потребовалось 6,3 мл раствора гидроксида натрия с С( 2. На титрование раствора, содержащего 0,45 г Na2B4O7, затра-чено 24,1 мл раствора серной кислоты. Вычислить С( 3. Определить объем раствора перманганата калия, титр которого равен 0,000948 г/мл, необходимого для титрования в кислой среде 5 мл раствора сульфата железа (II) с С( 4. К 0,29 г образца, содержащего дихромат аммония, добавлен раствор серной кислоты и избыток раствора иодида калия. На титрование выделившегося иода было затрачено 12,8 мл раствора тиосульфата натрия с Т(Na2S2O3) = 0,079 г/мл. Чему равна массовая доля посторонних примесей в образце? Вариант №8 1. На титрование 5 мл раствора карбоната калия израсходовано 13 мл раствора соляной кислоты с С( 2. Определить массовую долю гидроксида стронция в 0,6 г образца, растворенного в мерной колбе объемом 150 мл, если на титрование 15 мл приготовленного раствора затрачено 8,8 мл раствора азотной кислоты с Т(НNО3) = 0,0063 г/мл.
3. К раствору, содержащему 0,098 г дихромата калия, добавлена серная кислота и избыток раствора иодида калия. Выделившийся йод оттитрован 5 мл раствора Na2S2O3. Рассчитать молярную концентрацию эквивалента тиосульфата натрия. 4. Рассчитать, какой объем раствора щавелевой кислоты с С( Вариант №9 1. Навеску Na2B4O7×10Н2О растворили в мерной колбе объемом 500 мл. На титрование 10 мл полученного раствора было затрачено 8,9 мл раствора серной кислоты с С( 2. На титрование 10 мл раствора гидроксида калия израсходовано 14,5 мл раствора соляной кислоты с Т(HCl) = 0,00073 г/мл. Вычислить С( 3. Рассчитать массовую долю посторонних примесей в образце, если на титрование 0,1 г образца, содержащего тиосульфат калия, затрачено 27,1 мл раствора иода с С( 4. Определить объем раствора перманганата калия с С( Вариант №10 1. На титрование 10 мл раствора соляной кислоты с молярной концентрацией эквивалента 0,125 моль/л потребовалось 11,5 мл раствора гидроксида натрия. Вычислить С( 2. Рассчитать массу навески гидрокарбоната калия, если известно, что на титрование его раствора до CO2 затрачено 14,3 мл раствора серной кислоты с молярной концентрацией эквивалента 0,2 моль/л. 3. Образец дигидрата щавелевой кислоты массой 1,6 г, содержащий примеси, растворили в мерной колбе объемом 500 мл. На титрование 10 мл полученного раствора щавелевой кислоты в кислой среде было затрачено 9,7 мл раствора перманганата калия с Т(КМnО4) = 0,00158 г/мл. Найти массовую долю примесей в образце. 4. Определить объем раствора тиосульфата натрия с Т(Na2 | |||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |

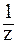 в окислительно-восстановительных реакциях определяется числом электронов (n), принятых или отданных одним атомом, ионом или молекулой окислителя или восстановителя (z = n).
в окислительно-восстановительных реакциях определяется числом электронов (n), принятых или отданных одним атомом, ионом или молекулой окислителя или восстановителя (z = n). ,
,  и 1.
и 1. KMnO4), г/моль
KMnO4), г/моль

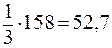
 Fe3+,
Fe3+, ;
; ;
; ;
; ;
; .
. = 10–4.
= 10–4.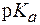 = –lg
= –lg 

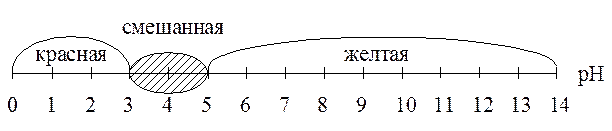
 (NaOH) = 10 мл
(NaOH) = 10 мл
 следовательно:
следовательно:

 Дано:
Дано: NaOH) = 0,05 моль/л
NaOH) = 0,05 моль/л m(CH3COOH) -?
m(CH3COOH) -?


 (H2SO4) -?
(H2SO4) -?

 HCl) = 0,1 моль/л. Найти массу соды в исходном растворе.
HCl) = 0,1 моль/л. Найти массу соды в исходном растворе. ,
,













 где M(
где M(
 .
.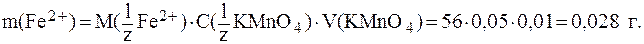





 .
. + 14Н
+ 14Н  + 6ē
+ 6ē  + 7H2O,
+ 7H2O, .
.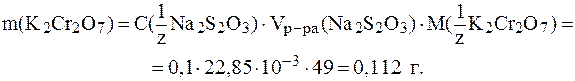

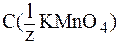 :
:

 .
. .
.




