
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эквивалент, фактор эквивалентности, молярная концентрация эквивалентовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пример 2. Вычислите молярную концентрацию эквивалентов ортофосфорной кислоты в 20%-ном растворе H3PO4, плотность которого 1,020 г/см3, учитывая уравнение H3PO4 + 3KOH = K3PO4 + 3H2O. Решение. Молярная концентрация эквивалентов вещества х (символ Сэкв (х), единица измерения моль/м3 или моль/л) определяется количеством вещества эквивалентов nэкв(х), находящихся в 1 л раствора. Молярная концентрация эквивалентов зависит от реакции, так как одно и то же вещество в различных реакциях может иметь разные значения эквивалентного числа. 1. Рассчитываем фактор эквивалентности H3PO4 в данной реакции. Реагент КОН обменивает с одной формульной единицей 1 ФЕ (H3PO4) три гидроксильные группы ОН–, каждая их которых эквивалентна иону Н+. Следовательно, эквивалентное число Z (H3PO4) = 3, фактор эквивалентности f(H3PO4) = 2. Рассчитываем молярную массу эквивалентов. Молярная масса эквивалентов H3PO4 равна произведению фактора эквивалентности H3PO4 на молярную массу H3PO4 (98 г/моль): Мэкв(H3PO4) = f(H3PO4) · 3. Вычислим массу 1 л раствора, исходя из значений плотности: m = υ · ρ = 1000 мл · 1,020 г/см3 = 1020 г. Содержание H3PO4 в 1 л раствора найдем из пропорции: в 100 г раствора H3PO4 содержится 20 г H3PO4; в 1020 г раствора H3PO4 содержится х г H3PO4, х = 4. Определим количество вещества эквивалентов H3PO4 в 1 л раствора. Количество вещества эквивалентов показывает количество вещества (в молях), в котором частицами являются эквивалентны (реальные или условные частицы вещества). Количество вещества эквивалентов H3PO4 в 1 л раствора получим делением числа граммов H3PO4 в 1 л раствора на молярную массу эквивалентов H3PO4: nэкв(Н3PO4) = т.е. получим 6,25 моль вещества. Значит Сэкв (H3PO4, Н2О, f = Пример 3. Учитывая уравнение реакции KOH + H2SO4 = KHSO4 + H2O, Рассчитайте фактор эквивалентности f(KOH) и f(H2SO4). Определите молярную концентрацию эквивалентов раствора серной кислоты H2SO4, если на нейтрализацию 24,5 мл кислоты потребовалось 23,0 мл раствора гидроксида калия KOH, Сэкв(KOH) = 0,15 моль/л. Решение. Растворы различной молярной концентрации эквивалентов взаимодействуют в объемах, обратно пропорциональных их молярным концентрациям эквивалентов. Зная молярную концентрацию эквивалентов одного из двух реагирующих растворов и их объемы, определяем молярную концентрацию эквивалентов второго раствора:
1. Рассчитаем фактор эквивалентности f(KOH) и f(H2SO4). Реагент KOH обменивается с одной формульной единицей 1 ФЕ H2SO4 одну гидроксильную группу ОН–, которая эквивалентна иону Н+. Следовательно, эквивалентное число Z(H2SO4) = 1, фактор эквивалентности f(H2SO4) = 1. Эквивалентное число Z(KOH) = 1, f(KOH) = 1. 2. Вычислим молярную концентрацию эквивалентов раствора H2SO4.
Сэкв(Н2SO4, Н2О, f = 1) = =0,14 моль/л или 0,14Н H2SO4. Пример 4. Определить массу (г) перманганата калия KMnO4, необходимую для приготовления 0,5 л 0,2н раствора, предназначенного для изучения окислительных свойств вещества в кислой среде MnO4– + 8H+ + 5e– = Mn2+ + 4H2O. Решение. 1. Определим фактор эквивалентности f(KMnO4). Ионно-электронное уравнение полуреакции показывает, что степень окисления марганца изменяется от +7 до +2. Одна формульная единица MnO4– присоединяет пять электронов, поэтому эквивалентное число Z(MnO4–) = 5. Следовательно, эквивалентное число KMnO4 равно Z(KMnO4) = 5, фактор эквивалентности f(KMnO4) = 2. Вычислим массу KMnO4 необходимую для приготовления 0,5 л 0,2н раствора. Молярная концентрация эквивалентов Сэкв(х) равна отношению количества вещества эквивалентов nэкв(х) к объему раствора Vp:
где mx – масса вещества (г); f(x) – фактор эквивалентности; Мх – молярная масса вещества, г/моль; Vp – объем раствора (л). Отсюда можно рассчитать массу вещества:
Ответ: Для приготовления 0,5 л 0,2н раствора необходимо взять 3,16 г KMnO4. КОНТРОЛЬНЫЕ ЗАДАНИЯ 121. Определите массовую долю (в%) некоторой соли в растворе, приготовленном из 10 г соли и 190 г воды. Ответ: 5%. 122. Рассчитайте молярную концентрацию (моль/л) хлорида марганца (II) MnCl2, если в 200 мл раствора содержится 2,52 г разбавленного вещества. Ответ: 0,1М. 123. Рассчитайте молярную концентрацию эквивалентов (моль/л) хлорида цинка ZnCl2, в 200 мл раствора которого содержится 1,83 г этого вещества. Реакция протекает по уравнению: ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl. Ответ: 0,3 моль/л. 124.Определите массу (г) перманганата калия KMnO4, необходимую для приготовления 1,5 л 0,3н раствора, предназначенного для изучения окислительных свойств этого вещества в нейтральной среде:
MnO4– + 3e– + 2H2O = MnO2 + 4OH–. Ответ: 23,7 г. 125. Вычислите титр 40%-ного раствора серной кислоты H2SO4 плотностью ρ = 1,307 г/см3. Ответ: 126. Реакция протекает по уравнению: 3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2 + 6H2O. Вычислите фактор эквивалентности f(Ba(OH)2) и f(H3PO4). Определите, какой объем ортофосфорной кислоты H3PO4, Сэкв (H3PO4) = 0,7 моль/л необходим для нейтрализации 30 мл раствора гидроксида бария Ba(OH)2, титр которого 0,0960 г/мл. Ответ: 48 мл. 127. Рассчитайте массу глюкозы С6Н12О6 и воды, необходимых для приготовления 200 г 5%-ного раствора. Ответ: 10 г глюкозы, 190 г воды. 128. Определите массу (г) нитрата никеля Ni(NO3)2, содержащегося в 200 мл 0,125М раствора Ni(NO3)2. Ответ: 4,6 г. 129. Реакция протекает по уравнению: Cr(NO3)3 + 3NaOH = Cr(OH)3 + 3NaNO3. Вычислите молярную концентрацию эквивалентов нитрата хрома Cr(NO3)3, в 3 л которого содержится 52,2 г этого вещества. Ответ: 0,22н. 130. Определите массу (г) дихромата калия K2Cr2O7, необходимую для приготовления 1 л 2н раствора, предназначенного для изучения окислительных свойств этого вещества в кислой среде: Сr2O72– + 6e– + 14H+ = 2Cr3+ + 7H2O. Ответ: 98 г. 131. Вычислите титр раствора гидроксида калия KOH, полученного при растворении 25 г KOH и 160 г воды, если плотность раствора равна 1,24 г/см3. Ответ: ТKOH = 0,1675 г/мл. 132. Реакция протекает по уравнению: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O. Рассчитайте фактор эквивалентности f(Zn(OH)2) и f(HCl). Определите, какой объем раствора соляной кислоты HCl, Сэкв(HCl) = 0,1 моль/л необходим для нейтрализации 8 мл гидроксида раствора цинка Zn(OH)2, титр которого 0,0720 г/мл? Ответ: 112 мл. 133. Смешали 200 г 2%-ного раствора и 300 г 12%-ного раствора хлорида кальция CaCl2. Определите массовую долю СaCl2 в полученном растворе. Ответ: 8%. 134. Определите массу (г) сульфита натрия Na2SO3, необходимую для приготовления 0,4 л 0,6н раствора, предназначенного для изучения восстановительных свойств этого вещества в щелочной среде SO32– + 2OH– – 2e = SO42– + H2O. Ответ: 15,12 г. 135. Сколько граммов кристаллогидрата хлорида бария (BaCl2·2H2O) надо взять для приготовления раствора объемом 0,5 л, в котором массовая доля BaCl2 составляет 0,1 (10%-ный раствор)? Плотность раствора ρ = 1,090 г/см3. Ответ: 63,92 г. 136. Вычислите молярную концентрацию эквивалентов соляной кислоты в 80 мл раствора, содержащего 3,6 г НСl, вступившей в реакцию по уравнению: 2HCl + Ca(OH)2 = CaCl2 + 2H2O. Ответ: 1,2н. 137. Вычислите массовую долю (%) Mn(NO3)2 в 0,57М растворе Mn(NO3)2, если плотность этого раствора равна ρ = 1,060г/см3. Ответ: 9,6%. 138. Для проведения реакции Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O использовали раствор карбоната натрия (Na2CO3), полученный при растворении 10,6 г соли в одном литре воды. Вычислите молярную концентрацию эквивалентов карбоната натрия в растворе. Ответ: 0,2н Na2CO3. 139. Из 800 г 2%-ного раствора соляной кислоты HCl выпарили 300 г воды. Рассчитайте массовую долю (%) HCl в оставшемся после выпаривания растворе. Ответ: 3,2%. 140. Рассчитайте массу K2CO3 (г), необходимую для приготовления 100 мл 10%-ного раствора (ρ= 1,0904 г/см3). Ответ: 10,9 г. ИОННО-ОБМЕННЫЕ РЕАКЦИИ Ионно-обменные реакции протекают в жидких растворах электролитов с участием ионов, на которые они диссоциируют. В ходе таких реакций степень окисления элементов не меняется. Для усвоения данного раздела необходимо знать, что по способности к диссоциации на ионы электролиты (основания, кислоты, соли) делятся на сильные и слабые, при этом сила электролита количественно характеризуется константой диссоциации Кд (Кд > 1 – сильные, Кд < 1 – слабые электролиты).
Ионно-обменные реакции могут быть обратимыми и необратимыми. Если в результате взаимодействия ионов образуются летучее соединение, малорастворимый электролит, выпадающий в виде осадка, растворимый слабый электролит (молекулы, ионы или комплексные ионы), то такие реакции идут практически до конца и называются необратимыми. Обратимые реакции характеризуются наличием слабого электролита или малорастворимого электролита в виде осадка в исходных реагентах и продуктах реакции. Химическое равновесие в таких реакциях смещено в сторону образования менее растворимого соединения или более слабого электролита. При составлении уравнений ионно-обменных реакций газообразные вещества, малорастворимые и слабодиссоциированные электролиты записывают в виде молекулы независимо от того, являются они исходными реагентами или продуктами реакции. Сильные электролиты следует записывать в виде ионов. При решении контрольного задания необходимо пользоваться следующими таблицами (см. приложение): растворимость кислот, оснований и солей в воде (табл. 7): произведение растворимости некоторых малорастворимых соединений (табл. 8); константы диссоциации некоторых электролитов (табл. 6) [1...5, 8]. Пример 1. Составьте молекулярные и ионно-молекулярные уравнения реакций между водными растворами следующих веществ: а) Nа2СО3и НСl; б) K2S и НСl. Решение. 1. Составляем молекулярные уравнения реакций
H2O б. K2S+2HCl = 2KCl + H2S. 2. В рассматриваемых уравнениях реакций Na2СО3, NaCl, K2S. КСl –растворимые соли (табл. 7), кислота НСl (Кд НCl = 1,0 · 107 табл. 6) – сильный электролит, Н2О ( а. 2Na+ + СО32– + 2Н+ + 2Сl– = 2Na+ + 2Сl– + СО2 + Н2О. б. 2K+ + S2– + 2H+ + 2Cl– = H2S+ 2K+ + 2Cl–. 3. Исключаем одинаковые ионы из обеих частей в каждом равенстве и получаем сокращенные ионно-молекулярные уравнения, которые, собственно, и выражают суть процессов - взаимодействие ионов: а. CO32– + 2H+ = СО2 + Н2О. б. 2H+ +S2– = H2S. Пример 2. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Na2S и СuSО4; б) Na2SiO3 и HCI; в) Fе2(SО4)3 и NaOH. Решение. Действуем поэтапно, как в предыдущем примере: 1. Записываем уравнения в молекулярном виде: а. Na2S + CuSO4 = CuS¯ +Na2SO4. б. Na2SiO3 + 2HCl = H2SiO3¯ + 2NaCl. в. Fe2(SO4)3 + 6NaOH = 2Fe(OH)3¯ + 3Na2SO4. 2. Пользуясь данными табл.7 приложения находим, что CuS, H2SiO3, Fe(OH)3 нерастворимые соединения. Далее записываем соответствующие полные ионно-молекулярные уравнения:
а. 2Na+ + S2– + Cu2+ + SО42– = CuS¯ + 2Na+ + SO42–. б. 2Na+ + SiO32– +2H+ + 2Cl– = H2SiO3¯ + 2Na+ +2Cl–. в. 2Fe3++ 3SO42– +3Na+ + 6OH– = 2Fe(OH)3¯ +6Na+ + 3SO42–. 3. После исключения одинаковых ионов из левой и правой частей в каждом равенстве получаем: а. S2– + Cu2+ = CuS¯. б. SiO32– + 2K+ = H2SiO3¯. в. 2Fe3++ 6OH– = 2Fe(OH)3¯. Пример 3. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) НСl и КОН; б) НNО3 и СН3СОONа; в) NH4Cl и NaOH. Решение. 1. Записываем уравнения в молекулярном виде: а. НСl + КОН = КСl + H2O. б. CH3COONa + HNO3 = СН3СООН + NaNO3. в. NH4Cl + NaOH = NaCl + NH4OH. 2. Используя значения констант диссоциации Кд (табл. 6 приложения) нaходим, что Н2О (Кд = 1,8 · 10–16), СН3СООН (Кд = 1,85 · 10–5), NH4OH (Кд = 1,79 · 10–5) – слабые электролиты, остальные соединения – сильные электролиты (Кд > 1). В связи с этим, полные ионно-молекулярные уравнения имеют вид: а. H+ + Cl– + K+ + OH– = K+ + Cl– + H2O. б. CH3COO– + Na+ + H+ + NO3– = CH3COOH + Na+ + NO3–. в. NH4+ + Cl– + Na+ + OH– = Na+ + Cl– + NH4OH. 3. Исключив одинаковые ионы из обеих частей каждого равенства, получаем: a. Н+ + ОН– = Н2О. б. СН3СОО– + Н+ = СН3СООН. в. NH4+ + OH– = NH4OH. Пример 4. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения: а. Ag+ + Br – = AgBr¯. б. SO32– + 2H+ = SO2 + H2O. Решение. а. Для полученияAgBr необходимо взять два растворимых вещества, одно AgNO3 + NaBr = AgBr¯ + NaNO3. б. Для получения SO2и Н2О необходимо взять в качестве исходных реагентов соль сернистой кислоты и кислоту более сильную, чем Н2SО3, т.е. способную вытеснить последнюю из её соли: Na2SO3 + 2НСl = 2 NaCl + SO2 + Н2О. Пример 5. Составьте ионно-молекулярные уравнения и определите, в какую сторону смещено равновесие в следующих обратимых процессах, протекающих в растворах: а. FeS¯ + 2HCl «FeCl2 + H2S. б. PbCl2¯ + H2SO4 «PbSO4¯ + 2HCl. в. CuOHCl + HC1 «CuCl2 + H2O. Решение. 1. Составляем полные ионно-молекулярные уравнения для данных процессов. а. FeS¯ +2H+ + 2Cl– «Fe2+ + 2Cl– + H2S. б. PbCl2¯ + 2H+ + SO42– «PbSO4¯ + 2H+ +2Cl–. в. СuOH+ + Cl– + H+ + Cl– «Cu2+ + 2Cl– + H2O. 2. После исключения одинаковых ионов из обеих частей каждого равенства а. FeS¯ +2H+ +2Cl– ® Fe2+ + H2S. б. PbCl2¯ + SO42– ® PbSO4¯ + 2Cl–. в. СuOH+ + H+ «Cu2+ + H2O. 3. Определяем направление смещения химического равновесия: а. Процесс растворения FeS (ПРFeS = 5,0 · 10–18, табл. 8 приложения)происходит за счёт связывания водород - ионами сульфид - ионов и образования менее диссоциированного соединения H2S (суммарная константа диссоциации Кд = Кд1 · Кд2 = 5,7 · 10–8 · 1,2 · 10–15 = 6,8 · 10–23). Равновесие смешено в сторону более слабого электролита, т.е. вправо. б. Произведение растворимости РbСl2 ( в. В данной реакции смещение химического равновесия происходит в сторону образования менее диссоциированного соединения Н2О (
КОНТРОЛЬНЫЕ ЗАДАНИЯ 141. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих между веществами: a) FeS и НСl; б) ВаСl2 и H2SO4; в) NаНSО3 и NaOH. В обратимых реакциях укажите и объясните направление смещения химического равновесия. 142. Укажите, между какими веществами возможно взаимодействие: а) Fе(NO3)2 и НСl; б) СuСl2 и K2S; в) K2SO4 и NaCl. Подтвердите ответ молекулярными и ионно-молекулярными уравнениями. 143.К каждому из веществ: а) Ва(NО3)2; б) FeCl2; в) Na2SO4 прибавили избыток раствора гидроксида натрия. В каком случае и почему произошла реакция? Составьте молекулярное и ионно-молекулярное уравнения протекающей реакции. 144. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающей при растворении в соляной кислоте соответствующего сульфида: а) HgS; б) SnS; в)MnS. 145. Подберите три варианта молекулярных уравнений реакций, выражающихся одним приведённым ионно-молекулярным уравнением: Ba2+ + SO42– = BaSO4¯. 146. К каждому из веществ КСl, Na3PО4 и Mg(NO3) 2 прибавили раствор сульфата алюминия. В каком случае и почему произойдёт реакция? Составьте для неё молекулярное и сокращённое ионно-молекулярное уравнения. 147. К каждому из веществ K2SO4, CdOHCI и Zn(NO3)2 прибавили соляной кислоты НСl. В каком случае произойдёт реакция? Укажите соединение, образование которого вызывает смешение химического равновесия в сторону прямой реакции. Составьте молекулярные и ионно-молекулярные уравнения реакций. 148. К каждому из веществ: а) CuSO4, б) Сu(NO3)2, в) AlOHCl2 прибавили соляной кислоты. Определите, какая реакция протекает, составьте её молекулярное и ионно-молекулярное уравнения. Укажите направление смешения химического равновесия в выбранной реакции. 149. Укажите, какую пару веществ: а) СаSО3 и AlPO4; б) СаСО3 и К3РO4; в) Са(NО3)2 и Nа3РО4 необходимо взять для осуществления реакции в соответствии со следующим сокращённым ионно-молекулярным уравнением: 3Ca2+ + 2PO43– = Ca3(PO4)2¯. 150. Определите, какая соль: a) FeS; б) Ag2S; в) CdS растворяется в соляной кислоте. Составьте молекулярное и сокращённое ионно-молекулярное уравнения реакции. 151. Напишите полное и сокращённое ионно-молекулярное уравнения обратимой реакции: NаОН + HCN «NaCN + Н2О. Определите, в какую сторону смещено равновесие реакции. Ответ мотивируйте. 152. Укажите, в каком случае возможно взаимодействие: а) Сu(NO3)2 и Na2SO4; б) ВаСl2 и К2SО4; в) КNO3 и NaCl. Составьте молекулярное и ионно-молекулярное уравнения реакции. 153. Мотивированно укажите, какая из нижеприведённых реакций является необратимой: a) 2NH4OH + H2SO4 = (NH4)2SO4 +2H2O. б) Cu(OH)2SO4 + H2SO4 = 2CuSO4 + H2O. в) 2КОН + H2S04 = K2SO4+2H2O. Составьте для неё полное я сокращенное ионно-молекулярные уравнения. 154. Объясните, какой из гидроксидов: а) КОН; б) NН4ОН; в) Сr(ОН)3 необходимо взять для осуществления реакции в соответствии со следующим сокращённым ионно - молекулярным уравнением: Fe3+ + 3OH– = Fе(OH)3. Составьте молекулярное и полное ионно-молекулярное уравнение для выбранного процесса. 155. Определите, между какими веществами возможно взаимодействие: a) NaOH и КСl; б) Сu(NO3)2 и Na2S; в) MgCl и K2SO4. Закончите молекулярное уравнение протекающей реакции. Составьте сокращённое ионно-молекулярное уравнение для неё. 156. Дана реакция: (CuOH)2SO4 + H2SO4 «2CuSO4 + 2Н2О. Напишите сокращённое ионно-молекулярное уравнение данной реакции. Определите, в какую сторону смещено равновесие данной реакции. Ответ мотивируйте. 157. Какие из приведённых ниже исходных веществ: а) Nа2СО3 и H2SO4 б) МgCО3 и HNO3; в) КНСО3 и НСl реагируют в соответствии со следующим сокращённым ионно-молекулярным уравнением: CO32– + 2H+ = CO2 + H2O. Напишите молекулярное уравнение этой реакции. 158. Напишите сокращённое ионно-молекулярное уравнение реакции: 2CrOHSO4 + H2SO4 «Сr2(SО4)3+2Н2О. Определите иобъясните, в какую сторону смещено равновесие реакции. 159. Укажите, какая из приведённых реакций и почему, протекает обратимо: a) Fe(OH)Cl2 + НСl = FеСl3 + Н2О; б) К2СО3 + 2НСl = 2 КСl + СО2 + Н2О; в) AgNO3 + НСl = AgCl + HNO3. Составьте сокращённое ионно-молекулярное уравнение обратимой реакции. 160. Какую из кислот HCN, СН3СООН, НNО3 и почему нужно взять для реакции, которая выражается следующим ионно-молекулярным уравнением: МgСO3 +2Н+ = Mg2+ + CO2 + H2O? Напишите молекулярное уравнение реакции. ГИДРОЛИЗ СОЛЕЙ При усвоении данного раздела прежде всего необходимо вспомнить получение солей; такие понятия как сила электролитов, характеризующаяся константой диссоциации Кд, а также количественные показатели гидролиза – константу гидролиза Кг, и степень гидролиза h [1…5, 10). Обратите внимание на то, что соль – продукт взаимодействия кислоты с основанием (реакция нейтрализации). В результате, в зависимости от силы электролита[1] (кислоты и основания), получается четыре типа солей (таблица).
Кг – константа гидролиза; h – степень гидролиза; Кв – ионное произведение воды; Кдосн – константа диссоциации слабого электролита (основания); Кдкисл – константа диссоциации слабого электролита(кислоты); Cm – молярная концентрация.
Пример1. Гидролиз соли I типа Докажите, что NaCl (1тип, таблица) гидролизу не подвергается.
Решение. Из четырех типов солей только три типа подвергаются гидролизу – II, III, IV. Причиной гидролиза соли является наличие в её молекуле иона слабого электролита (основания – II тип; кислоты – III тип; кислоты и основания – IV тип солей). Результат гидролиза – образование слабого электролита, малодиссоциирующего в растворе. Соль NaCl образована сильной кислотой HCl, Кд (НCl) = 107 > 1 и сильным основанием NaOH, Кд (NaOH) = 5,9 > 1 (табл. 6 приложения). Следовательно, соль NaCl относится к I типу (таблица) и не гидролизуется. В водном растворе соль диссоциирует по уравнению NaCl «Na+ + Cl–, а вода – Н2О «Н+ + ОН–. При растворении NaCl в воде ионы Na+ и Cl– c ионами H+ и OH– не образуются молекулы NaOH и HCl, так как эти соединения являются сильными электролитами и существуют в растворе только в виде ионов. Поэтому NaCl не гидролизуется.
Пример 2. Гидролиз соли II типа. По какому иону (катиону или аниону) гидролизуется соль Zn(NO3)2? Напишите молекулярное и ионно-молекулярное уравнения гидролиза соли. Докажите, что при обычных условиях гидролиз протекает только по первой ступени.
Решение. Соль Zn(NO3)2 образована слабым основанием Zn(OH)2, Zn(NO3)2 «Zn2+ + 2NO3–. Катион Zn2+, по которому гидролизуется соль, двухзарядный. Поэтому гидролиз протекает по двум ступеням. Первая ступень (молекулярное и ионно-молекулярное уравнения): Zn(NO3)2 + H2O «ZnOHNO3 + HNO3; Zn2+ + H2O «ZnOH+ + H+; рН<7. Гидролиз – процесс обратимый и зависит от концентрации соли в растворе, а также от температуры. Одной из количественных характеристик обратимого процесса гидролиза соли является константа гидролиза – Кг, чем больше Кг, тем сильнее гидролизуется соль.
Вторая ступень (молекулярное и ионно-молекулярное уравнения): ZnOHNO3 + H2O «Zn(OH)2 + HNO3; ZnOH+ + H2O «Zn(OH)2 + H+; рН<7,
гидролиз по первой ступени протекает в большей степени. Чем по второй, т.к. Кг1 > Кг2. Кроме того, накопление большего числа ионов H+ при обычных условиях, смещает равновесие в сторону образования ZnOH+ – иона, что практически подавляет гидролиз по второй ступени. Процесс гидролиза обратимый, поэтому, изменяя условия, при которых система находится в равновесии, возможно усилить или ослабить реакцию гидролиза соли (по принципу Ле Шателье). Усилить гидролиз можно разбавлением раствора или связыванием образующихся ионов OH- или H+. Поскольку реакция диссоциации воды – эндотермический процесс, т.е. протекает с поглощением тепла (DНр < 0, Qр > 0): Н2О «Н+ + ОН– – 13 кДж, то усилить гидролиз соли можно повышением температуры.
Пример 3. Гидролиз соли III типа. Вычислите константу и степень гидролиза при t = 250C для 0,1 М и 0,001 М растворов Na2SO3. Пo какому иону (катиону или аниону) гидролизуется соль? Напишите молекулярное и ионно-молекулярное уравнения гидролиза. При каких условиях гидролиз этой соли протекает в большей степени?
Решение. Соль Na2SO3 образована сильным основанием NaOH, Na2SO3 «2Na+ + SO32–. Анион SO32–, по которому гидролизуется соль, двухзарядный. Поэтому гидролиз протекает по двум ступеням. Первая ступень (молекулярное и ионно-молекулярное уравнения): Na2SO3 + H2O «NaHSO3 + NaOH; SO32– + H2O «HSO3– + OH–; рН > 7,
Другой количественной характеристикой гидролиза соли является степень гидролиза h. Степень гидролиза – это отношение числа гидролизованных молекул к общему числу растворённых молекул. Степень гидролиза h связана с константой гидролиза Кг и концентрацией раствора соотношением Кг = h2 · C. То есть, степень гидролиза возрастает с уменьшением концентрации соли.
а для С2 = 0,001 М раствора будет:
Вторая ступень (молекулярное и ионно-молекулярное уравнения): Na2HSO3 + H2O «H2SO3 + NaOH; HSO3– + H2O «H2SO3 + OH–; рН > 7,
Степень гидролиза для С1 = 0,1 М раствора будет:
При сравнении констант гидролиза (Кг1 > Кг2) каждой ступени и степеней гидролиза различной концентрации солей (h1,1 < h2,1) видно, что гидролиз по первой ступени протекает в большей степени, чем по второй. Накопление большого количества ионов ОН– при t = 250С смещает равновесие в сторону образования ионов HSO3–, что практически подавляет гидролиз по второй ступени. Усилить гидролиз в данном случае можно разбавлением раствора (h1,1 < h2,1 и h2,1 < h2,2). Кроме того, усиление гидролиза произойдет при повышении температуры или связывании ионов ОН–. Гидроксил – ионы ОН– возможно связать добавлением в раствор кислоты: HSO3– + H+ «H2SO3; H2SO3 + OH– «H2SO3 + H2O; (ионно-молекулярное уравнение) Н2О «Н+ + ОН– (ионно-молекулярное уравнение).
H2O Na2SO3 + 2HCl ® 2NaCl + H2SO3 ®
или SO32– + 2H+ ® H2SO3
В этой реакции роль основания играют ионы SO32– и HSO3–.
Пример 4. Гидролиз соли IV типа.
Каким образом гидролизуется соль CH3COONH4? Напишите молекулярное и ионно-молекулярное уравнение гидролиза соли. Определите рН этого раствора.
Решение. Соль CH3COONH4 образована слабым основанием (гидроксидом) NH4OH, В водном растворе соль CH3COONH4 диссоциирует по уравнению CH3COONH4 «NH4+ + CH3COO–. Рассмотрим отдельно гидролиз катиона и гидролиз аниона: NH4+ + H2O «NH4OH + H+, рН < 7; CH3COO– + H2O «CH3COOH + OH–, рН>7. т.е. при гидролизе катиона NH4+ образуется ион H+, а при гидролизе аниона CH3COO– – ион OH–. Ионы Н+ и ОН– при значительных концентрациях не могут сосуществовать. Они соединяются, образуя слабый электролит – воду (H2O), Образование молекул воды – более слабого электролита, чем NH4OH и СН3СООН, смещает равновесие вправо, что увеличивает гидролиз соли. Таким образом, гидролиз по катиону я гидролиз по аниону усиливают друг друга. Молекулярное уравнение гидролиза: CH3COONH4 + H2O «CH3COOH + NH4OH. Ионно-молекулярное уравнение гидролиза: CH3COO– + NH4+ «NH4OH + CH3COOH. Реакция раствора таких солей зависит от соотношения констант диссоциации кислоты и основания, образующих соль. В данном случае
Пример 5. Напишите продукты, получаемые при взаимодействии растворов хлорида железа (III) FeCl3 c карбонатом натрия Na2CO3. Решение. Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимые в воде или неустойчивые к разложению с образованием летучих продуктов, то гидролиз соли протекает необратимо, т.е. сопровождается полным разложением её. При взаимодействии водных растворов солей хлорида железа (III) FеС1з с карбонатом натрия Nа2СО3 образуется осадок Fе(OН)3 и выделяется СО2 – газ. 2FeCl3 + 3Na2CO3 + 3H2O ® Fe(OH)3¯ + 3CO2 + 6NaCl; 2Fe3+ + 3CO32– + 3H2O ® Fe(OH)3¯ + 3CO2. Происходящий процесс объясняется следующим образом. Соль FеС13, гидролизуясь по катиону, образует слабый малорастворимый электролит Fе(ОН)3. А соль Na2СО3, гидролизуясь по аниону, образует слабую кислоту Н2СО3, которая в свою очередь разлагается на воду (Н2О) и летучий продукт СО2 - газ. Процессы гидролиза по катиону и гидролиза по аниону усиливают друг друга, а образование малорастворимого соединения Fе(ОН)3 и СО2 – газа способствует необратимому полному процессу гидролиза солей.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
При решении задач в необходимых случаях следует пользоваться табл. 6 приложения.
161. Какая из предложенных солей ZnSO4, NaNO3, K3PO4 гидролизуется по катиону? Напишите молекулярное и ионно-молекулярное уравнения всех возможных ступеней гидролиза этой соли. По какой ступени, при обычных условиях, гидролиз этой соли больше? Ответ обоснуйте.
162. Какая из предложенных солей Na
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 2059; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.76.230 (0.011 с.) |

 .
. = 1/3 · 98 = 32,66 г/моль
= 1/3 · 98 = 32,66 г/моль г.
г. моль,
моль, или Сэкв(А) · Vp(A) = Cэкв(В) · Vp(B),
или Сэкв(А) · Vp(A) = Cэкв(В) · Vp(B), , отсюда
, отсюда =
= . Молярная масса KMnO4 равна
. Молярная масса KMnO4 равна  = 158 г/моль.
= 158 г/моль. ,
, ,
,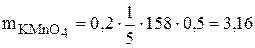 г.
г. = 0,5228 г/мл.
= 0,5228 г/мл. CO2
CO2 а. Na2CO3+2HCl = 2NaCl + H2CO3.
а. Na2CO3+2HCl = 2NaCl + H2CO3. = 1,8 · 10–16) – слабый электролит, СО2 и H2S – летучие соединения. Тогда, согласно вышеизложенному, ионно-молекулярные уравнения записываем следующим образом:
= 1,8 · 10–16) – слабый электролит, СО2 и H2S – летучие соединения. Тогда, согласно вышеизложенному, ионно-молекулярные уравнения записываем следующим образом: = 2,4 · 10–4) больше произведения растворимости РbSО4 (
= 2,4 · 10–4) больше произведения растворимости РbSО4 ( = 2,2 · 10–8), что обусловливает растворение осадка хлорида свинца и смещение химического равновесия вправо.
= 2,2 · 10–8), что обусловливает растворение осадка хлорида свинца и смещение химического равновесия вправо. = 3,4 · 10–7).
= 3,4 · 10–7).





 = 4,4 · 10-5 < 1;
= 4,4 · 10-5 < 1; 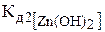 = 1,5·10-9 < 1 и сильной кислотой HNO3,
= 1,5·10-9 < 1 и сильной кислотой HNO3,  = 3,7 > 1 (табл. 6 приложения). Следовательно, соль Zn(NO3)2 относится ко II типу и гидролизуется по катиону Zn2+ (таблица). В водном растворе Zn(NO3)2 диссоциирует по уравнению:
= 3,7 > 1 (табл. 6 приложения). Следовательно, соль Zn(NO3)2 относится ко II типу и гидролизуется по катиону Zn2+ (таблица). В водном растворе Zn(NO3)2 диссоциирует по уравнению: .
.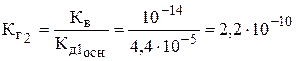 .
. = 5,9 > 1 и слабой кислотой H2SO3,
= 5,9 > 1 и слабой кислотой H2SO3,  = 1,7 · 10-2 < 1;
= 1,7 · 10-2 < 1;  = 6,2 · 10-8 < 1 (табл.6 приложения). Поэтому соль Na2SO3 относится к III типу и при t = 250C гидролизуется по иону SO32–. В данном растворе соль Na2SO3 диссоциирует по уравнению:
= 6,2 · 10-8 < 1 (табл.6 приложения). Поэтому соль Na2SO3 относится к III типу и при t = 250C гидролизуется по иону SO32–. В данном растворе соль Na2SO3 диссоциирует по уравнению: .
. ,
,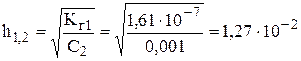 .
. .
. ,
, .
. Смещение равновесия гидролиза Na2SO3 вправо при добавлении к раствору соли кислоты (например, HCl) соответствует реакции нейтрализации:
Смещение равновесия гидролиза Na2SO3 вправо при добавлении к раствору соли кислоты (например, HCl) соответствует реакции нейтрализации: SO2
SO2 H2O
H2O .
. SO2
SO2 = 1,79 · 10–5 < 1 и слабой кислотой CH3COOH,
= 1,79 · 10–5 < 1 и слабой кислотой CH3COOH,  = 1,85 · 10–5 < 1 (табл. 6 приложения). Поэтому соль CH3COONH4 относится к IV типу и даже при обычных условиях гидролизуется до конца как по катиону, так и аниону.
= 1,85 · 10–5 < 1 (табл. 6 приложения). Поэтому соль CH3COONH4 относится к IV типу и даже при обычных условиях гидролизуется до конца как по катиону, так и аниону. , что значительно меньше
, что значительно меньше 


